高二化学-勒夏特列原理
- 格式:ppt
- 大小:325.50 KB
- 文档页数:12

第2课时温度对化学平衡的影响勒夏特列原理课程标准课标解读1.理解温度对化学平衡的影响,认识其一般规律。
2.理解温度、浓度、压强变化对化学平衡移动的影响。
3.理解勒夏特列原理并结合实际情况进行应用。
1.从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度、催化剂改变,平衡将会发生移动而建立新的平衡。
(变化观念与平衡思想)2.通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
(变证据推理与模型认知)知识01 温度变化对化学平衡的影响1.实验探究温度变化对化学平衡的影响实验步骤①取一支试管向其中加入少量CoCl2晶体,加入浓盐酸使其全部溶解;②加水至溶液呈紫色;③将上述溶液分别装于三支试管中,分别置于热水、冰水和室温下实验现象室温下试管内液体呈______;热水中试管内液体呈______,冰水中试管内液体呈______结论(平衡移动的方向)室温平衡______,温度升高平衡向______方向移动(即吸热方向),降低温度平衡向______方向移动(即放热方向)2.温度变化对化学平衡影响的规律m A(g)+n B(g)p C(g),当反应达平衡后,若温度改变,其反应速率的变化曲线分别如下图所示:(1)图①表示的温度变化是______,平衡移动方向是______方向。
(2)图②表示的温度变化是______,平衡移动方向是______方向。
(3)正反应是______热反应,逆反应是______热反应。
温度升高,平衡向____________方向移动;温度降低,平衡向____________方向移动。
3.改变温度对平衡常数的影响(1)改变温度可以使化学平衡发生移动,化学平衡常数也会发生改变,通过分析以下两个反应,总结出温度对化学平衡常数的影响规律。
①N2(g)+3H2(g)2NH3(g)化学平衡常数K1=____________,升温化学平衡向逆向移动,K1______ (填“增大”或“减小”,下同),ΔH______0(填“>”或“<”,下同)。



课前导入第09讲 勒夏特列原理知识导航化学平衡的特征:在一定条件下,当一个可逆反应达到化学平衡状态后,如果改变浓度、压强、温度等条件,化学平衡状态是否会发生变化?如何变化? 逆化学平衡状态的研究对象是可逆反应等各组分浓度/物质的量/百分含量保持不变动v 正=v 逆≠ 0,是一个动态平衡定变外界条件改变时,原平衡状态被破坏,在新条件下建立平衡一、化学平衡的移动1.定义:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。
这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
2.化学平衡移动的方向:(1)若外界条件改变,引起v正>v逆时,正反应占优势,化学平衡向正反应方向移动;(2)若外界条件改变,引起v正<v逆时,逆反应占优势,化学平衡向逆反应方向移动;(3)若外界条件改变,引起v正和v逆都发生变化,如果v正和v逆仍保持相等,化学平衡就没有发生移动。
二、浓度对化学平衡的影响实验探究——浓度对化学平衡的影响原理Fe3++3SCN-Fe(SCN)3浅黄色无色红色步骤现象a试管中溶液呈红色,b试管溶液红色_________,c试管中溶液红色_________解释(1)加入少量铁粉,发生反应__________________,使Fe3+的浓度_________,化学平衡向_________方向移动,Fe(SCN)3的浓度_________,溶液红色_________。
(2)加入KSCN溶液,SCN-的浓度_________,化学平衡向_________方向移动,Fe(SCN)3的浓度_________,溶液红色_________。
【实验结论】在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向_________方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向_________方向移动。
三、压强对化学平衡的影响实验探究——压强对化学平衡的影响知识预习原理2NO2(g)N2O4(g) (红棕色)操作用50 mL注射器抽入20 mL NO2和N2O4混合气体,将细管端用橡胶塞封闭将针筒活塞迅速推至10 mL处(压强增大)将针筒活塞从10mL处迅速拉至40 mL处(压强减小)现象气体颜色_____________________________气体颜色_____________________________解释压缩体积使压强增大时,c(NO2)瞬间________后又________,平衡向______移动增大体积使压强减小时,c(NO2)瞬间________后又________,平衡向______移动【实验结论】在其他条件不变的情况下,增大压强,平衡向气体物质的量________的方向移动;减小压强,平衡向气体物质的量________的方向移动。

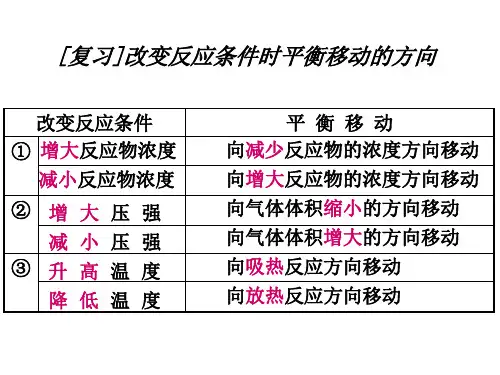
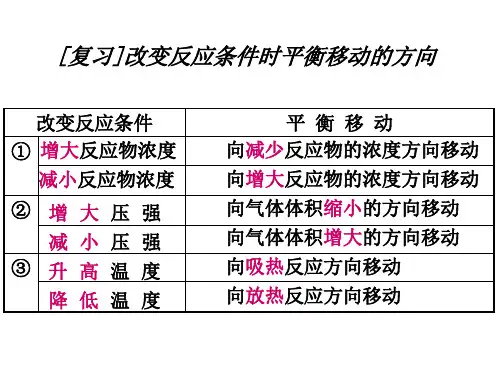
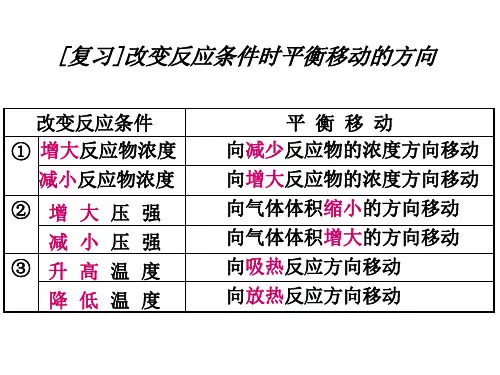
现吨市安达阳光实验学校考点5 化学平衡移动原理【考点位】本考点考查化学平衡移动原理的理解,是对勒夏特列原理的认识与用,涉及平衡的影响因素,特别注意催化剂的使用不影响平衡的移动,无法用化学平衡移动原理解释,难点为平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
【精确解读】1.化学平衡移动原理(勒夏特列原理):改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动,这就是勒夏特列原理.2.概念的理解:①影响平衡的因素只有浓度、压强、温度三种;②原理的适用范围是只有一项条件变化的情况,当多项条件同时发生变化时,情况比较复杂;③性角度:平衡移动的方向为减弱外界改变的方向;量角度:平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
【精细剖析】1.平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用;2.平衡的移动只能减弱影响平衡的因素,不能消除这个因素。
【典例剖析】下列事实不能用平衡移动原理解释的是( )A.稀释重铬酸钾溶液,溶液颜色由橙变黄B.将氯气通入NaHCO3溶液中能得到较高浓度的HClO溶液C.含有Mn2+的草酸溶液中加入酸性高锰酸钾溶液,溶液颜色更易褪去D.酸碱滴中,滴终点指示剂颜色变化【答案】C【变式训练】下列事实不能用勒夏特列原理解释的是( )A.溴水中有下列平衡Br2+H2O⇌HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅B.合成氨反(正反为放热反),为提高氨的产率,理论上采取降低温度的措施C.反CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反为放热反),达平衡后,升高温度体系颜色变深D.对于2HI(g)⇌H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深【答案】D【实战演练】1.下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )①溴水中存在化学平衡:Br2+H2O⇌HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅②铁在潮湿的空气中易生锈③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深④合成氨反,为提高氨的产率,理论上采取降低温度的措施⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)⇌K(g)+NaCl(l)⑥反CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反为放热反),达到化学平衡后,升高温度体系的颜色加深.A.①④B.②③C.②⑥D.②③⑥【答案】B【解析】A.加入AgNO3溶液后,AgNO3和HBr反导致平衡正向移动,则溶液颜色变浅,能用平衡移动原理解释,故不选;②铁在潮湿的空气中易生锈是电化学腐蚀,不是可逆反,故选;③增大压强,平衡正向移动,气体颜色变浅,但颜色加深是体积缩小,二氧化氮浓度变大,不能用平衡移动原理解释,故选;④合成氨反是放热反,降低温度平衡正向移动,提高氨的产率,故不选;⑤K为气体,减小生成物的浓度可使平衡正向移动,能用勒夏特列原理解释,故不选;⑥反CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反为放热反),达到化学平衡后,升高温度平衡逆向移动,所以二氧化氮的浓度变大,体系的颜色加深,故不选;故答案为B。
勒夏特列原理
勒夏特列(Le Chatelier, Henri Louis)(1850~1936),法国化学家。
他研究过水泥的煅烧和凝固、陶器和玻璃器皿的退火、磨蚀剂的制造以及燃料、玻璃和炸药的发展等问题。
从他研究的内容也可看出他对科学和工业之间的关系特别感兴趣,以及怎样从化学反应中得到最高的产率。
勒夏特列还发明了热电偶和光学高温计,高温计可顺利地测定3000℃以上的高温。
此外,他对乙炔气的研究,致使他发明了氧炔焰发生器,迄今还用于金属的切割和焊接。
勒夏特列原理的应用可以使某些工业生产过程的转化率达到或接近理论值,同时也可以避免一些并无实效的方案(如高炉加高的方案),其应用非常广泛。
这个原理可以表达为:“把平衡状态的某一因素加以改变之后,将使平衡状态向抵消原来因素改变的效果的方向移动。
” 换句话说,如果把一个处于平衡状态的体系置于一个压力增加的环境中,这个体系就会尽量缩小体积,重新达到平衡。
由于这个缘故,这时压力就不会增加得象本来应该增加的那样多。
又例如,如果把这个体系置于一个会正常增加温度的环境里,这个体系就会发生某种变化,额外吸收一部分热量。
因此,温度的升高也不会象预计的那样大。
这是一个包括对古尔贝格和瓦格宣布的著名的质量作用定律在内的非常概括的说法,并且它也很符合吉布斯的化学热力学原理(其实,这个说法是如此的概括,甚至可以不无风趣地用于说明人类的行为)。

利用勒夏特列原理判断化学平衡移动的方向廖秋英高二化学选修4《化学反应原理》中关于化学平衡移动的方向是以勒夏特列原理作为依据进行判断的,而这一原理在教材中的描述只有一句话“若是改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动”。
学生们在学习这一内容时往往感觉很容易,而在利用原理解决问题时却总是出差错,在实际教学中教师如能有效指导学生理解应用这一原理的方法,那么学生在应用时就不至于混乱了。
本人将自己在教学中指导学生应用原理的方法陈述如下。
一、从勒夏特列原理的文字描述中先进行要点分析。
此原理的关键词是“改变”和“减弱改变”,举出简单的改变例子,如:改变为“升高温度”,移动方向为“减弱改变”即“降低温度”,若改变为“降低温度”,移动方向为“减弱改变”即“升高温度”;可以再多举几个例子:改变为“增大压强”,移动方向为“减弱改变”即“降低压强”,改变为“减小浓度”,移动方向为“减弱改变”即“增加浓度”。
通过这样的分析,学生很容易理解原理的涵义了,接着便可趁热打铁进入下一个应用环节。
二、通过实例分析指导学生应用原理进行移动方向的判断。
以具体的反应N2+3H2——2NH3为例分析条件改变平衡将如何移动。
先详细地引导学生分析一个完整的过程,例如:若改变为“温度升高”,移动方向为“减弱改变”即“降低温度”,这时以氮气氢气合成氨为例引导学生判断降低温度的方向是“吸热方向”即“逆向”。
接着再多举几个例子让学生依据方法进行判断,若改变的是压强,如“减小压强”平衡会如何移动?若是增加氮气的浓度呢?移走部分氨气呢?学生们在一一解决这些问题后,对利用平衡移动原理判断平衡移动方向已初步掌握。
三、难点问题的分析-关于催化剂与气体分子数相等的反应变压的问题。
加入催化剂对反应的影响是“同等程度加快下逆反应的速率”,引导学生分析既然“同等”,则不会引起“改变”,从而推出平衡不会移动。
而气体分子数相等的反应变压的问题,以I2(g)+H2(g)——2HI(g)为例分析:若改变为“增大压强”,“减弱改变”则为“减小压强”,气体分子数减少则为减压方向,在此反应中有气体分子数减少的减压方向吗?学生们很快发现“没有”,由此推出此类反应的平衡不因压强改变而移动。