———N—O—2浓——度—减——小——,平衡向—正——反—应—— 方向移动
V(molL-1S-1)
V’吸 V”正 = V”逆
V正 V正= V逆 V‘放
0 V逆 t1
T 升温 编辑2版pppt
t(s)
9
小结:aA(g)+bB(g) cC(g)+dD(g) △H<0 a+b > c+d
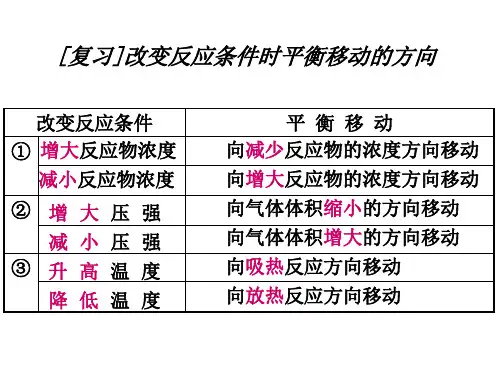
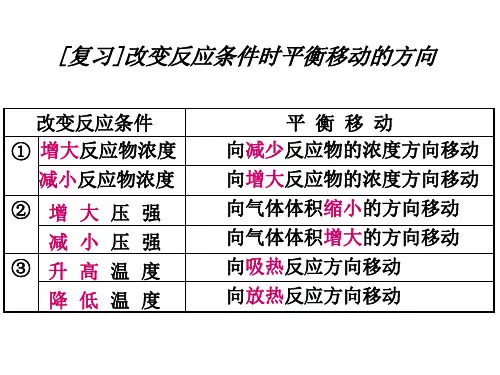
改变的条件 平衡移动的方向 平衡移动的结果
• 1、记忆改变“浓度、压强、温度”条件对化 学平衡的影响。
• 2、完成堂堂练4习题。
编辑版pppt
16
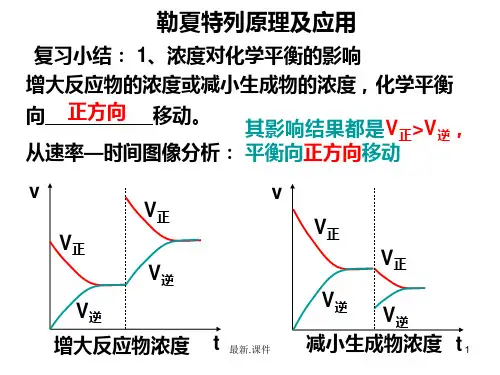
浓度对化学平衡的影响
1)、从化学反应速率角度解释
V(mol·L-1S-1)
V,正
增
大
反 应
V正
物
浓
度
V逆
V正= V逆 V’逆 平衡状态Ⅰ
V”正 = V”逆 平衡状态Ⅱ
0
t1
t 编辑版2pppt
t3
2NH3(g)反应中,压强变化和
NH3含量的关系
实验测得
压强(MPa) 1
5 10 30 60 100
NH3 %
2.0 9.2 16.4 35.5 53.6 69.4
结论: 压强增大, NH3%增大,平衡向正反应方向移动。 即压强增大, v正和 v逆同时增大,但改变倍数不同; 压强减小,v正和 v逆同时减小,但改变倍数不同。
编辑版pppt
14
2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时,
X的物质的量浓度由0.1mol/L增大到0.19mol/L,
下列判断正确的是: