外植体的选择与培养
- 格式:pptx
- 大小:3.25 MB
- 文档页数:31

外植体选择的原则外植体选取的原则是什么?1、选择优良的种质无论是离体培养繁殖种苗,还是进行生物技术研究,培养材料的选择都要从主要的植物入手,选取性状优良的种质或特殊的基因型。
对材料的选择要有明确的目的,具有一定的代表性,以提高成功的几率,增加其实用价值。
2、选择健壮的植株选取发育正常的器官或组织,再生能力强,组培易成功。
组织培养用的材料,最好是从生长健壮的无病虫的植株上选取发育正常的器官或组织。
因为这些器官或组织代谢旺盛,再生能力强,培养后比较容易成功。
此现象可能是由于外植体内部的植物激素水平能够在接种后得以维持所致。
3、选择适宜的部位植物组织培养几乎在植物体的各个部位都获得了成功,这些部位包括茎尖、茎段、皮层及维管组织、髓细胞、表皮、块茎的储藏薄壁细胞、花瓣、根、茎、子叶、鳞茎、胚珠和花药等。
但是不同种类的植物以及同一植物的不同器官对诱导条件反应是不一致的,有的部位诱导分化率高,有的部位很难脱分化,或者再分化频率很低。
4、选择适当的时期组织培养选择材料时,要注意植物的生长季节和生长发育阶段,对大多数植物而言,应在其开始生长或生长旺季采样,此时材料内源激素含量高,容易分化,不仅成活率高,而且生长速度快,增殖率高。
若在生长末期或已进入休眠期时采样,则外植体可能对诱导反应迟钝或无反应。
花药培养应在花粉发育到单核靠边期取材,这时比较容易形成愈伤组织。
百合在春夏季采集的鳞茎、片,在不加生长素的培养基中,可自由地生长、分化;而其他季节则不能。
叶子花的腋芽培养,如果在1~2月采集,则腋芽萌发非常迟缓;而在3~8月采集,萌发的数目多,萌发速度快。
对于大多数植物而言,应在其生长季节开始时采样。
在生长末期或已进入休眠期时取样,外植体可能对诱导反应迟钝或无反应,较难成活。
5、考虑器官的生理状态和发育年龄一般认为,生理年龄小的幼嫩组织较生理年龄大的成熟衰老组织具有较高的形态发生能力。
随着组织年龄的增加,器官的再生能力逐渐减弱甚至完全失去再生能力。

《植物组织培养技术》知识清单一、什么是植物组织培养技术植物组织培养技术是一种在无菌条件下,将植物的离体器官、组织或细胞等培养在人工配制的培养基上,使其生长、分化并发育成完整植株的技术。
这项技术的核心在于创造一个适宜的环境,让植物细胞能够像在体内一样进行分裂、生长和分化,从而实现植物的快速繁殖、品种改良以及基因工程等多种应用。
二、植物组织培养技术的基本原理植物细胞的全能性是植物组织培养的理论基础。
这意味着每个植物细胞都包含着该植物的全部遗传信息,在一定条件下具有发育成完整植株的潜力。
细胞分化则是细胞在发育过程中逐渐形成不同形态和功能的过程。
在组织培养中,通过调节培养基的成分和培养条件,可以控制细胞的分化方向,使其按照我们的需求发育成特定的组织或器官。
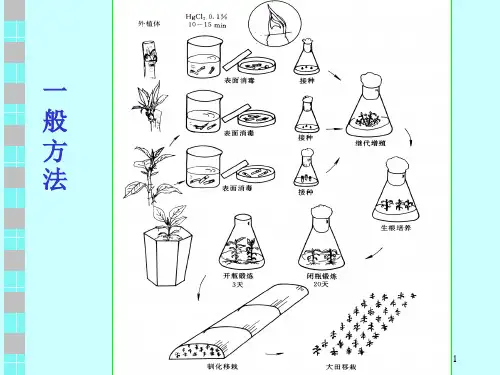
三、植物组织培养技术的流程1、外植体的选择与消毒外植体是指用于培养的植物器官、组织或细胞。
常见的外植体有茎尖、叶片、花药等。
在选择外植体时,要考虑其来源的植物品种、生长状态和健康程度。
消毒是非常关键的一步,通常使用酒精、升汞等消毒剂对外植体进行处理,以去除表面的微生物,确保培养过程不受污染。
2、培养基的配制培养基是为植物细胞提供营养和生长条件的物质。
它包含大量元素、微量元素、有机成分、植物生长调节剂等。
不同的植物种类和培养目的需要不同的培养基配方。
例如,诱导愈伤组织形成的培养基和诱导芽分化的培养基成分就有所不同。
3、接种在无菌条件下,将消毒后的外植体接种到培养基上。
操作过程要迅速、准确,避免外植体受到污染。
4、培养接种后的外植体需要在适宜的温度、光照和湿度条件下进行培养。
培养过程中要定期观察,及时处理出现的污染、褐化等问题。
5、诱导分化根据培养目的,通过调整培养基成分和培养条件,诱导外植体分化形成芽、根或愈伤组织等。
6、植株再生当分化形成的芽和根发育成熟后,将其转移到生根培养基上,促进根系的生长,最终形成完整的植株。
7、炼苗与移栽再生的植株需要经过一段时间的炼苗,使其逐渐适应外界环境。


植物组织培养的完整过程1.选择适宜的母体植物:选择具有优良性状和抗病虫害能力的母体植物,从中选择健康的叶片、茎段等组织作为外植体。
2.外植体的准备:将母体植物采集的叶片或茎段进行无菌处理,去除表面杂菌和泥沙,然后用75%酒精或漂白粉消毒外表。
3.外植体的切割:将无菌环境下的外植体切割成小片,大小约为0.5-1cm,同时尽量保持外植体的干燥,以防止外植体内部水分过多。
4.外植体的接种:将切好的外植体小片接种在含有植物生长激素的无菌培养基上。
培养基通常由无机盐溶液、有机源、糖和植物生长激素等组成,植物生长激素的种类和浓度会影响到后续培养过程中的分化和增殖。
5.分化:外植体接种到培养基后,会经历分化阶段,外植体的组织逐渐增殖和分化为不同种类的细胞,形成生长点。
6.增殖:通过定期的次级培养,子培养、分生器、病毒消除等手段,将外植体中的细胞不断分化和增殖,以便大量生产幼苗。
7.再分化:经过增殖后的外植体,可以再次进行分化,形成茎尖、腋芽或花蕾等器官,以便进一步培养和繁殖。
8.根的诱导:在合适的培养条件下,外植体可以诱导生成根系,这是为了使外植体脱离体外培养环境,继续生长的必要步骤。
9.移栽:当幼苗的根系已经发达足够,可以将外植体移栽到含有适宜营养成分的固体培养基上或直接移植到土壤中,进行实地管理和生长。
10.过程控制:在整个培养过程中,要控制好环境条件,例如温度、湿度和光照等,以保证培养的成功率。
11.病毒清除:植物组织培养中经常伴随着病毒感染问题,可以通过不同的方法对外植体和培养基进行检测和清除,以保证获得健康的植株。
总的来说,植物组织培养是一个复杂的过程,需要严格的无菌操作和合适的培养条件。
它广泛应用于植物的繁殖、遗传改良、新品种选育以及病毒和细菌的清除工作中,对推动植物学研究和农业生产具有重要的意义。

植物细胞培养的原理
植物细胞培养是通过无菌条件下将植物的组织或细胞分离培养在适当的培养基上进行培养的一种方法。
其原理主要包括以下几个方面。
1. 选择合适的外植体:外植体是指从植物体中取出的组织或器官,如茎尖、芽体、种子等。
合适的外植体应具有较高的再生能力和愈伤组织形成能力,能够在培养基中生长和分化。
2. 建立无菌培养条件:植物细胞培养必须在无菌条件下进行,以防止微生物的污染。
通过在实验室中进行严格的无菌操作,如使用无菌器具、灭菌培养基和无菌操作箱等,可以保证培养过程的无菌性。
3. 选择适当的培养基:培养基是植物细胞培养的基础,提供细胞所需的营养物质和生长因子。
根据不同的外植体和培养目的,可以选择不同种类的培养基,如MS培养基、B5培养基等。
培养基中通常含有碳源、氮源、植物生长调节剂等。
4. 调控生长因子的含量:植物细胞培养中的生长因子包括植物激素等,它们可以调控细胞的生长和分化。
通过合理调节生长因子的浓度和比例,可以促进细胞的再生和组织的发育。
5. 培养条件的控制:植物细胞培养需要控制适当的培养温度、光照和湿度等条件,以提供良好的生长环境。
这些条件的变化可以影响细胞的代谢活性和生长速率。
通过以上原理的应用,可以使植物组织或细胞在无菌培养条件下获得新的营养和生长环境,从而实现细胞分裂、再生和分化,为后续的研究和应用提供基础。


植物组织培养的工作流程
植物组织培养是一种常用的植物繁殖和研究方法,其工作流程包括以下几个主要步骤:
1.材料准备:选择适宜的原植物材料,如茎段、叶片、种子等作为外植体。
确保材料的新鲜性和无病原体污染。
2.表面消毒:将外植体进行表面消毒,以去除表面的微生物和杂质。
这可以通过在消毒剂(如酒精、次氯酸钠等)中浸泡、搅拌等方法进行。
3.分离和切割:根据实验需求,将外植体切割成适当大小的组织片段。
可以使用手工切割、离心分离或显微镜下的操作等方法进行。
4.培养基制备:制备适合植物生长和繁殖的培养基。
培养基通常包括基本盐、有机物、维生素、植物激素和其他添加剂。
根据实验需求可以调整培养基成分。
5.外植体接种:将分离和切割好的外植体进行培养基中的接种。
接种可以通过将外植体直接放置于培养基上或将其插入培养基中的凝胶(如琼脂)中进行。
6.培养条件控制:对培养的温度、光照、湿度和气体条件进行控制。
这些条件可以根据不同植物的生长习性和实验要求进行调整。
7.植物增殖和分化:在培养基中,外植体会通过分裂、再生和分化等过程进行植物增殖和不同类型的器官分化。
植物激素的添加和培养条件的调整可以影响生长和分化的过程。
8.增殖体移栽:将培养的增殖体转移到新的培养基或固体培养基中,以促进继续生长和发育。
9.实验分析:通过观察、记录和分析培养组织的生长情况、形态特征、遗传表达等参数,进行实验结果的分析和研究。



半夏块茎外植体的分离、接种和培养需要注意的点一、分离1.选择健康的半夏块茎在分离外植体之前,需要选择外表无病斑,质地坚实,具有一定营养价值的半夏块茎作为外植体的来源。
只有健康的半夏块茎才能保证外植体的生长和培养成功。
2.消毒在分离外植体之前,需要对半夏块茎进行消毒处理,以避免外植体在分离过程中受到细菌和病毒的侵害。
常用的消毒方法包括漂白粉浸泡、酒精消毒等。
3.分离外植体将经过消毒处理的半夏块茎切割成小块,然后用无菌手术刀将外植体分离出来。
分离过程需要在无菌条件下进行,以保证外植体的无菌状态。
二、接种1.选择合适的培养基在接种外植体之前,需要选择合适的培养基进行培养。
培养基的选择应考虑外植体的生长需求,包括营养成分、pH值、激素等。
2.无菌操作在接种外植体的过程中,需要在无菌条件下进行,避免细菌和病毒的侵害。
使用无菌技术和无菌器具进行操作,确保外植体的无菌状态。
3.接种外植体将分离好的外植体放置在培养基上并轻轻压实,然后进行培养。
接种过程需要轻柔,避免外植体的损伤。
三、培养1.温度和光照在外植体培养的过程中,需要注意控制温度和光照条件。
根据外植体的生长需求,保持适宜的温度和光照条件,促进外植体的生长和分化。
2.营养外植体在培养的过程中需要充足的营养供应。
根据外植体的生长阶段和特点,调整培养基的营养成分,保证外植体的正常生长。
3.无菌管理在外植体培养的过程中,需要进行严格的无菌管理,避免细菌和病毒的侵害。
定期对培养器皿和培养环境进行消毒和无菌处理,确保外植体的无菌状态。
结语半夏块茎外植体的分离、接种和培养是一项复杂的过程,需要严格的无菌操作和专业的技术支持。
只有在合适的环境和条件下进行培养,才能保证外植体的正常生长和分化,最终获得高质量的植株。
希望以上的指导能帮助大家更好地进行半夏块茎外植体的分离、接种和培养工作。
半夏块茎是一种常见的中药材,对其外植体的分离、接种和培养过程进行合理的操作和管理,能够有效地提高外植体的存活率和快速生长,进而获得高质量的植株。
一、实训目的本次实训旨在通过实际操作,学习并掌握植物组织培养技术中的外植体选择、消毒、接种和培养等基本步骤,了解外植体培养过程中的注意事项,提高实验室无菌操作技能,为后续的植物组织培养研究打下基础。
二、实训时间2023年11月1日至2023年11月5日三、实训地点植物组织培养实验室四、实训内容1. 外植体的选择与采集- 根据培养目的和植物特性,选择生长健壮、无病虫害的植株作为外植体来源。
- 采集外植体时,注意选取具有再生能力的部位,如茎尖、叶片、茎段等。
2. 外植体的预处理- 对采集的外植体进行表面消毒,常用70%酒精和氯化汞溶液交替消毒。
- 将消毒后的外植体放入无菌水中清洗,去除残留的消毒剂。
3. 外植体的接种- 在无菌操作条件下,将处理好的外植体切割成适宜大小(如茎尖1-2mm,叶片0.5-1cm²等)。
- 将切割好的外植体接种到预先配制好的培养基上。
4. 培养基的配制与灭菌- 配制MS培养基,包括大量元素、微量元素、铁盐、植物激素等。
- 将培养基分装到试管中,高压蒸汽灭菌。
5. 外植体的培养- 将接种后的试管放入培养箱中,设置适宜的温度、光照和湿度条件。
- 定期观察外植体的生长状况,记录培养过程中的变化。
五、实训结果与分析1. 外植体生长情况- 在培养过程中,部分外植体成功诱导出愈伤组织,部分外植体生长出芽苗。
- 成功诱导愈伤组织的外植体在培养基表面形成白色或黄色的愈伤组织,质地较软。
- 成功诱导芽苗的外植体在培养基表面形成绿色或紫色的芽苗,芽苗生长旺盛。
2. 影响因素分析- 外植体的选择与采集:选择生长健壮、无病虫害的植株作为外植体来源,有利于提高培养成功率。
- 外植体的预处理:消毒处理要彻底,避免残留的消毒剂影响外植体的生长。
- 培养基的配制与灭菌:培养基的营养成分要均衡,灭菌要彻底,避免杂菌污染。
- 培养条件:温度、光照和湿度等培养条件要适宜,有利于外植体的生长。
六、实训总结通过本次实训,我们掌握了植物组织培养技术中外植体的选择、消毒、接种和培养等基本步骤,了解了外植体培养过程中的注意事项。
愈伤组织培养一、外植体的选择愈伤组织培养的第一步是选择适当的外植体。
外植体可以是植物的根、茎、叶、花、果实等任何部分,但必须具有分生能力。
通常,选择新鲜、健康的幼嫩组织作为外植体,因为这些组织分生能力强,容易诱导出愈伤组织。
同时,外植体的选择还必须考虑其遗传背景、生理状态以及是否容易进行消毒等。
二、愈伤组织的诱导外植体在适当的培养基和条件下,能够被诱导形成愈伤组织。
这个过程涉及到细胞的脱分化,即细胞从特定的组织类型转变成未分化的状态。
为了成功诱导出愈伤组织,需要使用含有足够营养物质和植物生长调节物质的特殊培养基。
例如,高浓度的生长素和细胞分裂素可以促进细胞分裂和组织形成。
三、愈伤组织的增殖诱导出的愈伤组织需要在适合的培养基中进一步增殖。
这个过程需要持续监控并调整培养基的成分,以确保愈伤组织能够快速、健康地生长。
同时,还需要控制培养条件,如温度、光照、湿度等,以提供最佳的生长环境。
四、细胞分化的诱导增殖后的愈伤组织可以进行进一步的分化。
这个过程可以通过改变培养基的成分或添加特定的生长调节物质来实现。
例如,某些激素可以诱导愈伤组织分化成特定的组织或器官。
五、遗传稳定性的维持为了保持愈伤组织的遗传稳定性,通常需要进行长期的培养和多代的筛选。
这个过程可以通过定期检查染色体数目和结构来实现,以确保细胞的遗传稳定性。
同时,通过定期进行克隆繁殖,可以进一步维持细胞的遗传稳定性。
六、培养基的选择与优化愈伤组织培养的成功与否,很大程度上取决于培养基的选择和优化。
培养基是愈伤组织获取营养的来源,必须含有细胞生长所需的各类营养物质,如碳源、氮源、维生素、矿物质等。
同时,还需要添加植物生长调节物质,如生长素、细胞分裂素等,以调节细胞的生长和分化。
对于不同的外植体和实验目的,可能需要选择不同的培养基。
例如,MS、N6、B5等都是常用的培养基配方。
此外,培养基的pH值、渗透压等也需要进行适当的调整。
为了优化培养基,通常需要进行一系列的试验和筛选,以找到最适合特定组织或细胞的培养基配方。
蝴蝶兰的组织培养技术蝴蝶兰的组织培养技术蝴蝶兰为兰科多年生附--生草本,又名蝶兰,是兰科植物中栽培最为广泛的种类之一,主要分布在热带及亚热带地区。
其花形奇特,色彩艳丽,花期持久,素有“兰中皇后”的美誉,具有极高的观赏和经济价值,在国内外花卉市场上极受欢迎。
蝴蝶兰是单茎气生兰,植株上极少发育侧枝,比其他种类的兰花更难于进行常规无性养殖。
组织培养是建立蝴蝶兰快速养殖无性系的重要手段。
1 外植体的选择蝴蝶兰的茎尖、茎段、叶片、花梗侧芽、花梗节间、根尖等部位都已有培养成功的报道,方法各异,难度各有高低。
蝴蝶兰不同外植体的成活率有差异,其中花梗侧芽的成活率最高,达75%;其次为花梗,成活率为 62.5%;叶片和根尖最差,分别为12.5%和 7.5%。
针对不同外植体,取材方法也不同,通常取花梗节之间1~2cm长的幼嫩部分,切取长 2~3mm 的切段作为外植体。
2 基本培养基的选择蝴蝶兰组织培养所采用的基本培养基包括 MS、1/2MS、VW、B5、KC、花宝及其改良型等,其中1/2MS对蝴蝶兰原球茎增殖效果最好。
3 外源激素的选择目前常使用的外源激素主要是生长素类(如IAA、2,4-D和NAA)和细胞分裂素类(如BA、ZT、KT)。
蝴蝶兰组织培养中常用的细胞分裂素为 6-BA,较高浓度(1~8mg/L)的 6-BA 能促进蝴蝶兰原球茎增殖,较低浓度(0.1~0.5mg/L)的 6-BA 则能促进原球茎分化。
适宜浓度的 6-BA 配合较低浓度的 NAA,更有利于原球茎的增殖,2.0mg/L 6-BA 和 0.3mg/L NAA配合使用是蝴蝶兰原球茎增殖的最佳组合。
4 培养基添加物对蝴蝶兰增殖和分化的影响蝴蝶兰组织培养中常加入一些天然物质如椰乳、香蕉泥、番茄汁、苹果汁等,这些物质能提供一些必要的微量营养成分、生理活性物质和生长激素等,如加入100~200mg/L香蕉泥,具有较大的 pH 缓冲作用,有利于兰科植物的壮苗和生根。