金银花愈伤组织的诱导及继代培养研究
- 格式:pdf
- 大小:508.11 KB
- 文档页数:4

摘要:为了加快金银花产业的发展。
提高金银花的繁殖系数,避免生态环境被破坏。
以药用金银花的当年生幼叶为外植体,用MS基本培养基。
通过不同的生长激素和细胞分裂素浓度梯度,筛选适合的培养浓度和培养条件。
实验结果表明,随着培养基中6-BA浓度的升高,褐变率随之提高,褐变现象出现的时间也越早;反之,较低浓度的6-BA适宜幼叶的分化生长,褐变反应慢。
另外,培养时间过长,未及时转接,也出现了褐变现象。
采用3×3(6-BA,NAA各3个平行组)正交实验的方法,找出最优水平组合,得出最佳的激素配比组合。
培养条件:26℃恒温培养,光照1200lx。
实验结果表明,诱导愈伤组织的增殖最佳培养基:MS+6-BA0.5mg/L+NAA0.5 mg/L;诱导芽分化的最佳培养基:MS+6-BA1.0 mg/L+NAA0.1 mg/L。
关键词:金银花;外植体;生长激素;细胞分裂素AbstractTo quicken the development of Honeysuckle industry, improve the proliferation rate of Honeysuckle, avoid the damage of ecological environment, we choose current-year-young leaves of Jiangsu medicinal Honeysuckle to establish aseptic system for explants.In the whole cultivation process, we choose MS medium. The disinfection method: 1.Sterilization with alcohol of 75% concentration for 45s, 2.Sterilization with HgCl2 of 0.15% concentration for 8min, 3.Washing with aseptic water for 4 or 5 times, 4.Drying with aseptic filter paper.There two kinds of medium: with activated carbon and without activated carbon. Experimental results demonstrated that a little of activated carbon can decrease Browning. With comparison of different cultivation time and concentration of growth hormone(NAA) and cytokinin(6-BA), we discover that the higher of the 6-BA concentration, the higher Browning rate and the earlier of Browning. On the contrary, young leaves growth better and later Browning with lower concentration of 6-BA. We also found Browning with too long cultivation time. By 3×3 Orthogonal Experiment, We find optimal combination of hormone. Cultivation environment: constant temperature with 26℃, light irradiaton 1200lx. The main results: 1.The best multiplication medium for callus: MS+6-BA0.5mol/L+NAA0.5 mol/L.2. The best medium for meristtem culture: MS+6-BA1.0 mol/L+NAA0.1 mol/L.Key words: Honeysuckle, aseptic system, growth hormone, cytokinin1 前言1.1形态特征及生物学特征金银花(拉丁学名:Lonicera Japonica,英文名:Japan-ese Honeysuckle)别称:忍冬、金银藤、银藤、二色花藤、二宝藤、右转藤、子风藤、鸳鸯藤。

(完整)第三章-愈伤组织诱导编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)第三章-愈伤组织诱导)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)第三章-愈伤组织诱导的全部内容。
第三章愈伤组织的诱导与培养第一节愈伤组织的诱导与继代培养愈伤组织(callus): 在培养基上,由外植体经脱分化和细胞分裂形成的一团无序生长的薄壁细胞。
大部分外植体细胞须经脱分化形成愈伤,才能再分化成完整植株,只有茎尖等少数细胞只恢复为分生状态但不分裂,直接再分化。
愈伤组织的诱导与分化是植物组培的基本环节。
一、愈伤组织的诱导及其形态特征1、愈伤组织的诱导1)起动期/诱导期(initiation/induction stage, Induction of growth)外植体细胞在外源激素作用下,经脱分化而恢复分裂状态,开始形成愈伤。
细胞外观无明显变化,代谢旺盛,合成加强,为分裂做准备.持续十几小时~几天。
2)分裂期(divition stage/phase):外植体切口边缘膨大,外层细胞迅速分裂,体积变小,具分生细胞的特征,细胞数速增。
3)形成期(formation stage/Differentiation phase):外植体表层细胞分裂减缓,内部细胞开始分裂,大量细胞形成瘤状/泡状或片状结构。
若不及时继代,将分化出拟分生组织瘤状物和维管组织,又称分化期。
2. 愈伤组织的形态特征质地:松脆易碎的颗粒状;紧密坚实的结块状;水渍或浆糊状。
颜色:白色或淡黄色;淡绿色或绿色;黄色至褐色。
一般,淡黄或淡绿/绿色松脆(近圆形)或致密的颗粒状愈伤再生能力较强,白色/灰白色或黄褐色、浆糊状或紧实(香蕉形)的愈伤再生能力差。
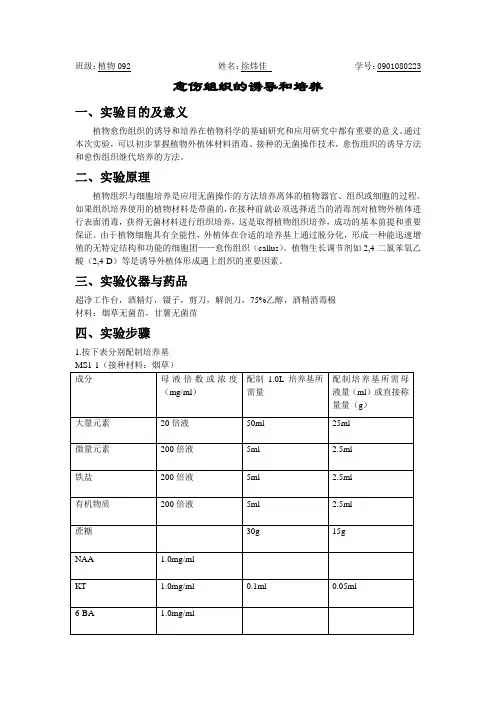
班级:植物092 姓名:徐炜佳学号:0901080223愈伤组织的诱导和培养一、实验目的及意义植物愈伤组织的诱导和培养在植物科学的基础研究和应用研究中都有重要的意义。
通过本次实验,可以初步掌握植物外植体材料消毒、接种的无菌操作技术,愈伤组织的诱导方法和愈伤组织继代培养的方法。
二、实验原理植物组织与细胞培养是应用无菌操作的方法培养离体的植物器官、组织或细胞的过程。
如果组织培养使用的植物材料是带菌的,在接种前就必须选择适当的消毒剂对植物外植体进行表面消毒,获得无菌材料进行组织培养,这是取得植物组织培养,成功的基本前提和重要保证。
由于植物细胞具有全能性,外植体在合适的培养基上通过脱分化,形成一种能迅速增殖的无特定结构和功能的细胞团——愈伤组织(callus)。
植物生长调节剂如2,4-二氯苯氧乙酸(2,4-D)等是诱导外植体形成遇上组织的重要因素。
三、实验仪器与药品超净工作台,酒精灯,镊子,剪刀,解剖刀,75%乙醇,酒精消毒棉材料:烟草无菌苗,甘薯无菌苗四、实验步骤1.按下表分别配制培养基将配置的四种培养基分别分装入20个培养瓶,高温灭菌后水平放置凝固2.接种前,将实验所需器具放入超净工作台,打开紫外灯灭菌20~30min,关闭紫外灯,开启通风开关。
洗手后用酒精喷洒消毒手、手臂、实验材料及培养基外部等进入超净工作台的部分。
进入超净工作台,用酒精棉擦拭台面(手勿伸出工作台),台面完全风干后点燃酒精灯。
3.接种开始时,将镊子及手术刀在酒精中浸泡,并在酒精灯外焰上烧炽片刻,充分冷却。
取幼嫩的烟草(甘薯)叶片,用手术刀切割成小片,再用镊子将其接种至相应的培养基上,每瓶接种3~5片,封口后取出超净工作台,标注姓名、日期、培养基和接种材料。
4.将上述培养材料常温暗培养,每隔7天观察一次,并记录培养情况五、实验结果组织长芽,而当生长素含量大于细胞分裂素含量时,二者共同作用在室温下可诱导外植体生成不定根,也可形成愈伤组织,细胞色素沉淀情况严重;NAA为植物生长素,6-BA为细胞分裂素,促进扦插生根,而当细胞分裂素含量大于生长素含量时,二者共同作用在室温下可诱导外植体生成不定芽,此次实验由于温度非形成愈伤组织的最适温度,所以未形成完整的愈伤组织细胞团。


外植体类型和植物生长调节剂浓度对红金银花愈伤组织诱导的影响摘要:以红金银花(Lonicera japonica var. chinensis)顶芽、当年生幼茎和叶片为试验材料,利用仿自然气候的培养条件,采用L9(34)正交试验设计,考察了外植体类型和培养基中添加植物生长调节剂的浓度对愈伤组织诱导的影响。
结果表明,外植体类型对红金银花组织培养的污染率及愈伤组织的诱导率均有影响,以顶芽为外植体时污染率低,愈伤组织诱导率高,为最佳外植体。
优化后的愈伤组织诱导培养基中KT、6—BA、α—NAA浓度分别为1.5、1.5、0.5 mg/L。
关键词:红金银花(Lonicera japonica var. chinensis);外植体类型;植物生长调节剂;愈伤组织;正交试验金银花(Lonicera japonica Thund.)又名忍冬,是忍冬科忍冬属多年生半常绿藤本植物,是一种珍贵的观赏树种和绿化材料,也是临床常用中草药,具有清热解毒、凉散风热之功效[1]。
红金银花(L. japonica var. chinensis)为忍冬科忍冬属木本植物,是金银花的野生变种。
其枝、叶、茎淡紫色,叶久寒而不落,花蕾红色,香味浓郁,且生长快、适应性强、耐旱、耐涝、耐寒、耐瘠薄,是集药用、观赏、水土保持于一体的优良品种[2]。
目前,生产上金银花和红金银花的主要繁殖方式是扦插,也可用种子繁殖,关于金银花的组织快繁已有少量报道[3—5],而红金银花相关方面的研究则较少[6,7]。
为加快红金银花的繁育,探讨了外植体类型和植物生长调节剂浓度对红金银花愈伤组织诱导的影响,旨在优化红金银花的组培快繁技术,为红金银花工厂化育苗和规模化栽培提供技术参考。
1 材料与方法1.1 供试材料红金银花当年生幼嫩枝条采自河南省封丘县金银花基地。
1.2 实验方法将取回的红金银花枝条置于水槽中,用软毛刷刷洗表面尘土,无菌水反复冲洗干净,剪取顶芽部位,保留幼茎和叶片。

探讨影响金银花组织再生率的因素金银花,又称忍冬花,是一种常见的藤本植物,被广泛用作中药材和观赏植物。
其具有清热解毒、清肺润喉、凉血止血等药用价值。
金银花也具有较强的再生能力,能够快速生长并繁衍。
金银花组织再生过程受到多种因素的影响,这些因素对金银花再生率产生重要影响。
本文将探讨影响金银花组织再生率的因素,以期为金银花的再生及优化生产提供参考。
一、遗传因素金银花的再生能力与其遗传因素密切相关。
在金银花的种质资源中,存在着不同的遗传变异类型,这些遗传变异类型对金银花的再生能力有着显著影响。
有的品种再生率高,能够在较短时间内快速生长;而有的品种则再生率低,需要较长时间才能恢复生长。
在金银花的繁育过程中,应选择再生率高的优良品种进行繁育,以提高金银花的再生率和生长速度。
二、生长环境因素金银花的生长环境对其组织再生率亦有重要影响。
光照、温度、湿度等环境因素是影响金银花再生率的重要因素。
充足的光照能够促进金银花的光合作用,提高其再生率;适宜的温度和湿度则有利于金银花组织的生长与分化。
在金银花的生长过程中,应合理调控其生长环境,为其提供适宜的光照、温度和湿度条件,以提高其再生率。
三、培养基因素培养基是植物体外再生的重要基础,对金银花组织再生率同样具有重要影响。
培养基的成分、pH值、激素浓度等因素会直接影响金银花的再生能力。
过高或过低的激素浓度会抑制金银花的再生,而适宜的激素浓度则能够促进金银花的组织再生。
在金银花的组织培养过程中,应合理设计培养基的成分及配比,以提高其再生率。
四、激素因素五、外界刺激因素外界刺激因素对金银花的再生率也有着重要影响。
外界刺激因素包括机械刺激、生物刺激和化学刺激等多种类型,这些刺激因素能够诱导金银花的再生。
机械刺激能够促进金银花的愈伤组织再生;生物刺激如植物激素或外源基因的引入亦能够促进金银花的再生。
在金银花的再生过程中,可以通过合理引入外界刺激因素的方式来提高其再生率。
影响金银花组织再生率的因素包括遗传因素、生长环境因素、培养基因素、激素因素和外界刺激因素。


红金银花组织培养试验研究世界上忍冬属植物有200多种,我国有98种,约占世界总数的50%,其中以西南部为主产区。
金银花生长快,寿命长,其生理特点是更新性强,老枝衰退新枝很快形成。
红金银花是金银花的变种,花蕾、叶、茎均为红色,花蕾为红色,花开后变成红、黄、白相间,赏心悦目,花色艳丽,香味浓郁。
该试验对红金银花的组织培养试验进行了研究,为红金银花在山东地区乃至全国快速推广应用,发挥其园林绿化功能,提供了基础性和技术性支持。
1 材料和方法1. 1 材料试验所用材料为当年生红金银花中、上部的枝条,采集时间是春季,取自青岛平度地区。
将取回的红金银花枝条放入水槽中,用软毛刷刷洗枝条的表面,自来水冲洗,将尘土冲洗干净。
剪取顶芽部位1. 0~2. 0 cm,放入洗涤液或洗衣粉溶液中浸泡15~20 min ,再用自来水将洗涤液冲洗干净。
在超净工作台下,先用75 %的酒精浸泡30 s ,用无菌水冲洗1~2次,再用0. 2 %的升汞溶液灭菌3~5 min ,用无菌水冲洗5~6 次。
备用。
1. 2 方法切取已经灭菌的红金银花顶芽部位1.0~2.0cm作为外植体,接种到以MS 为基本培养基,添加0.5、1.0、2.0、4.0 mg/L的6-BA 和0、0.1、0.2、0.4 mg/L 的NAA以及10、20、30、40 g/L的蔗糖的初代培养基上。
当初代培养的芽长到3.0~4.0cm 时,将其转接到以MS 为基本培养基,同时添加1.0、1.5、2.0 mg/L的继代培养的6-BA和0.1、0.2、0.4mg/L的NAA以及0、0.5、1.0mg/L的GA3基上。
另添加LH0.2g/L,蔗糖20.0g/L。
当继代培养的芽生长较健壮(高4.0~5.0 cm) 后,先将其从基部切下转接到只含MS的空白培养基上,培养1周后再接到生根培养基上,生根培养基以1/2MS为基本培养基,同时添加0、0.25、0.5mg/L的6-BA 和0.5、1.0、2.0mg/L的NAA以及0、1.0、2.0g/L的活性炭。

2012年第04期(总第266期)吉 林 农 业JILIN AGRICULTURENO.04,2012(CumulativetyNO.266)金银花的组织培养与快速繁殖文清岚,黄修林(桂林市林业科学研究所,广西桂林 541004)摘要:金银花作为一种清热解毒的良药,在我国乃至世界医药领域应用广泛。
巨大的市场需求催生了对金银花的快速繁殖技术研究步伐,通过组织培养技术对金银花进行快速繁殖已经取得了一定的进展,在保护金银花的物种纯度以及繁育的速度上已经达到了一定的水平,文章在研究现有的关于金银花的组织培养的基础之上,总结了金银花组织培养的具体步骤,以及在快速繁殖过程中应该注意的问题。
关键词:金银花;繁殖;培养技术中图分类号:S687 文献标识码:A 文章编号:1674-0432(2012)-04-0197-21 金银花的生长特性植物金银花又名忍冬,为忍冬科多年生半常绿缠绕木质藤本植物。
“金银花”一名出自《本草纲目》,由于忍冬花初开为白色,后转为黄色,因此得名金银花。
金银花的原产地在中国,在金银花的生长过程中适应能力较强,在我国的每个省份都可以生长。
金银花喜阳、耐阴,耐寒性强,也耐干旱和水湿,对土壤要求不严,但以湿润、肥沃的深厚沙质壤上生长最佳,同时对土壤的酸碱度的适应性也比较强,在酸碱等环境下都能正常生长。
2 目前金银花快速繁殖的主要技术2.1 扦插繁殖扦插繁殖,就是将金银花的枝条同金银花植株进行分离后,种植于土壤,让其在土壤中生根发芽,扦插繁殖所选用的枝条的成熟程度不同,可以选择充分木质化的枝条进行繁殖,也可以选择未经过充分木质化的枝条进行繁殖。
2.2 压条繁殖压条繁殖通天扦插繁殖的方法相似,区别就在于压条的枝条不与金银花的植株分离,在生根发芽的过程中,还可以从金银花的植株吸取养分,待其生根发芽后在与母体分离。
2.3 分株繁殖分株繁殖的方法就是在金银花营养生长阶段,在水肥充足的情况下,促进其植株的生长,根部分蘖较多,或者是植株的枝蔓生长的较多,然后将这些枝蔓或者分蘖后的根芽进行分离,在种植于土壤当中的繁殖方法。

金银花抗感染作用研究进展【摘要】本文主要探讨了金银花在抗感染领域的研究进展。
在介绍了金银花的概述和其在抗感染中的作用。
在详细分析了金银花提取物对病毒、细菌和真菌感染的抑制作用研究,以及金银花在临床上的应用和未来的发展前景。
结论部分总结了金银花作为抗感染药物的潜力,提出了金银花在医药领域的重要性和未来研究的发展方向。
综合研究结果表明,金银花具有显著的抗感染效果,有望成为重要的抗感染药物,并为医药领域带来重要的发展机遇。
【关键词】金银花, 抗感染, 病毒感染, 细菌感染, 真菌感染, 临床应用, 前景展望, 潜力, 医药领域, 发展方向。
1. 引言1.1 金银花的概述金银花,学名忍冬藤,为忍冬科植物,是一种常见的中药材和中药原料。
金银花有着白色或淡黄色的花朵,花形美丽,具有香气扑鼻的特点,被广泛用于中药和食疗中。
金银花的主要产地包括中国、印度和南美洲等地区。
在中医传统中,金银花被认为有清热解毒、解表散风的功效,常用于治疗风热感冒、咽喉肿痛、疮疖肿痛等症状。
金银花中含有多种活性成分,如黄酮类、挥发油、维生素C等,这些成分赋予了金银花抗炎抗菌的作用。
1.2 金银花在抗感染中的作用1. 抑制病毒复制:多项研究表明,金银花提取物对多种病毒的复制有一定的抑制作用,包括流感病毒、呼吸道合胞病毒等。
其抗病毒作用可能通过干扰病毒复制过程、增强机体免疫等方式发挥。
2. 抗细菌作用:金银花提取物对多种细菌具有一定的抑制作用,包括金黄色葡萄球菌、大肠杆菌等。
其抗菌作用可能与提取物中的挥发油成分有关,这些成分可以破坏细菌细胞壁、干扰细菌代谢等。
金银花在抗感染中的作用主要通过多种方式发挥,具有较好的抗感染效果。
随着研究的深入和技术的发展,金银花在抗感染领域的应用前景将更加广阔。
2. 正文2.1 金银花提取物对病毒感染的抑制作用研究实验结果显示,金银花提取物能够通过多种途径抑制病毒的复制和传播,包括干扰病毒的进入宿主细胞、阻断病毒复制过程、促进宿主细胞的免疫反应等。

金银花诱导培养和增殖培养技术大多研究认为,金银花诱导培养选用MS培养基或稍加改良MS培养基的诱导效果较好,芽萌动较快,但在蒙花金银花组培中使用了B5培养基。
不同种类激素及浓度配比对丛生芽的诱导影响较大。
一般认为诱导培养基的细胞分裂素和生长素浓度比为10~12.5:1时较好。
但蒙花金银花从生芽诱导所用细胞分裂素和生长素浓度比例以2.3~2.5为宜,忍冬诱导培养基两者比例为6时较好,认为金银花良种PM~1诱导培养基的两者比例以20最好,分化率达93%,平均丛生芽数9个。
增殖培养的基本培养基与诱导培养大致相同,多采用MS培养基。
灰毡毛忍冬增殖培养基中硝酸钾为零,磷酸二氢钾、硝酸钱、氯化钙和硫酸镁分别减半,组培苗分化最好,增殖系数达4.0,通过调节细胞分裂素BA和生长素IBA、NAA、IAA的配比,实现组培苗增殖。
一些试验中还使用了KT,ZT,如蒙花金银花在B、+BA2.0毫克/升+KT 0. 36毫克/升+IAA1.0毫克/升十CH1000毫克/升产生愈伤组织较少,增殖系数较高;北京忍冬增殖培养基也添加了ZT0.5毫克/升。
另有研究报道,在增殖培养基中添加适量的有机物有利于组培苗增殖和生长。
如在蒙花金银花组织培养中添加水解乳蛋白(LH)和水解酪蛋白(CH),在灰毡毛忍冬组培中添加生物素D。
组培苗根长1.5~2.0厘米时,在自然条件下炼苗5天,开口炼苗2天,即可移栽。
但也有研究认为,金银花组培苗移栽不需要炼苗,采用“塑料杯单株一步移栽方法”,移栽成活率达95 %。
移栽温度以12~28℃,相对湿度80%~85 %为宜。
移栽基质对组培苗移栽成活率影响较大。
适宜的移栽基质有河砂+蛙石或泥炭(1:1)、珍珠岩+腐殖土(1:1)或珍珠岩+蛙石+腐殖土(1:1:1)、黄心土+炭化糠壳灰+细砂(1:2: 2)。
也有试验表明,不同基质对成活率影响不显著,移栽在纯河砂、纯蛙石、河砂蛙石各半的3种基质上,成活率90%以上。
探讨影响金银花组织再生率的因素许兰杰,余永亮,谭政委,杨红旗,董薇,梁慧珍*,芦海灵,李春明(河南省农业科学院芝麻研究中心,河南郑州450002)概括了影响金银花组织再生率的因素,主要从外植体、基因型、培养基种类3个方面进行分析讨论,综合了当前金银花研究现状,为开展金银花组织培养提供技术参考。
金银花;组织培养;外植体;基因型30s+0.1%升汞8min 等5种方法处理金银花外植体,结果表明紫外灯照射30min+75%碱化乙醇30s+0.1%升汞8min 方法可以显著降低外植体污染率,并提高萌发率[8]。
总之,研究者采用的基本药品均为75%乙醇和升汞,区别在于优化了75%乙醇处理时间和升汞浓度。
2基因型大量研究表明,基因型对组织培养和植株再生影响较大。
目前已经在水稻、玉米、小麦和番茄等作物上开展了相关研究,而金银花组织培养针对于一种金银花品种的快繁,未研究同一组培条件下不同基因型金银花的组织再生率差异。
于惠敏等[9]研究了11个番茄基因型品种的组织培养和植株再生能力,发现不同基因型的植株再生能力存在着明显差异。
孙建昌等[10]研究了4个水稻品种的组织培养特性,表明不同外植体的组织培养特性差异较大。
赵贤慧[4]以红金银花的顶芽为外植体,经过初代培养、继代培养和生根培养获得了理想的生根苗。
任敏[3]以河南封丘金银花品种带腋芽茎段为外植体,可以获得无菌苗。
3培养基种类金银花用于外植体诱导愈伤组织的基础培养基有MS 和B5,以MS 应用较多,差异主要在于激素的浓度。
赵贤慧[4]发现培养基类型对愈伤组织诱导率有一定的影响,但是小于不同浓度NAA 对愈伤组织诱导率的影响。
过低或过高浓度的生长调节剂都不利于愈伤组织的生长。
植物组织培养常用的生长调节剂有NAA 、6-BA 、KT 。
王文静等[6]发现对红金银花顶芽诱导率最高的植物生长调节剂组合为KT 1.5mg/L+6-BA 1.5mg/L+a-NAA 0.5mg/L 。
金银花细胞悬浮培养体系的建立研究作者:祖恩凡,赵晨晨,张凌霄,钱晶晶来源:《现代园艺·下半月园林版》 2019年第3期金银花( )为忍冬科忍冬属多年生半常绿藤本植物[1],有研究指出,金银花含有大量化学成分,如挥发油中多有不饱和烯萜类和芳香醇类物质[2、3]、有机酸类[4]、黄酮类[5]和皂苷[6]等。
金银花含有大量的化学成分,具有清热解毒、疏散风热的功能,用于治疗温病发热、风热感冒、咽喉肿痛、肺炎、丹毒、蜂窝状组织炎和痢疾等多种疾病,为临床最常用中药之一[7]。
金银花作为食品、饮品应用广泛,且市场前景广阔[8-11]。
近年来,大部分提取物都是采用金银花植物提取,若采用人工栽培方式培育[12],生长周期相对较长;而植物组织或细胞培养具有不受环境和季节影响、培养周期短等优点。
1 材料与方法1.1 试验材料外植体来源于安徽科技学院种植基地,采集健壮的无病虫害金银花的新生嫩茎,去除叶片作为外植体,用流水冲洗10 min后备用。
1.2 试验方法1.2.1 外植体消毒。
放入外植体,用无菌水冲洗3~4次。
将外植体放入超净工作台中,用无菌水冲洗3次,分别用双氧水中浸泡消毒7min,再用无菌水冲洗5次,最后将冲洗好的材料放于滤纸上备用。
1.2.2 愈伤组织诱导。
将茎切成小段,处理叶片时则在叶脉处轻轻划上3~4道伤口,而后将截面朝向培养基,固体培养基均为:MS+6-BA0.6mg/L+NAA0.5mg/L+2,4-D0.2mg/L。
1周后,比较不同外植体诱导形成的愈伤组织性状及生长状况。
试验中不同外植体接种为一组试验,每组做3个重复,取平均数绘制生长曲线。
1.2.3 诱导率与褐化率的统计。
诱导率(%)=形成愈伤组织的外植体块数/接种外植体块数×100;褐化率(%)=褐化愈伤组织块数/愈伤组织总数×100。
1.2.4 细胞悬浮培养。
继代2次后,选择生长旺盛、结构疏松的愈伤组织块,用镊子夹碎或用小刀分割得到愈伤组织碎块,转移到装有MS 液体培养基的三角瓶中进行悬浮培养,置于摇床内110r/min ,26℃ 振荡培养,每7d继代1 次,继代时培养物用200目的灭菌细胞筛过滤,除去大细胞团和残渣,得到一定体积的小细胞团或单细胞悬浮液。