试管苗的继代增殖培养
- 格式:ppt
- 大小:1.32 MB
- 文档页数:15


试管苗的转接与继代实验报告一、实验目的本实验旨在探究试管苗的转接与继代技术,了解其操作方法及注意事项,为后续植物组织培养提供基础。
二、实验材料1.试管苗:选取生长良好的试管苗作为实验材料。
2.转接液:含有适量激素和营养物质的转接液。
3.培养基:含有适量激素和营养物质的培养基。
4.器具:无菌操作室、显微镜、离心机、移液器等。
三、实验步骤1.准备工作:(1)将所需器具清洗消毒,并在无菌操作室内进行操作。
(2)将试管苗从原来的试管中取出,清洗外部残留物。
2.转接步骤:(1)将试管苗放入含有适量激素和营养物质的转接液中浸泡10-15分钟,使其吸收足够的营养物质和激素。
(2)用移液器将试管苗从转接液中取出,放入新的含有适量激素和营养物质的培养基中。
(3)将培养基离心,使试管苗紧贴于培养基上。
3.继代步骤:(1)当试管苗生长到一定程度时,需要进行继代操作,即将试管苗移植到新的培养基中。
(2)将试管苗从原来的培养基中取出,清洗外部残留物。
(3)用移液器将试管苗从旧的培养基中取出,放入新的含有适量激素和营养物质的培养基中。
四、注意事项1.操作过程需在无菌条件下进行,避免杂菌污染。
2.转接液和培养基需按照配方制备,并在操作前进行检测确认其无菌状态。
3.移液器、显微镜等器具也需进行消毒处理。
五、实验结果通过本次实验,成功地完成了试管苗的转接和继代操作。
经过一段时间的观察和培育,发现试管苗在新的培养基中生长良好,并且细胞分裂活跃。
说明本次实验操作正确、有效。
六、实验总结本次实验主要是为了探究试管苗的转接与继代技术,了解其操作方法及注意事项。
通过实验,我们深刻认识到无菌操作的重要性,以及对试管苗的培养条件的掌握,这对于后续植物组织培养具有重要意义。
同时,本次实验还需要在实验过程中注意细节和精度,保证实验结果的准确性和可靠性。



影响试管苗继代培养的因素及解决措施1、影响试管苗继代培养的因素及解决措施当试管苗的瓶内长满并长到瓶塞,或培养基利用完成时就要转接,进行继代,可迅速得到大量试管苗,以便到一定数量时进行移栽。
能否保持试管苗的继代培养,是能否得到大量试管苗和能否用于生产的重要问题。
(1)驯化现象在植物组织培养的早期研究中,发现一些植物的组织经长期继代培养,发生一些变化,在开始的继代培养中需要生长调节物质的植物材料,其后加入少量或不必加入生长调节物质就可以生长,此现象就叫作“驯化”。
如在胡萝卜薄壁组织培养过程中,逐渐消耗了母体中原有器官形成有关的特殊物质。
如初代中加入10-6mol/L IAA,才能达到最大生长量,但经多次继代培养后,在不加IAA的培养基上也可达到同样生长量,一般约在一年以上,或继代培养10代以上。
但并不是出现这种所谓的驯化现象就好,有时长期的“驯化”现象会得到适得其反的结果,如卡德利亚兰实生苗在长期的加香蕉的培养基中继代,最后造成只长芽不长根,芽的增长倍数很高,但芽又细又弱,这时在加入生长素的培养基中培养,几次继代可长出较多的根。
(2)形态发生能力的保持和丧失在长时期的继代培养中,材料自身内部要发生一系列的生理变化,除了前面讲的“驯化”现象外,还会出现形态发生能力的丧失。
不同的植物其保持再生能力的时间是不同的,而且差异很大,在以腋芽或不定芽增殖继代的植物中,在培养许多代之后仍然保持着旺盛的增殖能力,一般较少出现再生能力丧失问题。
一般认为分化能力衰退主要有三个因素:第一,愈伤组织中含有从外植体启动分裂时就包括进来的成器官中心(分生组织),当重复继代会逐渐减少或丧失,这意味着不能形成维管束,只能保持无组织的细胞团。
也有人认为在继代培养过程中,逐渐消耗了原有的与器官形成有关的特殊物质。
为什么有的植物出现形态发生能力丧失的现象,而在另一些植物中,形态发生能力又能很好保持?其原因还有待进一步研究。
第二,形态发生能力的减弱和丧失,也可能与内源生长调节物质的减少或丧失有关,如胡萝卜和菘兰。


一、继代培养1.培养物再培养的或从初代培养新生长的组织或器官称为“培养物”。
在初代培养的基础上所获得的培养物如愈伤组织、芽、胚状体和原球茎等, 数量都还不太多, 它们需要进一步增殖, 使之越来越多, 从面发挥快速繁殖的优势。
2.继代培养把初代培养所获得的培养物, 移植到新的培养环境, 这种移植操作经过多次反复的培养, 就叫继代培养, 又叫连续培养。
依移植操作的次数分别称为第 1 次继代培养、第2 次继代培养…., 连续多代的培养又被称为建成培养。
其目的旨在繁殖出相当数量的无菌芽(苗)。
继代培养的后代是按几何级数量增加的过程。
3.继代培养中扩繁的方法,包括切割茎段、分离芽丛、分离愈伤组织、分离胚状体、分离原球茎等。
切割茎段常用于有伸长的茎梢、茎节较明显的培养物。
这种方法简便易行,能保持母种特性。
增殖使用的培养基对于某一种植物的培养物来说每次几乎完全相同, 由于培养物在接近最良好的环境条件, 营养供应和激素调控下, 排除了其他生物的竞争, 所以能够按几何级数增殖。
继代培养是经常性不停的进行过程。
在达到相当数量之后, 应考虑使其中大部分转入生根阶段。
从某种意义上讲, 增殖只是贮备母株, 而生根才是增殖材料的分流, 生产出成品。
二、继代方法1.固体培养有利于器官的分化。
2.液体培养以原球茎或胚状体方式增殖时,如兰花中增殖后得到的原球茎,分切后进行振荡培养(22 ℃恒温,连续光照)即可获得大量的原球茎,再切成小块转入固体培养基中,即可得到大量小苗。
在快速繁殖中, 增殖培养有时采用浅层液体静置培养, 生根阶段再采用固体培养基, 以节省成本。
三、提高增殖速度的方法1.改进培养基历来使用的培养基大多为培养细胞、愈伤组织和根等设计的, 无机盐浓度较高, 对一些植物茎尖、芽的生长不一定合适。
一方面可参考已有资料或相关的报道, 一方面进行多种实验找出最佳培养基。
GR 在增殖培养中所起的作用往往是决定性的, 但是报道差异很大。

试管苗的继代培养原理
继代培养是指将已经生长一段时间的植株组织再次转移到新的培养基中,以维持细胞的生长和增殖。
试管苗的继代培养主要通过以下原理实现:
1.组织分化和增殖:初始的试管苗组织经过培养后可以进一步分化和增殖,形成新的细胞和组织,从而实现苗期继代。
2.提供营养和生长因子:新的培养基中含有必要的营养物质和生长因子,如无机盐、糖类、氨基酸、维生素等,能够满足细胞的营养需求,促进细胞生长。
3.细胞分裂和增殖:培养基中的激素,特别是植物生长调节剂(PGRs)可以促进细胞分裂和增殖,如培养基中含有较高浓度的激素,则可以促使细胞增殖更快。
4.去除抑制因子:有时候,初始化的培养基可能含有一些抑制因子,如乙烯等,会阻碍细胞的生长和增殖,需要通过调整培养基的成分和pH值,使抑制因子的影响降到最低。
综上所述,试管苗的继代培养通过分化和增殖、提供营养和生长因子、促进细胞分裂和增殖以及去除抑制因子等原理实现。


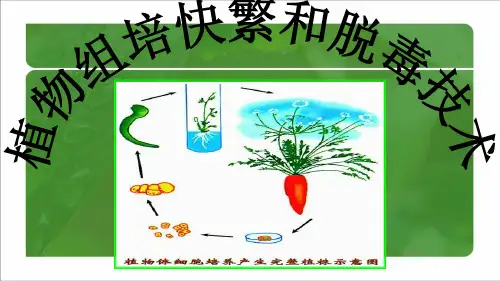
试管苗的继代培养与扩繁继代培养指在组织培养过程中,当外植体被接种一段时间后,将已经形成愈伤组织或已经分化成茁的培养物重新切割,转接到新鲜的培养基上,进一步扩大增殖培养的过程。
在进行继代培养时,要根据生长习性及品种特点,来确定继代时间和继代培养基,对一些生长速度比较快或者繁殖系数高的种类,如满天星、非洲紫罗兰等,继代时间比较短,一般不能超过15d。
对生长速度比较慢的种类,继代时间就要长一些,如非洲菊、红掌等,30-40d才需转瓶继代。
当然,继代时间也不是一成不变的,它要根据当时的培养目的、环境条件及所使用的培养基配方进行考虑,若是在前期的扩繁阶段,为了加快繁殖速度和尽快增大繁殖量,可以当苗才分化时,就切割继代,而无需待苗长到很大时才进行继代。
反之,若是在保持一定繁殖基数的前提下,进行定量生产时,为了有更多的大苗可以用来生根,可以间隔较长的时间继代,达到既可以维持一定的繁殖量,又可以提高组培苗产量目的。
继代培养基的使用,要根据品种的长势来确定。
除了种类的差异外,有时,同一种类的不同品种间所用的培养基也有很大的不同,如香石竹品种马斯特在BA大于0.2mg/L时,连续使用几代就出现丛生变异;而兰贵人等品种在0.5mg/L时多次继代丛生现象也不明显。
另外,为了保证组培苗在继代培养期间质量不下降,不同激素浓度的培养基交替使用同样很重要。
同时,在继代培养中增殖率、变异、污染控制、玻璃化等因素会影响组培苗生产的效率及经济效益。
首先增殖率,也就是繁殖系数,指每块外植体在单位时间内增殖的倍数。
每种植物的增殖率各不相同,在生产时要进行试验比较,通过对激素水平的调整,寻找出增殖系数最高、变异系数最低的激素用量及配比。
多数以顶芽或腋芽增殖方式扩繁的植物,进行多代培养后仍能保持比较旺盛的繁殖能力,因此丧失和削弱增殖力的问题不是非常明显。
但在继代转接时,易出现潜在性污染,使生长势削弱,增殖率降低。
潜在性污染的控制十分困难,每次操作都须小心认真。
愈伤组织和试管苗的培养愈伤组织的培育一般来说,从接种外植体到消失愈伤组织,需要经过2周时间。
2周之内就可以看到外植体上渐渐长出乳白色或黄白色的瘤状愈伤组织。
首次培育愈伤组织时,恒温箱的门应当关闭,不必见光,由于在无光条件下愈伤组织长得更快。
2周以后,由于培育基中的养分成分已接近耗尽,必需更换培育基,进行继代培育。
愈伤组织的继代培育进行继代培育所用的培育基,和培育愈伤组织所用的培育基相同。
在严格的无菌条件下(接种箱内)将愈伤组织连同原来的外植体,一起移到新的培育基上。
愈伤组织的继代培育,一代为20天。
假如延长培育时间,培育基中的养分物质会削减,外植体也会分泌一些有毒物质,造成自身中毒。
20天以后,可以依据愈伤组织的大小,打算是连续进行继代培育,还是进行试管苗培育。
假如愈伤组织长到直径为1-15cm时,就可以进行试管苗培育,否则还需要进行其次次继代培育。
在愈伤组织进行继代培育期间,可以将恒温箱的门打开,让愈伤组织见光。
愈伤组织见光后,颜色可以转为绿色。
试管苗的培育当愈伤组织长到肯定大小后,可以更换培育基,进行试管苗的培育。
试管苗的培育分为生芽培育和生根培育。
要想培育出一株完整的试管幼苗,必需先进行生芽培育,然后进行生根培育。
假如挨次颠倒,先诱导生根,就不好诱导生芽了。
生芽大约需要4~6周的时间,而生根培育时,1周以后就可以见到幼根了。
留意,试管苗应当进行见光培育。
下面列出继代培育和试管苗培育的培育基配方。
①继代培育和生芽培育的培育基配方是:MS培育基+6BA(质量浓度为0.5-1.0 mg/L)+NAA(质量浓度为0.1-0.15 mg/L)。
即在1 L MS培育基中加入5-10 mL6BA和1-1.5 mL的NAA母液。
NAA协作6BA,可以促进不定芽的生长。
②生根培育的培育基配方是:MS培育基+NAA(质量浓度为0.1-0.5 mg/L)。
即在1 L MS培育基中加入1-5 mL的NAA母液。
NAA起促进生根的作用。
实验三植物继代培养一、目的要求通过在超净工作台上进行无菌操作训练掌握组织培养的继代操作技术。
二、基本原理植物组织培养中,培养物(细胞、愈伤组织、器官、试管苗等)培养一段时间后,为了防止培养的细胞团老化,或培养基养分利用完而造成营养不良及代谢物过多积累而引起毒害等的影响,要及时将其接种到新鲜培养基中,进行继代培养。
固体培养可使用在组织培养过程中的各个阶段,如愈伤组织的增殖、器官的分化及完整植株的再生等阶段,液体培养主要用于植物材料再生培养的诱导前期,如愈伤组织的增殖、分化等。
本实验以菊花为例,学习继代培养的操作技术。
三、材料与用具1.仪器用具超净工作台、70%的乙醇、95%的乙醇、盛有培养基的培养瓶、接种器械(主要指剪刀、镊子等)、酒精灯、培养材料、无菌纸。
2.材料菊花花的试管苗或愈伤组织。
四、方法步骤(仅供参考)1.准备继代培养的培养基,。
于诱导试管苗的增殖。
2.将接种用具、酒精灯、烧杯、无菌培养皿、培养基等置于超净工作台的接种台面;打开超净台的电源开关,打开鼓风开关(调节送风量),并打开紫外灯消毒20min,之后关掉紫外灯,继续送风20min,打开荧光灯开关,准备接种。
3.无菌操作前,将双手用70%乙醇棉球擦拭消毒,剪刀、镊子等金属工具在用酒精灯外焰灼烧灭菌,后置于支架上冷却备用。
4.无菌纸置于超净工作台,打开包纸,用镊子将无菌滤纸取出,置于操作人员的正前处。
5.在酒精灯火焰处打开外植体材料瓶,将植物材料用灭过菌的镊子取出置于无滤菌纸上。
6.一手持镊子,一手持剪刀,将植物材料按照要求切割。
切割时,需将变褐的部位、根切下弃去。
根据其增殖方式,将小苗切成单株、或小苗丛,或小段(每段均有芽)接种于继代培养基中,与初代培养不同的是,继代培养时,每瓶中的接种材料可适当多接,可材料要均匀分布。
7.在标签上写上植物编号(即原培养瓶上的编号,若没有编号可不写),日期、班级、学号,放于培养箱中进行培养。
8.接种结束后,关闭和清理超净工作台,并清洗用过的玻璃器皿等。
盐母液:80ml;钙盐母液160ml;有机物母液80ml。
1mg/L 6-BA取8ml,0.1mg/L NAA取16ml。
混匀。
c.待琼脂完全溶解后,加入规定用量的蔗糖(240g),继续加温并不断搅拌,待琼脂煮透后端离火源,再加入所需用量的母液(可事先取好放于一烧杯中),最后加蒸馏水至所需体积,即8L。
注意:a)、调节培养基的酸碱性至pH5.8b)、培养基的分装,配制好的培养基要趁热分装,培养基分装完后,用封口膜封严瓶口,并用棉线扎紧。
本次实验中4L分装到150个左右三角瓶,每人3瓶。
2. 培养基的灭菌培养基分装后应立即置于高压蒸气灭菌锅内进行灭菌。
消毒灭菌时,压力表读数约为1.06kgf·cm-2或0.105 MPa (可在0.105 ~ 0.12MPa间,但不得超过0.14 MPa),温度121℃时保持15~30 min左右即可。
同时将接种工具进行灭菌。
3.试管苗转接(1)准备:提前将经过灭菌的培养基、接种工具、吸水纸、器皿及待转接材料放入超净工作台内,打开紫外灯消毒20min。
(2)转接:对菊花、香石竹、马铃薯、月季等节间明显的多茎段嫩枝材料,采取切茎段的方式,茎段长1cm左右,带1-2个茎节,可将茎段垂直插入培养基中,或水平放入培养基表面,一刺激侧芽的萌动;对生姜,草莓等茎间不明显的芽从,采取分离芽从的方式扩繁。
c.待琼脂完全溶解后,加入规定用量的蔗糖(240g),继续加温并不断搅拌,待琼脂煮透后端离火源,再加入所需用量的母液(可事先取好放于一烧杯中),最后加蒸馏水至所需体积,即8L。
2. 培养基的灭菌培养基分装后应立即置于高压蒸气灭菌锅内进行灭菌。
消毒灭菌时,压力表读数约为1.06kgf·cm-2或0.105 MPa (可在0.105 ~ 0.12MPa间,但不得超过0.14 MPa),温度121℃时保持15~30 min左右即可。
同时将接种工具进行灭菌。
3.试管苗转接(1)准备:提前将经过灭菌的培养基、接种工具、吸水纸、器皿及待转接材料放入超净工作台内,打开紫外灯消毒20min。