第八章配位化合物
- 格式:ppt
- 大小:2.90 MB
- 文档页数:79

第八章络合物(配位化合物)化学基础【竞赛要求】配位键。
重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的络合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物几何构型和异构现象基本概念。
配合物的杂化轨道理论。
八面体配合物的晶体的颜色。
路易斯酸碱的概念。
场理论。
Ti(H2O) 36【知识梳理】一、配合物基本知识1、配合物的定义由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
[Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。
判断的关键在于是否含有配位单元。
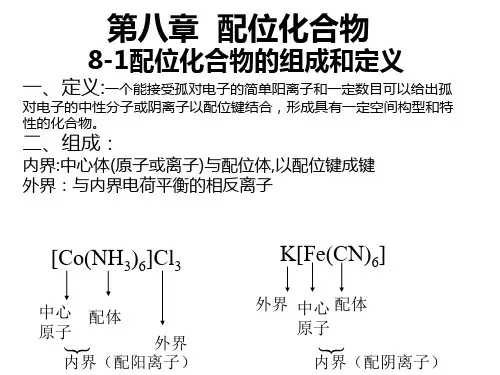
思考:下列化合物中哪个是配合物①CuSO4·5H2O ②K2P t Cl6 ③KCl·CuCl2④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2注意:①配合物和配离子的区别②配合物和复盐的区别2、配合物的组成中心离子内界单齿配体配位体多齿配体配合物螯合配体外界(1)配合物的内界和外界以[Cu(NH3)4]SO4为例:[Cu(NH3)4]2+ SO 24内界外界内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。
可以无外界,如Ni(CO)4。
但不能没有内界,内外界之间是完全电离的。
(2)中心离子和配位体中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。