- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
❖ 1798年 ,塔赫特(Tassaert) Co3+ + NH4Cl + NH3·H2O CoCl3 ·6NH3 ( Co3+ 的电子层结构)
❖ 1893年 ,Werner 配位学说 ❖ 至今,形成一门独立学科,成为各分支化学的交叉点
Tuesday, June 16, 2020
§8.1 配合物的组成和定义 §8.2 配合物的类型和命名 §8.3 配合物的化学键理论 §8.4 配位平衡 §8.5 螯合物的特点及稳定性
单齿配体: 多齿配体:
[ Cu(NH3)4]2+ 4 [PtCl3(NH3)]- 4 [CoCl2(en)2] + 6 [Al(C2O4)3]3- 6 [Ca(EDTA)]2- 6
Tuesday, June 16, 2020
4、配离子电荷
配离子电荷等于中心离子和配体两者电荷的代数和。
(+3)
[Fe(CN)6]3-(赤血盐)
2、系统名称
配合物内界命名:配位体数—配位体名称(不同配 位体名称之间以中圆点(·)分开)—合—中心离子(氧
化数) 配体顺序:先无机后有机;先离子后分子;
先阴离子后阳离子; 同类型离子,按英文字母顺序排配体
Tuesday, June 16, 2020
常见配体的名称
N
Tuesday, June 16, 2020
(+2)
[Fe(CN)6]4-(黄血盐) [Fe(CO)5]
?配合物内界是否一定带电
Tuesday, June 16, 2020
§8.2 配合物的类型和命名
一、类型
1、按中心离子数
❖ 单核 H2N Pt
Cl
H2N Pt
❖ 多核 H2N
Cl H2N
2、按配体种类
❖ 水合 ❖ 卤合 ❖ 氨合 ❖ 氰合
❖ 特殊配合物
❖金属羰基配合物 Ni(CO)4 ❖簇状配合 ❖有机金属配合物
H2 CH2N
CH2N H2
H2
2+
NCH2
Cu
NCH2
H2
❖多酸配合物
Tuesday, June 16, 2020
金属羰基化合物
有机金属配合物
Tuesday, June 16, 2020
二、命名
1、习惯名称
K4[Fe(CN)6]: 黄血盐 Fe(C5H5)2: 二茂铁 K3[Fe(CN)6]: 赤血盐 K[PtCl3(C2H4)]:蔡斯盐
1、中心离子(或原子)
❖ 一般为带正电的过渡金属离子 [Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2-
❖ 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 ❖ 非金属元素原子:SiF62- , PF6-
2、配体(配位原子)
配体:含孤对电子 ❖ 阴离子:X-, OH-, SCN-
[Co(NH3)6]Cl3 K3[Fe(NCS)6]
Tuesday, June 16, 2020
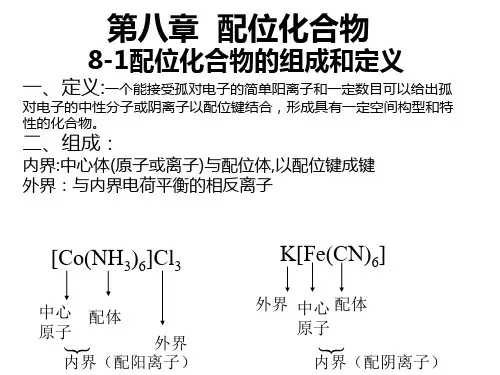
二、配位化合物的组成
内界(配位个体)
[Co(NH3)6]Cl3
配体
中心离子
外界
配位数 配位原子
练习:
[Cu(NH3)4]SO4
K3[Fe(NCS)6] [Fe(CO)5]
Tuesday, June 16, 2020
❖中性分子:CO, H2O, NH3
配位原子:配体中与中心原子直接相连的原子。
H,C,N,P,As,Sb,O,S,Se,Te,F, Cl,Br,I
Tuesday, June 16, 2020
3、配位数
配位数是与中心原子成键的配位原子总数
中心离子最高配位数:第一周期 2 , 第二周期 4
第三,四周期 6 ,第五周期 8
影响配位数的因素:❖中心离子
半径 半径 电荷 电荷
配位数 配位数
Tuesday, June 16, 2020
(AlF63-, BF4-) (PtCl62-, PtCl42-)
❖配位原子
半径 电荷
(AlF63-, AlCl4-)
半径 电荷
配位数 配位数
配位数: 与中心原子成键的配位原子总数.
分类 单齿配体:只含有一个配位原子的配体 多体—合—中心离子(价态)酸
例:K[PtCl5(NH3)] 五氯.氨合铂(IV)酸钾 2)配阳离子配合物 规则:外界阴离子—化—配体—合—中心离子(价态)
例:[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根.五氨合钴(III)
Tuesday, June 16, 2020
一、配位化合物定义
[Cu(NH3)4]SO4
中心离子 (原子)
定义:以具有接受电子对的空轨道的原子和离子为
中心,与一定数量的可以给出电子对的离子或分子
按一定的组成和空间构型形成的化合物。 配位体
配位键的形成:中心离子(原子)提供空轨 道,配位体上的配位原子提供孤对电子。
Tuesday, June 16, 2020
§8.1 配合物的组成和定义
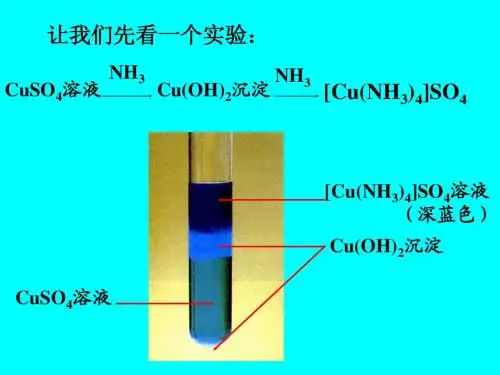
实验例:CuSO4→加NaOH , 浅蓝色沉淀Cu(OH)2 →加氨 水 ,沉淀溶解,生产绛蓝色溶液
加BaCl2,白色沉淀 加NaOH ,无沉淀 碱性条件下加热,无气体放出
说明:新生产的分子中几乎没有游离的Cu2+和NH3 [Cu(NH3)4]SO4 Cu2+:具空轨道,路易斯酸 NH3:具孤电子对,路易斯碱
第八章 配位化合物
复习1、共价键分类 按电子对提供方式分正常共价键和配位共价键
CO分子的结构: C: 2s22px12py12pz
CO
O: 2s2 2px12py1 2pz2
复习2、酸碱电子理论 酸:凡接受电子对的物质,碱:凡给出电子对的 物质
酸碱反应实质:形成配位键,生成配位化合物
Tuesday, June 16, 2020
[Cu(H2O)6]2+ [AlF63-] [Co(NH3)6]3+ [Fe(CN)6]4-
Tuesday, June 16, 2020
Cl Pt NH2
Cl
NH2
3、按成键类型
S
Co
Co
❖ 经典配合物 ❖ 簇状配合物
Co C
O
N C
N
C
Ph
(金属-金属键)
O
❖ 烯烃不饱和配合物
❖ 夹心配合物
❖ 穴状配合物
H H Cl
Cl
C Pt
Cl C
HH
N
N
NH Eu NH
N
N
Tuesday, June 16, 2020
C5H5 Fe
C5H5
4、按配体类型
❖简单配合物 单齿配体——一个配位原子
(NH3, H2O, CN-) ❖ 螯合物
H3N
NH3 2+
Cu
H3N
NH3
多齿配体——两个(含)以上配位原子
(en, EDTA)