烃的含氧衍生物
- 格式:ppt
- 大小:669.50 KB
- 文档页数:9

烃的含氧衍生物燃烧通式1. 烃和它的含氧衍生物说到烃,大家一定不会陌生。
这玩意儿就是我们日常生活中最常见的化合物之一,像是汽油、蜡烛、甚至某些油炸食品里的油,都是烃的身影。
不过,今天咱们不光说烃本身,还要聊聊它的“亲戚”——含氧衍生物。
这些小家伙可厉害了,它们一旦燃烧起来,产生的能量可不是闹着玩的。
1.1 含氧衍生物的类型含氧衍生物其实就是在烃的基础上,增加了氧元素的化合物,像是醇、醚、酸等等。
别小看它们,这些东西可广泛应用于各种领域,比如燃料、溶剂,甚至药物。
就像是家里的调料一样,少了可不行,有了才香。
1.2 它们的燃烧反应这些含氧衍生物在燃烧时,通常会和氧气反应,释放出二氧化碳和水。
简单来说,就是把它们丢到火里,呼啦一下,热量就蹭蹭地上来了。
你要是看过露营的时候把木材扔进篝火,那种熊熊燃烧的景象,你就能理解这燃烧过程有多壮观。
2. 燃烧的化学反应燃烧其实是个化学反应,简单点说,就是物质和氧气反应,释放能量。
在这个过程中,含氧衍生物的分子结构会被打乱,重新组合成二氧化碳和水。
想象一下,这就像是一个人参加了聚会,原本穿着的衣服(分子结构)在狂欢中被撕扯(反应),最后变成了一件崭新的T恤(产物)。
不过,这个过程可不是一蹴而就的,还得有合适的条件,比如温度、压力等等。
2.1 燃烧的热量说到热量,那可真是一个有趣的东西。
我们常常用卡路里来衡量食物的热量,其实燃烧反应中释放的热量也是可以量化的。
不同的含氧衍生物,燃烧时产生的热量也是不同的,就像每道菜都有自己的特色,烹饪出来的味道自然也不一样。
比如,酒精燃烧时就能释放出不少热量,用来当燃料再合适不过了。
2.2 燃烧的副产物不过,燃烧可不只是好看,它还有副作用。
尤其是当氧气不足时,燃烧产生的一氧化碳可是个“大麻烦”,它可是无色无味,杀伤力十足的家伙,长期吸入可就危险了。
所以在使用这些含氧衍生物的时候,安全可得放在第一位。
就像是开车出门,一定要系好安全带,确保自己和他人的安全。

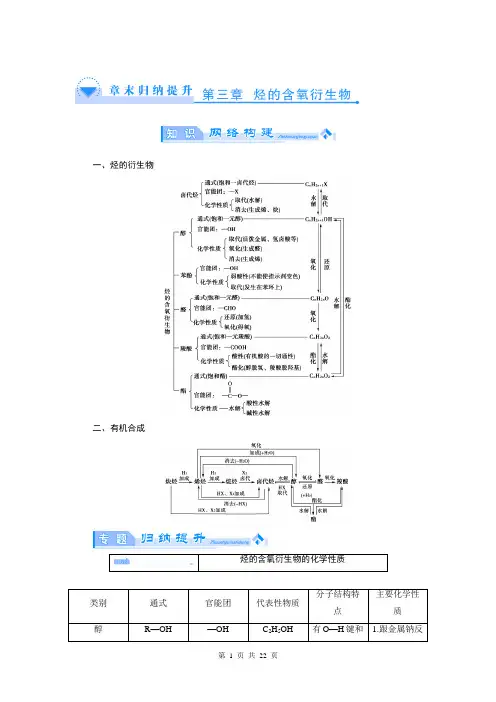
一、烃的衍生物二、有机合成(2013·长安一中高二期末)2011年西安世园会期间对大量盆栽鲜花施用了诱抗素剂,以保持鲜花盛开。
诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羧基、酯基三种官能团B .1 mol 该物质在催化剂加热条件下最多可与4 mol H 2发生加成反应C .1 mol 该有机物与足量的溴水反应能消耗4 mol Br 2D .该分子中所有碳原子可能位于同一平面上【解析】 该分子含有碳碳双键、羧基和羰基三种官能团,A 项错误;1 mol 该有机物最多消耗3 mol Br 2,C 项错误;分子内部有饱和碳原子,D 项不正确;分子中三个碳碳双键和羰基能够与H2发生加成反应,—COOH中的碳氧双键不能与H2反应,B项正确。
【答案】 B醇、由于与—OH相连的基团不同,—OH受相连基团的影响也不同,这些羟基上的氢原子活性也就不同,表现在性质上也就有较大差异。
如下表:2332 ROH。
(2012·上海高考)过量的下列溶液与水杨酸(COOHOH)反应能得到化学式为C7H5O3Na的是()A.NaHCO3溶液B.Na2CO3溶液C.NaOH溶液D.NaCl溶液【解析】由于酸性:COOH>H2CO3>OH,可知水杨酸与NaHCO3溶液反应时只是—COOH作用转化为—COONa,产物的分子式为C7H5O3Na,A项正确;水杨酸与Na2CO3溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,B项错误;水杨酸与NaOH溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,C项错误;与NaCl溶液不反应,D项错误。
【答案】 A现有4种液态有机物A、B、C、D,分子式均为C3H6O2,请根据下表所给出的实验结果,判断这4种物质为何物质(写出结构简式)。
A________;B________;C________;D________。
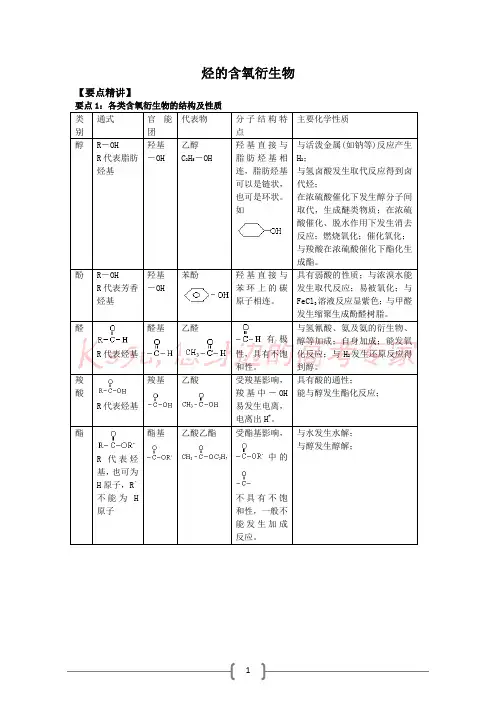
烃的含氧衍生物【要点精讲】要点1:各类含氧衍生物的结构及性质有极要点2:重要的有机反应类型、等要点3:烃的羟基衍生物比较【典例精讲】典例1:烃的衍生物及其官能团的性质(08广东化学卷25)某些高分子催化剂可用于有机合成。
下面是一种高分子催化剂(Ⅶ)合成路线的一部分(Ⅲ和Ⅵ都是Ⅶ的单体;反应均在一定条件下进行;化合物Ⅰ-Ⅲ和Ⅶ中含N 杂环的性质类似于苯环):回答下列问题:(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式 (不要求标出反应条件)。
(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是 (填字母)。
A .化合物Ⅰ可以发生氧化反应B .化合物Ⅰ与金属钠反应不生成...氢气 C .化合物Ⅱ可以发生水解反应 D .化合物Ⅲ不可以...使溴的四氯化碳深液褪色 E .化合物Ⅲ属于烯烃类化合物(3)化合物Ⅵ是 (填字母)类化合物。
A .醇B .烷烃C .烯烃D .酸 E.酯 (4)写出两种可鉴别V 和VI 的化学试剂(5)在上述合成路线中,化合物Ⅳ和V 在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式 (不要求标出反应条件) 解析:(1)由II的结构可以看出和I的区别在于侧链中多了一个乙酰基,也就是说I中侧链上的羟基与乙酸发生了酯化反应,生成了酯类物质。
(2)化合物I 官能团有羟基,碳碳双键,故可发生氧化反应,也可以与金属钠发生反应生成氢气,故A 正确,B 错误。
化合物II 官能团有酯基,可以发生水解发生,生成相应的酸和醇,故C 正确。
化合物III 的官能团有碳碳双键,可以使溴的四氯化碳溶液褪色,属于以乙烯为母体的烯烃类衍生物,故D 错误,E 正确。
(3)VI的结构可以从VII的结构来判断,VII中有两种单体,一种是由III提供,另一种是由VI提供,将III的结构单元去掉即为VI的结构单元,可以看出应是一种酯的结构。
(4)2008年诺贝尔化学奖授予美籍华裔钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白方面做出的杰出贡献。



第十章 烃的含氧衍生物10.1 醇、酚高考考点:醇、酚的性质与结构是高考的重点和热点,在有机合成与推断中处于中心枢纽位置。
一.烃的含氧衍生物1. 定义:从结构上说,可以看作是烃分子里的氢原子被含氧原子的原子团取代而衍生二.乙醇1.分子结构:结构式:电子式:分子式:C 2H 6O 结构简式:CH 3CH 2OH 官能团:-OH(羟基)2.物性:无色透明有特殊香味的液体,ρ(CH 3CH 2OH )>ρ(H 2O )易挥发,沸点78.5℃ 熔点:-117.3℃ 能与水以任意比互溶,能溶解多种有机物和无机物,工业酒精含乙醇96%,用工业酒精与生石灰混合蒸馏可制取无水酒精 3.化学性质:(1)与活泼金属反应2CH 3CH 2OH+2Na 3CH 2ONa+H 2↑ (2)氧化反应: CH 3CH 2OH+O 2 2+3H 2O 2CH 3CH 2OH+O 2 3CHO+2H 2O乙醇可以使酸性KMnO 4溶液褪色,能与酸性重铬酸钾(K 2Cr 2O 7)溶液反应,被直接氧化成乙酸。
(3)消去反应: ↑+H 2OCH 3CH 2OH(4)取代反应: CH 3CH 2 2Br +H 2O (浓氢溴酸)CH 3CH 2OH+CH 3COOH CH 3COOCH 2CH 3+H 2O2CH 3CH 23CH 2OCH 2CH 3 +H 2O4.工业制法:CH 2=CH 2 CH 3CH 2OH发酵法:淀粉 3CH 2OH+2CO 2 三.醇类1. 2. 分类※ 乙二醇、丙三醇都是无色粘稠、有甜味的液体,易溶于水和乙醇3. 物理性质:饱和一元醇(C n H 2n+2O )随着碳原子数的递增沸点逐渐升高4. 化学性质:与乙醇相似能与活泼金属反应、氢卤酸反应、能发生氧化反应和消去反应。
※ 催化氧化:-OH 在端上氧化成醛、在链中氧化成酮、与-OH 相连的C 上无氢则不能被催化氧化。
消去反应:CH 3-CH=CH-CH 3 +H 2O (查依采夫规则)10.1‘酚一.苯酚(石炭酸)1.分子结构分子式:C6H6O 结构简式:或C6H5OH2.物理性质:纯净的苯酚是无色的晶体,但放置时间较长的苯酚往往是粉红色,这是由于部分苯酚被空气中氧气氧化所致。

考点烃的含氧衍生物一、醇类1.醇类(1)定义:羟基与烃基或苯环侧链上的碳原子相连形成的化合物称为醇。
(2)醇的分类注意啦:饱和一元醇的通式是C n H2n+1OH,饱和一元醚的通式为C n H2n+2O,所以碳原子数相同的饱和一元醇和饱和一元醚互为同分异构体,如丁醇和乙醚互为同分异构体。
碳原子数相同的芳香醇及酚互为同分异构体。
(3)醇的物理性质和化学性质物理性质递变规律密度一元脂肪醇的密度一般小于1g·cm-3直链饱和一元醇的沸点随着分子中碳原子数的递增而升高沸点醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小化学性质由于醇类都以羟基为官能团,所以醇类的化学性质与乙醇相似,即能与活泼金属反应,能发生酯化反应、消去反应、取代反应、氧化反应等。
注意啦:在二元醇或多元醇的分子中,两个或两个以上的羟基结合在同一个碳原子上时,物质不能稳定存在(如:→)。
在写二元醇或多元醇的同分异构体时,要避免这种情况。
(4)重要的醇的用途①甲醇:有毒,饮用约10 mL就能使人双目失明。
工业酒精中含甲醇,甲醇是重要的化工原料和车用燃料。
②乙二醇和丙三醇:都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇还用作汽车防冻液,丙三醇用于配制化妆品。
2.脂肪醇、芳香醇、酚和芳香醚的比较类别脂肪醇芳香醇酚芳香醚实例CH3CH2OH C6H5CH2OH C6H5OH C6H5OCH3官能团—OH—OH—OH—O—结构特点—OH与链烃基相连—OH与芳香烃侧链相连—OH与苯环直接相连氧原子连接2个烃基主要化学性质①与钠反应②取代反应③脱水反应④氧化反应⑤酯化反应等①弱酸性②取代反应③显色反应④加成反应等______特性红热铜丝插入醇中有刺激性气味(生成醛或酮)与FeCl3溶液反应显紫色______二、酚1.酚的概念和结构特征羟基与苯环直接相连而形成的化合物称为酚。


第三章烃的含氧衍生物醇、酚引入:酒、醋、苹果酸、柠檬酸等有机物,可以看作是烃分子里的氢原子被含有氧原子的原子团取代而衍生成的,它们被称为烃的含氧衍生物。
烃的含氧衍生物种类很多,可分为醇、酚、醛、羧酸和酯等。
烃的含氧衍生物的性质由所含官能团决定。
利用有机物的性质,可以合成具有特定性质而自然界并不存在的有机物,以满足我们的需要。
知识点一、醇、酚烃分子中的氢原子可以被羟基(—OH)取代而衍生出含羟基化合物。
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇;羟基与苯环直接相连而形成的化合物称为酚。
(邻甲基苯酚)CH3CH2OH饱和一元醇的命名(1)选主链选最长碳链,且含—OH(2)编号从离—OH最近的一端起编(3)写名称取代基位置—取代基名称—羟基位置—母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。
)乙二醇苯甲醇1,2,3—丙三醇(或甘油、丙三醇)练习:写出下列醇的名称二、醇1.醇的分类1)根据羟基所连烃基的种类2)根据醇分子结构中羟基的数目,醇可分为一元醇、二元醇、三元醇……饱和一元醇通式:C n H2n+1OH或C n H2n+2O拓展乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
结论:相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。
乙二醇的沸点高于乙醇,1,2,3—丙三醇的沸点高于1,2—丙二醇, 1,2—丙二醇的沸点高于1—丙醇,其原因是:由于羟基数目增多,使得分子间形成的氢键增多增强。
处理反应釜中金属钠的最安全、合理的方法是:向反应釜中慢慢加入乙醇,由于乙醇与金属钠的反应比水与钠的反应缓和,热效应小,因此是比较安全,可行的处理方法。

第六章烃的含氧衍生物第一节乙醇苯酚1.烃分子中的氢原子被含有氧原子的原子团所取代,衍生出的一系列新的化合物,称为烃的含氧衍生物。
2.乙醇俗称酒精,是一种无色、有特殊香味的液体,能与水以任意比例互溶;易挥发。
乙醇能溶解多种物质,如医疗用的碘酒就是碘的酒精溶液。
乙醇是重要的有机合成原料,大量用于燃料、制造饮料和香料。
例如,用乙醇可制备乙醛、乙酸、乙醚、农药、纤维、塑料、合成橡胶等多种产品。
医疗上用的消毒酒精是含70%~75%(体积分数)乙醇的溶液。
3. 乙醇可看作是乙烷分子中的1个氢原子被羟基(—OH)取代后的生成物,—OH是它的官能团。
4.乙醇分子中的O—H键和C—O键都属于极性键,比较活泼。
因此,乙醇发生的化学反应主要有两种:一种是羟基上氢原子的反应,另一种是羟基被取代或脱去的反应。
5.乙醇与金属钠的反应较水与钠的反应要缓和得多6.乙醇是一种常用的燃料,在空气中燃烧生成二氧化碳和水,并放出大量的热。
7.有机化合物在适当的条件下,从分子中脱去1个小分子(如水、卤化氢等),而生成不饱和(含双键或三键)化合物的反应,叫做消去反应。
8.在同样的催化剂作用下共热到140℃时,乙醇还可发生分子间脱水生成乙醚。
9.苯酚俗名石炭酸。
纯净的苯酚是无色晶体,易受空气中氧的氧化而带有不同程度的黄色或红色。
苯酚有腐蚀性,与皮肤接触能引起灼伤,如果不慎溅到皮肤上,应立即用酒精洗涤。
纯净的苯酚可制成洗涤剂和软膏,有杀菌和止痛作用。
药皂中通常也掺入少量的苯酚。
10苯酚是苯分子里的1个氢原子被羟基取代后的生成物,-OH是它的官能团11.由于苯酚中的羟基与苯环直接相连,苯环与羟基之间的相互作用,使酚羟基在性质上与醇羟基有显著差异12.苯酚的酸性苯酚水溶液由浑浊变澄清,通入二氧化碳后又变浑浊。
说明苯酚的酸性比碳酸弱13.苯酚的取代反应此反应很灵敏,常用于苯酚的定性检验和定量分析14.苯酚的氧化反应15.苯酚与FeCl3溶液作用显紫色,这一反应非常灵敏,常用于检验苯酚的存在。
烃的含氧衍生物考点探析烃是一类化合物,其分子中只含有碳和氢两种元素。
烃的含氧衍生物是指在烃分子中,氧原子已经取代了其中一个或多个碳原子所形成的化合物。
这类化合物广泛存在于生活和工业中,具有重要的应用价值和学术研究意义。
本文旨在对烃的含氧衍生物的考点进行探析,帮助读者更好地理解和掌握这类化合物。
考点一:含氧衍生物的命名和结构含氧衍生物的命名在有机化学中非常重要,是通向有机合成和有机反应机理研究的基石。
其中的一些核心概念包括:醛、酮、羧酸、酯等。
这些化合物的命名和结构有一定规律可循,例如:•醛:前缀为“-al”,末尾为碳原子编号。
例如甲醛(CH0)可以写作“methanal”。
•酮:前缀为“-one”,末尾为碳原子编号。
例如丙酮(CH3COCH3)可以写作“propanone”。
•羧酸:前缀为“-oic acid”,末尾为碳原子编号。
例如乙酸(C2H5COOH)可以写作“ethanoic acid”。
•酯:前缀为“-yl”和“-oate”,末尾为碳原子编号。
例如甲基乙酸甲酯(CH3COOCH3)可以写作“methyl ethanoate”。
这些命名规则在有机化学中被广泛应用,因此对于有机化学学生来说,熟练掌握这些规则是非常重要的。
考点二:含氧衍生物的性质含氧衍生物的性质主要与它们的结构有关,例如:•醇的氢键性质:醇中氢原子(-OH)具有形成氢键的能力,因此醇的氢键强度比较大。
•酮的惰性:酮分子不含具有活性的-OH基团,因此其相对于醛而言,惰性较强。
•羧酸的强酸性:羧酸分子中的-COOH基团可以释放出H+,具有很强的酸性。
•酯的胺基作用:酯的分子中含有-OCO-连接,可以发生胺基作用,使其分子内部产生氢键。
这些性质对于学生理解含氧衍生物的结构和化学反应机理十分重要。
考点三:含氧衍生物的化学反应含氧衍生物的化学反应种类繁多,其中一些重要反应包括:•羧酸的脱水:羧酸分子中的-COOH基团可以脱水,形成酰亚胺;反之,酰亚胺可以加水生成羧酸。
酚和醚都是烃的含氧衍生物醇可以看作是烃分子中的氢原醇、酚和醚都是烃的含氧衍生物。
醇可以看作是烃分子中的氢原子被羟基〔-OH〕取代而生成的化合物。
而芬芳环上的氢原子被羟基取代而生成的化合物那么为酚。
醇和酚的分子中虽都含有相反的官能团−−羟基,但是酚羟基仅限于直接连在芬芳环上,这种结构的差异使酚类与醇类的性质存在着清楚的不同。
通常醇类的羟基称为醇羟基,酚类的羟基称为酚羟基。
醚的官能团为醚键〔C-O-C〕,也可看作是醇或酚羟基上的氢被烃基〔-R或-Ar〕取代而生成的化合物。
醇、酚、醚的通式区分为:R-OH Ar-OH R-O-R′〔或Ar′〕醇酚醚醇、酚和醚都属于重要的基本无机化合物。
它们在医药、化装品等方面具有普遍的运用,可用作消毒剂、防腐剂、保湿剂、抗氧剂、麻醉剂、溶剂等。
第一节醇醇类是最罕见、运用最普遍的无机化合物。
醇也是制备各种无机物的重要原料,如由醇制备卤代烃、醛、酮、羧酸和酯类等多种无机物。
一、醇的结构醇的通式为R-OH,醇也可看作是水分子的一个氢原子被脂肪烃基取代后的生成物。
以最复杂的醇−−甲醇CHOH为例,其C-O-H3键的键角为108.9°,故以为醇羟基的氧原子为不等性sp3杂化,外层6个电子散布在四个sp3杂化轨道上,其中两个单电子区分占有两个sp3杂化轨道,与C和H区分构成O-C键和O-H键,余下两对未共用电子对区分占有另外两个sp3杂化轨道,构成的O-H键那么以交叉式优势构象介于两个C-H键之间。
如图10-1所示。
交叉式优势构象介于两个C-H键之间。
如图10-1所示。
CHH H OHHHH透视式Newman投影式球棒模型图10-1甲醇的优势构象和结构表示图二、醇的分类和命名(一)、醇的分类1、依据羟基所连结的碳原子类型,醇可以分为:伯醇〔1°醇〕、仲醇〔2°醇〕、和叔醇〔3°醇〕。
R-CH2-OH R-C-OH′CR″OH′R伯醇仲醇叔醇2、依据羟基所连结的烃基结构不同,醇可分为饱和醇、不饱和醇和芬芳醇。
烃的含氧衍生物复习课教案高雪梅【教学目标】1.复习烃含氧衍生物类别、性质、反应类型及相互转化。
2.了解有机合成过程,把握有机合成遵循的基本原则。
3.学会设计合理的有机合成路线。
4、能熟练运用官能团之间转化解答有机推断题。
【教学重点】1、各类烃含氧衍生物的化学性质2、学会设计合理的有机合成路线3、综合运用含氧衍生物之间的转化解决有机推断题。
【教学难点】逆向合成的思维方法【教学方法】归纳小结演绎推理【教学过程】【内容】:烃的含氧衍生物一、烃含氧衍生物的化学性质1、醇①醇与钠的反应,生成醇钠和氢气②跟氢卤化物反应生成卤代烃③脱水反应:140℃分子间脱水生成醚,170℃分子内脱水生成烯烃④氧化反应:燃烧;被催化剂氧化为醛⑤酯化反应:与酸反应生成酯2、酚①弱酸性,与氢氧化钠反应②取代反应:与浓溴水反应生成白色沉淀③显色反应:遇到FeCl3显紫色3、醛①加成反应:与氢气加成生成伯醇②具有还原性:可以被弱氧化剂氧化4、酸①具有酸的通性②与醇发生酯化反应5、酯①酸性水解,生成醇和酸②碱性水解,生成醇与羧酸钠二、有机合成1、官能团的引入(1)C=C的引入①卤代烃的消去②醇的消去③炔烃与氢气1:1 加成(2)—OH的引入①烯烃与水的加成反应;②醛(酮)与氢气的加成反应;③卤代烃的水解反应;④酯的水解反应。
(3)—X的引入①烷烃或苯的同系物与卤素单质的取代反应;②不饱和烃与HX或X2的加成反应;③醇或酚的取代反应。
2、碳链增长:有机合成题中碳链的增长,一般会以信息形式给出,常见方式为有机物与HCN的反应以及不饱和化合物间的加成、聚合等。
3、变短:如烃的劣化裂解,某些烃(如笨同系物、烯烃)的氧化、羧酸盐脱羧反应等。
4、成环:通过形成酯基成环、肽键成环、醚键成环等。
5、有机合成路线的选择。
有机合成往往要经过多步反应才能完成,因此确定有机合成的途径和路线时,就要进行合理选择。
选择的基本要求是原料价廉、原理正确、路线简捷、便于操作、条件适宜、易于分离、产率高、成本低,中学常用的合成路线有三条:2.已知:Ⅰ.冠心平 F 是降血脂、降胆固醇的药物,它的一条合成路线如下:(1)A 为一元羧酸,8.8 g A 与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),A 的分子式为________。