不对称合成—手性助剂法
- 格式:ppt
- 大小:192.00 KB
- 文档页数:19

有机化学中的手性催化剂应用于不对称合成手性催化剂是有机合成中一种重要的工具,它们能够有效地促进不对称合成反应,合成出具有高立体选择性的手性化合物。
手性化合物在药物、农药、香料等领域具有广泛的应用价值,因此手性催化剂的研究和应用一直备受关注。
手性催化剂的研究可以追溯到20世纪初,当时的研究主要集中在金属有机化合物的催化反应上。
然而,随着有机合成的发展和对手性化合物需求的增加,研究者们开始寻找新的手性催化剂,并发现了许多有效的有机催化剂。
不对称合成是有机合成中的一种重要反应类型,它能够合成出具有高立体选择性的手性化合物。
手性催化剂在不对称合成中起到了至关重要的作用。
它们能够选择性地催化反应的一个立体异构体,从而合成出具有高立体选择性的手性化合物。
手性催化剂的应用范围非常广泛。
例如,铂族金属配合物是一类常用的手性催化剂。
它们能够催化氢化、氢甲酰化、氢化醛等反应,合成出具有高立体选择性的手性醇、醛等化合物。
此外,手性有机分子也被广泛应用于不对称合成中。
例如,手性配体能够与金属形成配位键,催化不对称氢化、不对称氧化等反应,合成出具有高立体选择性的手性化合物。
手性催化剂的应用还可以拓展到不对称催化反应中。
不对称催化是一种能够合成具有高立体选择性的手性化合物的重要手段。
手性催化剂能够选择性地催化反应的一个立体异构体,从而合成出具有高立体选择性的手性化合物。
不对称催化反应广泛应用于有机合成中,例如,不对称氢化、不对称氧化、不对称亲核取代等反应。
手性催化剂的应用还可以拓展到不对称合成中的其他领域。
例如,手性催化剂可以应用于合成手性药物。
手性药物具有高立体选择性,能够更好地与生物体相互作用,因此具有更好的药效和更低的副作用。
手性催化剂能够选择性地合成出具有高立体选择性的手性药物,从而提高药物的疗效。
手性催化剂的应用在有机化学中具有重要的意义。
它们能够有效地促进不对称合成反应,合成出具有高立体选择性的手性化合物。
手性化合物在药物、农药、香料等领域具有广泛的应用价值。

手性药物及其不对称合成[摘要]近年来不对称合成法应用在手性药物及药物中间体的制备中,使手性药物得到了快速的发展,不少手性药物及其中间体已经实现了工业化生产。
本文介绍了手性药物及获取手性药物的方法,对不对称合成法尤其是不对称催化法在手性药物工业制备中的应用进行了综述。
[关键词]手性药物;制备;不对称合成;不对称催化Chiral Drugs and Asymmetric SynthesisAbstract: In recent years ,since the asymmetric synthesis has been used in preparation of the chiral drugs and pharmaceutical intermediates ,there has been fast development in preparation of chiral drugs ,some of which has been already synthesed in industry scale .What is chiral drugs and the ways to abtain the chiral drugs are introduced .The methods of asymmetric synthesis,especially asymmetric catalytic reaction used in synthesis chiral drugs are reviewed .Key words :chiral drugs ,preparation , asymmetric synthesis;asymmetric catalytic synthesis1 引言2001 年10 月10 日,瑞典皇家科学院决定将2001年度诺贝尔化学奖授予在催化不对称反应领域做出突出贡献的3 位科学家:威廉·诺尔斯,野依良治与巴里·夏普赖斯。

有机化学中的不对称合成在有机化学领域中,不对称合成是一项重要的研究领域,它可以有效地合成具有手性的有机分子。
手性分子在药物合成、天然产物合成以及材料科学等领域中具有重要的应用价值。
本文将探讨不对称合成的基本概念、方法和应用,并介绍一些常见的不对称合成反应。
一、不对称合成的基本概念不对称合成是指通过使用手性起始原料或手性催化剂,合成出具有手性的有机分子的化学合成方法。
在不对称合成中,合成的产物具有不对称的结构或旋光性。
与对称合成相比,不对称合成可以得到具有更高的立体选择性和手性纯度的产物。
不对称合成的基本原理是利用手性诱导或手性催化剂来选择性地激活反应物中的一个面或一个手性中心,从而控制反应的立体选择性。
手性诱导合成方法包括拆分法、不对称催化、酶催化和手性助剂等。
其中,不对称催化是最为常见的方法,它通过使用手性催化剂,使化学反应以特定的立体选择性进行。
二、不对称合成的方法1. 手性诱导合成手性诱导合成是通过使用手性起始原料或手性诱导剂来进行的合成方法。
手性诱导合成包括手性拆分法和手性诱导剂法。
手性拆分法是通过将手性分子与反应物进行化学或物理上的拆分,使得反应物在反应过程中保持立体选择性。
手性拆分法包括光学拆分法、金属配合物拆分法和手性分子的稳定性拆分法等。
手性诱导剂法是通过使用手性诱导剂来引发反应中的手性识别过程,从而控制反应的立体选择性。
手性诱导剂法包括非手性基团诱导和手性感受性诱导。
2. 不对称催化合成不对称催化合成是通过使用手性催化剂来实现的合成方法。
手性催化剂能够选择性地提供一个特定的反应路径,从而控制反应的立体选择性。
不对称催化合成通常包括氢化、氧化、醇缩合、酯化、醚化等反应。
不对称催化合成中最有代表性的方法是手性配体催化法。
手性配体催化法通过使用手性配体配位于金属催化剂上,使催化剂具有手性识别能力,从而实现对反应物的选择性激活。
3. 酶催化合成酶催化合成是通过使用天然酶或人工改造酶来进行的合成方法。

非对称催化和手性合成的研究和应用非对称催化是一种重要的有机合成方法,它是将不对称催化剂加入反应体系中,促使反应发生的一种方法。
通俗地说,非对称催化即是用左右手不同的手套去操作手动工具。
非对称催化技术因其高效、高选择性和环保,已成为现代有机合成化学中最重要的研究领域之一。
而在非对称催化的基础上,手性合成技术的发展依 then迅速,取得了优异的成就。
一、非对称催化的发展历程非对称催化起源于20世纪60年代,当时的美国化学家基斯威特(William S. Knowles)和日本化学家野依良治(Ryoji Noyori)分别发现了镍质催化剂和银催化剂对于烯烃和酮化合物的不对称催化反应。
这一发现为非对称催化技术的发展奠定了基础。
1987年,野依良治等人发现了不对称催化剂的高催化效率,推动了非对称催化技术的广泛应用。
近年来,随着合成技术的不断发展,非对称催化技术的研究越来越深入,已广泛应用于药物合成、材料科学、化学生物学及两性荧光探针化学等领域。
二、非对称催化的基本原理非对称催化技术的关键在于催化剂的立体化学性质。
通常,催化剂由两部分组成,即基团和配体,配体的成分决定催化剂的立体化学性质。
在不对称催化中,立体异构体对于反应过程的速率和化学选择性均有显著的影响。
因此,在反应中只有对于立体异构体易于选择的某个立体异构体才能催化反应剩,称之为手性催化剂。
非对称催化的另一个重要原理是立体失活。
在反应中,由于反应物吸附到催化剂的某一面上,导致反应物只能在这一侧发生反应,从而使反应物在催化剂表面发生立体失活。
三、手性合成的发展历史手性合成是无机化合物、有机分子和生物体中重要的发展方向之一。
在手性化合物的制备中,非对称催化反应是最重要的手法之一,它与混合酸催化、酶催化等手法相得益彰,在应用上常常可以相互补充。
通过不断探索、发展和改进,科学家们开发出了多种具有各种不同选择性和高效的催化剂,手性合成技术得到迅速发展。
这个领域的里程碑是加那利群岛的诺贝尔化学家莫里斯·威廉森(Morris William Williamson)和埃德蒙·希哈德(Edmund H. Hirst)发现了化学反应的对称性质,从而引领了手性合成技术的发展。

有机化学中的不对称合成方法探索有机化学是研究碳和碳之间的化学反应的学科,而不对称合成则是有机化学中一种重要的方法,通过该方法可以合成具有立体异构体的有机分子。
不对称合成方法的探索对于有机化学的发展具有重要意义。
在有机化学中,合成有机分子的方法多种多样,但是往往会产生两种或多种立体异构体。
而对于某些药物、天然产物或手性材料来说,只有其中一种立体异构体具有所需的生物活性或物理性质。
因此,合成具有特定立体异构体的有机分子就成为了有机化学的重要课题之一。
早期的不对称合成方法主要是通过手性试剂或催化剂来实现的。
例如,利用手性试剂进行不对称还原反应可以得到具有特定立体异构体的醇或胺。
而利用手性催化剂进行不对称催化反应可以实现对手性酮、醛或烯烃的不对称合成。
这些方法虽然有效,但是手性试剂或催化剂的合成和回收往往比较困难,限制了这些方法的应用范围。
随着有机化学的发展,研究人员不断探索新的不对称合成方法。
其中一种重要的方法是利用手性配体催化剂进行不对称合成。
手性配体催化剂是一种具有手性结构的有机分子,可以与金属离子形成手性配合物,从而实现对手性反应的催化。
这种方法的优势在于手性配体催化剂可以通过合成进行调整,从而得到更高的催化活性和选择性。
同时,手性配体催化剂可以通过简单的溶剂萃取或柱层析等方法进行回收和再利用,降低了合成成本。
除了手性配体催化剂,还有一种被广泛应用的不对称合成方法是利用手性辅基催化剂。
手性辅基催化剂是一种具有手性辅基的有机分子,可以与底物形成手性中间体,从而实现对手性反应的催化。
与手性配体催化剂相比,手性辅基催化剂的合成更加简单,且催化效果也往往更好。
这种方法的优势在于手性辅基催化剂可以通过简单的结构修饰进行调整,从而得到更高的催化活性和选择性。
此外,还有一些新的不对称合成方法正在被研究和开发。
例如,利用手性催化剂和手性辅基催化剂的组合催化反应可以实现对手性反应的高效催化。
利用手性小分子催化剂进行不对称合成也是一个研究热点,这种方法可以通过合成简单的小分子催化剂来实现对手性反应的催化。

不对称反应及应用—手性合成前沿研究不对称合成是有机化学领域中一种重要的合成方法,通过该方法可以制备手性分子,即具有手性空间结构的有机分子。
手性分子在药物、农药、材料等领域具有广泛的应用价值,因此手性合成一直是有机化学研究的热点之一、不对称反应是实现手性合成的核心技术之一,其优势在于可以选择性地控制产物的手性结构,提高产品的立体选择性和产率。
本文将重点介绍不对称反应及其在手性合成前沿研究中的应用。
不对称反应是指在反应中产生手性产物,同时控制产物手性结构的过程。
不对称反应主要包括催化剂不对称反应和合成不对称反应两大类。
催化剂不对称反应是通过手性催化剂促进反应进行,如不对称氢化、不对称氨基化、不对称烯基化等。
合成不对称反应是通过手性试剂实现反应不对称性,如不对称亲核取代、不对称环化等。
不对称反应在有机合成中起着重要的作用,可以用于制备手性有机分子、手性药物等。
手性合成是有机化学研究的重要方向之一,目前在手性合成领域中,不对称反应的研究是一个热点。
一些新型不对称反应的开发和应用正在成为手性合成领域的前沿研究。
例如,最近几年来,金属催化的不对称反应得到了广泛关注。
金属催化的不对称反应具有底物范围广、反应条件温和等优点,因此在手性合成中具有广阔的应用前景。
目前,已经有许多金属催化的不对称反应已经成功开发,例如不对称氢化、不对称羟基化、不对称氨基化等。
此外,还有一些其他新型的不对称反应也在手性合成领域中得到了应用。
例如,不对称有机催化反应、不对称电化学反应等。
不对称有机催化是利用手性有机分子作为催化剂促进反应的进行,该方法具有催化条件温和、底物范围广等优点,因此在手性合成中具有很大的应用潜力。
不对称电化学反应是通过电化学手性诱导实现反应的手性选择性,该方法具有可控性强等优点,可以用于制备手性分子。
总的来说,不对称反应及其在手性合成领域的应用是有机化学研究的热点之一,不同类型的不对称反应各有特点,可以根据具体的需求选择合适的方法。

有机化学中的不对称合成与手性识别随着有机合成化学的发展,不对称合成成为了有机化学的重要分支之一。
不对称合成可用于合成手性分子,这对于药物开发、材料科学等领域具有重要意义。
不对称合成主要通过手性识别与手性鉴定来实现。
一、手性的基本概念与性质手性是物质在空间中存在两种非对称结构的性质,包括左旋和右旋两种形式。
手性分子与手性识别密切相关,不同立体异构体的物理、化学性质有可能截然不同。
二、不对称合成的方法不对称合成是合成手性分子的重要方法之一,下面介绍几种常用的不对称合成方法。
1. 手性催化剂法手性催化剂法是使用具有手性结构的催化剂来实现不对称合成。
催化剂可以是金属配合物、有机物或生物催化剂。
这种方法在有机合成中应用广泛,通过调控催化剂的结构,可以获得高产率和高立体选择性的产物。
2. 代谢法代谢法是利用生物体内的酶或细胞进行不对称合成。
通过筛选具有对底物选择性的酶或细胞,可以实现高立体选择性的合成。
代谢法适用于某些天然产物的合成,但对于大规模合成存在一定的限制。
3. 动力学分辨法动力学分辨法利用反应速率差异来实现不对称合成。
通常情况下,反应速率较快的反应产生一种立体异构体,速率较慢的反应产生另一种立体异构体。
通过合理设计反应条件,可以实现高立体选择性的合成。
三、手性识别与手性鉴定在不对称合成中,手性识别和手性鉴定是非常重要的环节。
手性识别是指通过识别手性配体或手性底物与手性催化剂之间的相互作用来实现立体选择性合成。
手性识别可以通过多种手段实现,包括非共价相互作用、手性诱导效应等。
手性鉴定是指对合成产物进行手性分析,确定合成产物的立体结构。
手性鉴定方法有很多,包括圆二色光谱、核磁共振等。
这些方法通过分析产物在物理性质上的差异来判断其立体异构体。
手性识别和手性鉴定在不对称合成过程中起着至关重要的作用。
只有准确的手性识别和手性鉴定,才能保证合成产物的立体选择性。
四、不对称合成的应用不对称合成在药物合成、天然产物合成、材料合成等领域具有广泛的应用。



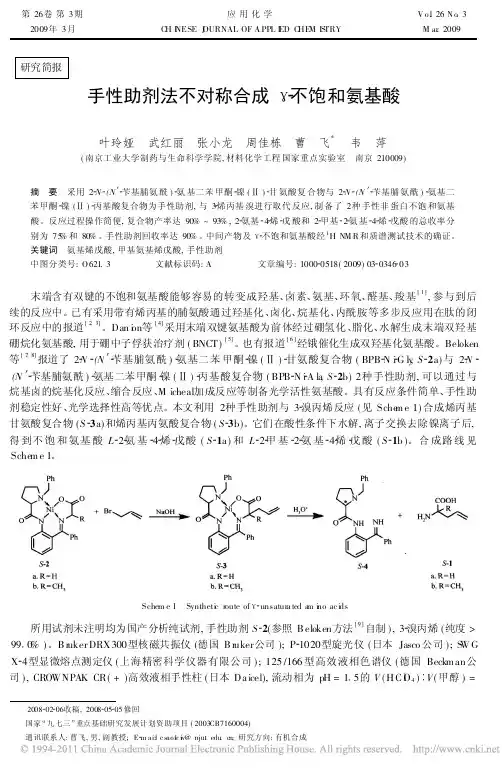
第26卷第3期应用化学V o.l26N o.3 2009年3月 C H I NESE J OURNAL OF A PPL I ED C HE M IS TRY M ar.2009研究简报手性助剂法不对称合成 不饱和氨基酸叶玲娅 武红丽 张小龙 周佳栋 曹 飞* 韦 萍(南京工业大学制药与生命科学学院,材料化学工程国家重点实验室 南京210009)摘 要 采用2 N (N 苄基脯氨酰) 氨基二苯甲酮 镍() 甘氨酸复合物与2 N (N 苄基脯氨酰) 氨基二苯甲酮 镍() 丙基酸复合物为手性助剂,与3 烯丙基溴进行取代反应,制备了2种手性非蛋白不饱和氨基酸。
反应过程操作简便,复合物产率达90%~93%,2 氨基 4 烯 戊酸和2 甲基 2 氨基 4 烯 戊酸的总收率分别为75%和80%。
手性助剂回收率达90%。
中间产物及 不饱和氨基酸经1H NM R和质谱测试技术的确证。
关键词 氨基烯戊酸,甲基氨基烯戊酸,手性助剂中图分类号:O621.3 文献标识码:A 文章编号:1000 0518(2009)03 0346 03末端含有双键的不饱和氨基酸能够容易的转变成羟基、卤素、氨基、环氧、醛基、羧基[1],参与到后续的反应中。
已有采用带有烯丙基的脯氨酸通过羟基化、卤化、烷基化、内酰胺等多步反应用在肽的闭环反应中的报道[2,3]。
Dan i o n等[4]采用末端双键氨基酸为前体经过硼氢化、脂化、水解生成末端双羟基硼烷化氨基酸,用于硼中子俘获治疗剂(BNCT)[5]。
也有报道[6]经锇催化生成双羟基化氨基酸。
Beloken 等[7,8]报道了2 N (N 苄基脯氨酰) 氨基二苯甲酮 镍() 甘氨酸复合物(BPB N i G ly,S 2a)与2 N (N 苄基脯氨酰) 氨基二苯甲酮 镍() 丙基酸复合物(BPB N i A la,S 2b)2种手性助剂,可以通过与烷基卤的烷基化反应、缩合反应、M icheal加成反应等制备光学活性氨基酸。
有机合成中的不对称合成方法有机合成是化学领域中的一项重要研究领域,它涉及到合成有机化合物的方法和技术。
其中,不对称合成方法是一种重要的合成策略,它能够有效地合成具有手性的有机分子。
本文将介绍几种常见的不对称合成方法,并探讨其在有机合成中的应用。
一、不对称合成方法的概述不对称合成方法是指在有机合成中,通过使用手性试剂或催化剂,将对称的起始物转化为手性产物的合成方法。
这种方法能够有效地合成具有手性的有机分子,具有广泛的应用前景。
二、手性试剂法手性试剂法是一种常见的不对称合成方法,它通过使用手性试剂将对称的起始物转化为手性产物。
手性试剂可以是手性草酸、手性胺等,它们能够与起始物发生反应,形成手性产物。
这种方法具有反应条件温和、操作简单等优点,广泛应用于不对称合成中。
三、催化剂法催化剂法是一种重要的不对称合成方法,它通过使用手性催化剂将对称的起始物转化为手性产物。
手性催化剂可以是金属配合物、有机小分子等,它们能够催化起始物的反应,形成手性产物。
这种方法具有反应条件温和、产物选择性高等优点,被广泛应用于不对称合成中。
四、不对称合成方法的应用不对称合成方法在有机合成中具有广泛的应用。
首先,不对称合成方法可以用于合成手性药物。
手性药物具有较高的生物活性和选择性,能够更好地与生物体发生相互作用,因此在制药领域中具有重要的应用价值。
其次,不对称合成方法可以用于合成手性农药。
手性农药具有良好的杀虫、杀菌活性,能够更好地保护农作物,提高农业产量。
此外,不对称合成方法还可以用于合成手性材料、手性催化剂等,具有广泛的应用前景。
五、不对称合成方法的发展趋势随着科学技术的不断发展,不对称合成方法也在不断创新和改进。
一方面,研究人员不断寻找新的手性试剂和催化剂,提高不对称合成的效率和选择性。
另一方面,研究人员也在探索新的反应体系和反应条件,拓宽不对称合成的应用范围。
未来,不对称合成方法将继续发展,为有机合成提供更多的选择和可能性。
非对称催化合成和手性理论的研究手性是指分子具有左右对称性,因此左右手之间的手性在科学研究中扮演着重要的角色。
在化学领域中,手性被广泛应用于药物、化学品、材料等领域的研究,因为手性决定着分子的性质和活性。
非对称催化合成是一种通过催化剂作用于反应物形成手性产物的反应,非常适合于手性产物制备。
本文将深入剖析非对称催化合成和手性理论的研究。
一、催化剂在非对称催化合成中,催化剂是至关重要的。
催化剂能够促进反应的速率,控制化学反应的选择性和手性。
目前,广泛应用的催化剂包括手性配体、酶类、金属有机骨架(MOL)等。
其中,手性配体催化被认为是最有效的催化方法之一。
手性配体催化通过影响反应物分子的手性结构来控制反应的选择性和手性产物的形成。
配体通常是手性分子,具有左右对称性,可以与金属离子形成配位络合物。
金属离子配合了手性配体之后,其活性中心具有一定的不对称性,从而可以控制选择性和手性。
例如,鲁氏催化剂(RuPhos)是一种广泛应用的手性催化剂,由二苯基胺配体与钌离子配合而成。
通过鲁氏催化剂的作用,不对称C-C键形成方法得到了广泛的应用,成为非对称催化合成的典型方法之一。
二、手性化学的理论基础手性化学理论是研究手性分子如何相互作用的一门学科。
根据手性分子之间的相互作用可以分为对映异构体间的相互作用(光学活性能够旋转线偏振光的现象)和对称异构体间的相互作用(只能旋转平面偏振)手性对应着非中心对称,也就是说,手性分子的左右部分并不完全对称。
因此,手性分子之间的相互作用受到多种因素的影响,包括空间位阻、电荷、键能和极性等。
在实施非对称催化合成的过程中,也需要考虑手性分子之间的相互作用。
例如,需要避免反应路径上的不对称因素,防止产生对映异构体的混合物。
三、应用非对称催化合成在化学领域中具有广泛的应用。
其中,应用最广的领域为制药和材料科学。
制药化学:手性化合物在制药领域的应用非常广泛,因为手性决定了分子的活性和选择性。
然而,很多药物分子都是手性的,而且手性异构体的性质及其药效差异非常大。
有机化学中的不对称合成方法有机化学是一门研究有机物结构、性质和合成方法的学科。
在有机化学中,不对称合成方法是一种重要的研究领域。
不对称合成方法可以用于合成具有特定空间结构和生物活性的有机分子,对于药物研发、农药合成等领域具有重要意义。
本文将介绍几种常见的不对称合成方法。
一、手性诱导的不对称合成方法手性诱导的不对称合成方法是通过引入手性诱导剂来实现对手性产物的选择性合成。
手性诱导剂可以是手性配体、手性催化剂或手性试剂等。
其中,手性配体是一种常见的手性诱导剂。
通过选择合适的手性配体,可以控制反应中的立体选择性,实现对手性产物的选择性合成。
二、不对称催化的不对称合成方法不对称催化是一种常用的不对称合成方法。
在不对称催化中,手性催化剂被用于引发化学反应,从而实现对手性产物的选择性合成。
不对称催化可以分为金属催化和有机催化两大类。
其中,金属催化是指利用手性过渡金属配合物作为催化剂,而有机催化则是指利用手性有机分子作为催化剂。
不对称催化的不对称合成方法具有反应条件温和、产物产率高等优点,已经成为有机化学中的重要研究方向。
三、不对称还原的不对称合成方法不对称还原是一种常见的不对称合成方法,通过利用手性还原剂对不对称亲核试剂进行还原反应,从而实现对手性产物的选择性合成。
不对称还原的不对称合成方法可以分为金属催化还原和酶催化还原两大类。
其中,金属催化还原是指利用手性金属催化剂对不对称亲核试剂进行还原反应,而酶催化还原则是指利用手性酶对不对称亲核试剂进行还原反应。
不对称还原的不对称合成方法具有反应条件温和、产物产率高等优点,广泛应用于有机合成领域。
四、不对称加成的不对称合成方法不对称加成是一种常用的不对称合成方法,通过利用手性试剂对不对称底物进行加成反应,实现对手性产物的选择性合成。
不对称加成的不对称合成方法可以分为不对称亲电加成和不对称亲核加成两大类。
其中,不对称亲电加成是指利用手性亲电试剂对不对称底物进行加成反应,而不对称亲核加成则是指利用手性亲核试剂对不对称底物进行加成反应。
有机合成中的不对称催化探索手性化合物的新途径手性化合物在药物领域、农药制备、化学催化等领域具有广泛应用。
不对称合成手性化合物是一项复杂而具有挑战性的任务。
传统的不对称合成方法通常依赖于手性诱导剂或手性催化剂,但常常受到选择性、产率等问题的限制。
近年来,不对称催化成为探索手性化合物新途径的热点领域,以其高产率、高选择性的特点受到了广泛关注。
一、不对称催化的基本原理不对称催化是指在化学反应中引入手性催化剂,以实现对手性物质的选择性催化。
它的基本原理是通过手性催化剂与底物之间的相互作用,使得反应发生在特定构型的手性中心处,从而得到手性纯的产物。
催化剂可通过形成空间定向的极性相互作用、氢键键合、金属有机配合物的形成等方式,实现对反应的催化控制。
二、金属催化剂在不对称催化中的应用金属催化剂在不对称催化中发挥着重要的作用。
过渡金属如铂、钯、铜等可通过改变活性中心的配位构型、形成手性催化剂来实现不对称催化。
以手性配体为辅助剂的手性金属催化剂能够在不对称合成中实现高产率和选择性。
此外,手性手性金属有机配合物也可以通过架桥或者配体胁迫形成手性中心,实现不对称催化反应。
三、催化剂设计与合成不对称催化中,催化剂的设计与合成是关键环节。
合理设计催化剂的活性中心结构以及配体的选择对反应的产率和选择性具有重要影响。
通过合成手性配体,可以实现不对称催化剂的高选择性,同时,可以通过调整配体的电子性质、手性手性诱导剂的引入等手段,对反应的底物范围进行扩展,从而实现对手性化合物的高效合成。
四、新兴的催化方法除了金属催化剂,一些新兴的催化方法也在不对称合成中被广泛探索。
例如,有机小分子催化剂、有机光催化剂等,这些催化剂以其便于合成和调节活性的特点受到研究人员的关注。
有机小分子催化剂可以通过小分子之间的相互作用,实现对手性中心的选择性催化。
有机光催化剂则通过光敏剂的作用,激发化学反应的进行,从而实现不对称合成。
五、潜在的应用领域不对称催化作为一种高效、选择性的反应手段,具有广阔的应用前景。
有机化学中的手性合成方法研究在有机化学领域中,手性合成方法的研究一直备受关注。
手性分子是指镜像对称,但无法相互重叠的分子。
手性化合物在医药、生物学和材料科学等领域具有重要应用价值,因此,发展手性合成方法对于有机化学研究具有重要的意义。
本文将探讨一些常见的手性合成方法及其应用。
1. 不对称合成法不对称合成法是最常用的手性合成方法之一。
这种方法通过利用手性诱导剂,即手性催化剂或手性试剂,使得合成产物具有手性。
手性诱导剂可以选择手性配体或酶,通过配位或催化反应,实现手性的转化和扩增。
例如,罗朗斯长年研究的金属有机催化合成手性化合物的方法就是成功的示范。
2. 动态合成法动态手性合成法是利用手性物质或外源手性试剂在反应过程中进行动态转变的合成方法。
通常,手性反应物以非手性方式进入反应体系,然后通过某种方式进行反应,使得一部分产物变成手性。
这种方法可以利用一些具有手性记忆特性的反应体系来实现。
例如,一些手性催化剂在反应中发生动态转变,从而产生手性产物。
3. 不对称诱导手性合成法不对称诱导手性合成法是利用具有手性势能面的反应体系来实现手性合成。
手性诱导剂在反应中通过各种方式引导反应物在特定的路径上反应,从而形成手性产物。
这种方法常见的应用是通过溶剂分子的手性诱导来控制合成产物的手性。
此外,手性模板效应也是一种应用广泛的手性诱导手性合成方法。
4. 代谢酶催化合成法代谢酶催化合成法是利用生物酶作为催化剂来实现手性合成的方法。
这种方法常用于制备手性药物和天然产物。
酶催化合成具有反应温和、对环境友好等优点。
同时,通过对酶的改造和重组,可以进一步提高手性合成的效率和产物的手性纯度。
总结起来,有机化学中的手性合成研究主要集中在不对称合成法、动态合成法、不对称诱导手性合成法以及代谢酶催化合成法等方面。
这些方法在手性药物合成、天然产物合成和材料化学等领域具有广泛的应用前景。
进一步的研究和发展将促进手性合成方法的进一步突破,为有机化学领域的发展做出更大的贡献。