药分试验四—制剂含量均匀度的检查概要
- 格式:ppt
- 大小:1.42 MB
- 文档页数:4


含量均匀度检查标准操作规程1 简述1.1 本法适用于中国药典2005年版二部附录X E含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量的均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.4 除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg或主药含量小于每片(个)重量5%者;其他制剂,每个标示量不大于2mg或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效度与毒副反应浓度比较接近的品种或混匀工艺较困难的品种,每片(个)标示量不大于25mg 者,也应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光关度法测定含量均匀度时,所用溶剂需一下配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检查方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,求其均值和标准差S(S= )以及标示量与均值之差的绝对值A(A=|100- |)。

作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 1 页共 4 页第二版同意李忠华初审吴雅凝草拟李鑫含量均匀度检查法1简述本法合用于含量均匀度检查。
在生产过程中,某些小剂量的剂型因为工艺或设施的原由,可惹起含量均匀度的差别。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的正确。
含量均匀度系指单剂量的固体系剂、半固体系剂和非均相液体系剂含量符合标示量的程度。
除还有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于 25mg 或主药含量小于每一个单剂重量 25%者;药物间或药物与辅料间采纳混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应切合要求的制剂,均应检查含量均匀度。
复方制剂仅检查切合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
凡检查含量均匀度的制剂,不再检查重(装)量差别;当所有主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差别。
含量均匀度的限度应切合各品种项下的规定。
2仪器与器具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法供试品初试10片(个),复试20片(个)。
除还有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 2 页共 4 页第二版同意李忠华初审吴雅凝草拟李鑫供试品的主药一定溶解完整,必需时可用乳钵研磨或超声办理,促进溶解,并定量转移至量瓶中。
测准时溶液一定澄清,如过滤不清,可离心后,取澄清液测定。
用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即便是同批号的溶剂,也应混淆均匀后使用。
6记录与计算应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
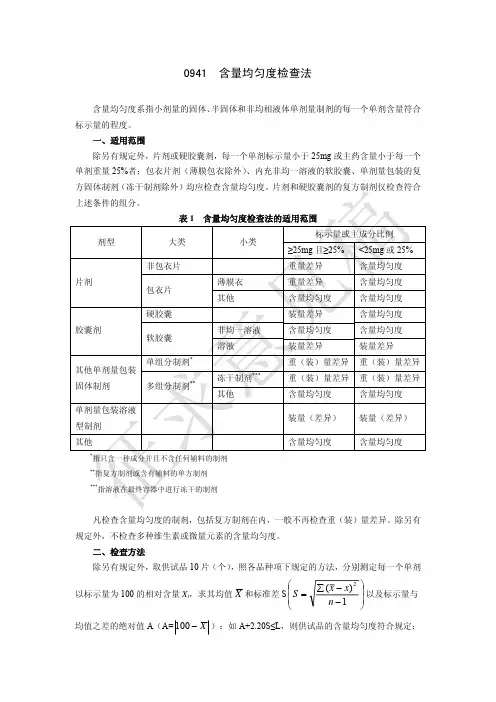
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。



含量均匀度检查法1简述1.1本法适用于含量均匀度检查。
1.2在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg 或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6含量均匀度的限度应符合各品种项下的规定。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),复试20片(个)。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,_ I °(Xi X)2求其均值X和标准差S(S ■. i 1〔)以及标示量与均值之差的绝对值A(A 100 X )。

目的:制订含量均匀度检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:含量均匀度检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于《中国药典》2010年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.3在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.4除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量不大于每片(个)重量25%者;内容物为非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),如需要复试,另取20片(个)。
取样应随机抽取,不应采用其他的方式筛选。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据6.2根据测定的响应值,分别计算出每片(个)以标示量为100的相对含量X,并求其均值X和标准差S(()12--=∑nXXS)以及标示量与均值之差的绝对值A(XA-=100)。
《药物分析与检验》项目化课程任务单7工会党支部工作总结[工会党支部工作总结] xxxx年,我们工会党支部在师直党工委的正确领导下,认真学习贯彻“三个代表”重要思想,学习党的十六届四中全会精神,自觉用“三个代表”重要思想指导工作,进一步加强党支部的建设,在工作中较好的发挥了政治核心和战斗堡垒作用,工会党支部工作总结。
现将xxxx年的支部工作情况总结汇报如下。
一、努力加强党支部的思想建设、组织建设和作风建设1.思想建设:在工会全体党员中继续深入学习邓小平理论和“三个代表”的重要思想。
在党的十六大四中全会召开以后,认真学习大会的精神和文件,特别是对全会讨论通过的《关于加强中国共产党执政能力建设的决定》,不仅在支部成员内部认真学习贯彻,而且还在工会全体工作人员中传达贯彻学习。
坚持严肃认真地进行党员民主评议工作,切实解决党支部、党员中存在的问题和不足,努力提高全体党员的思想认识,为圆满完成全年的各项工作,提供思想保证。
同时开好领导班子民主生活会,认真征集职工意见,认真开展批评与自我批评,找差反思,并进行认真整改,进一步完善领导班子的工作。
全年共召开民主生活会2次,均取得了良好效果,大家普遍反映心更近了,关系更融洽了,工作氛围更加和谐了,团队的力量更加强大了。
2.加强党支部的组织建设,发挥先锋模范作用。
支部坚持“三会一课”制度,按时召开支委会、支部大会和党课学习,坚持党支部委员经常碰头,有问题及时研究解决。
努力提高组织生活质量,发挥党支部战斗力。
继续认真做好对入党积极分子的培养教育和考察、引导工作。
党支部认真贯彻《关于进一步开展“创建学习型组织,争做知识型职工”活动的通知》,认真组织党员参加学习,结合部门工作具体实际,发动党员积极投入“创争”活动,为我师的职工素质工程作出积极的贡献。
在支部内部,充分发挥领导干部和骨干党员的先锋模范作用,带动了支部工作跃上了一个新的台阶。
经支部考核评议,推荐经济工作部部长唐志刚同志为“优秀党员”和“优秀公务员”。

含量均匀度系指小剂量口服固体制剂、粉雾剂或注射用无菌粉末中的每片(个)含量偏离标示量的程度。
除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量小于10mg 或主药含量小于每片(个)重量5%者;其他制剂,每个标示量小于2mg或主药含量小于每个重量2%者,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
凡检查含量均匀度的制剂,不再检查重(装)量差异。
除另有规定外,取供试品10片(个),照各药品项下规定的方法,分别测定每片以标示量为100的相对含量X,求其均值X和标准差S以及标示量与均值之差的绝对值A(A=∣100-X ∣);如A+1.80S≤15.0,即供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
如该药品项下规定含量均匀度的限度为±20%或其他值时,应将上述各判断式中的15.0改为20.0或其他相应的数值,但各判断式中的系数不变。
在含量测定与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值求出每片含量情况下,可取供试品10片(个),照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y.另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值Y,得比例系数K(K=XA/Y)。
将上述诸响应值Y 与K相乘,求得每片标示量为100的相对含量(%)X(X=KY),同上法求X和S以及A,计算,判定结果,即得。
1.目的:建立含量均匀度检查法(二部)检验标准操作规程,并按规程进行检验,保证检验操作规范化。
2.依据:2.1.《中华人民共和国药典》2010年版二部。
3.范围:适用于所有用含量均匀度检查法(二部)测定的供试品。
4.责任:检验员、质量控制科主任、质量管理部经理对本规程负责。
5.正文:5.1. 含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
5.1.1. 除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量小于每片(个)重量25%者;内容物非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
5.1.2. 凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
5.2.除另有规定外,取供试品10片(个),照各品种项下规定的方法,分别测定每片(个)以标示量为100的相对含量X,求其均值和标准差S[]以及标示量与均值之差的绝对值A(A=│100- |);如A+1.80S≤15.0,则供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值、标准差S和标示量与均值之差的绝对值A:如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
5.3. 含量均匀度的限度应符合各品种项下的规定。
除另有规定外,单剂量包装的口服混悬剂、内充混悬物的软胶囊剂、胶囊型或泡囊型粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或半固体制剂,其限度均应为±20%;透皮贴剂、栓剂的限度应为±25%。
5.4. 如该品种项下规定含量均匀度的限度为±20%或其他数值时,应将上述各判断式中的15.0改为20.0或其他相应的数值,但各判断式中的系数不变。
含量均匀度检查标准操作规程1 简述1。
1 本法适用于中国药典2005年版二部附录X E含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量的均匀度的差异.本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.4 除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg 或主药含量小于每片(个)重量5%者;其他制剂,每个标示量不大于2mg或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效度与毒副反应浓度比较接近的品种或混匀工艺较困难的品种,每片(个)标示量不大于25mg 者,也应检查含量均匀度。
复方制剂仅检查符合上述条件的组分.1。
5 凡检查含量均匀度的制剂,不再检查重(装)量差异.1。
6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4。
1 供试品初试10片(个),复试20片(个).4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量.5 注意事项5。
1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5。
2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定.5。
3 用紫外—可见分光关度法测定含量均匀度时,所用溶剂需一下配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用.6 记录与计算6。
1 应记录所用检查方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,求其均值和标准差S(S= )以及标示量与均值之差的绝对值A(A=|100-|)。
作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 1 页共 4 页第二版同意李忠华初审吴雅凝草拟李鑫含量均匀度检查法1简述本法合用于含量均匀度检查。
在生产过程中,某些小剂量的剂型因为工艺或设施的原由,可惹起含量均匀度的差别。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的正确。
含量均匀度系指单剂量的固体系剂、半固体系剂和非均相液体系剂含量符合标示量的程度。
除还有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于 25mg 或主药含量小于每一个单剂重量 25%者;药物间或药物与辅料间采纳混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应切合要求的制剂,均应检查含量均匀度。
复方制剂仅检查切合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
凡检查含量均匀度的制剂,不再检查重(装)量差别;当所有主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差别。
含量均匀度的限度应切合各品种项下的规定。
2仪器与器具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法供试品初试10片(个),复试20片(个)。
除还有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 2 页共 4 页第二版同意李忠华初审吴雅凝草拟李鑫供试品的主药一定溶解完整,必需时可用乳钵研磨或超声办理,促进溶解,并定量转移至量瓶中。
测准时溶液一定澄清,如过滤不清,可离心后,取澄清液测定。
用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即便是同批号的溶剂,也应混淆均匀后使用。
6记录与计算应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
目的:制订含量均匀度检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:含量均匀度检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于《中国药典》2010年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.3在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.4除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量不大于每片(个)重量25%者;内容物为非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),如需要复试,另取20片(个)。
取样应随机抽取,不应采用其他的方式筛选。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据6.2根据测定的响应值,分别计算出每片(个)以标示量为100的相对含量X,并求其均值X和标准差S(()12--=∑nXXS)以及标示量与均值之差的绝对值A(XA-=100)。
含量均匀度检查法(总4页)本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March0 9 4 1 含量均匀度检查法本法用于检查单剂量的固体、半固体和非均相液体制剂含量符合标示量的程度。
在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检査符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
凡检査含量均匀度的制剂,一般不再检査重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
除另有规定外,取供试品10个,照各品种项下规定的方法,分别测定每一个单剂以标示量为100的相对含量X,求其均值和标准差S以及标示量与均值之差的绝对值A (A = | 100-| ) 。
若A + S≤ L,则供试品的含量均匀度符合规定;若A + S > L,则不符合规定;若A + S > L,且A + S < L ,则应另取供试品20个复试。
根据初、复试结果,计算30个单剂的均值、标准差S和标示量与均值之差的绝对值A 。
再按下述公式计算并判定。
当A≤0.25 L时,若A2+ S2≤0.25L2,则供试品的含量均匀度符合规定;若A2+ S2> 0.25L2则不符合规定。
当A > 0.25L时,若A + ≤L,则供试品的含量均匀度符合规定;若A + > L,则不符合规定。
上述公式中L 为规定值。