含量均匀度检查标准操作规程
- 格式:doc
- 大小:16.00 KB
- 文档页数:3

含量均匀度操作规程1. 引言含量均匀度是评价药物制剂质量的重要指标之一。
合格的药物制剂应该在整个批次中保持均匀的含量,以确保每个剂量单元的有效成分符合规定的标准。
本操作规程旨在规范含量均匀度测试的操作流程,确保测试结果准确可靠。
2. 适用范围本操作规程适用于药物制剂的含量均匀度测试。
3. 仪器和试剂准备3.1. 含量均匀度测试所需仪器包括:分析天平、振荡器、试验管等。
3.2. 所需试剂包括:待测试的药物制剂样品、溶剂等。
4. 操作步骤4.1. 准备工作 4.1.1. 将分析天平校准至合适的灵敏度和准确度。
4.1.2. 准备适量的溶剂,满足测试样品的溶解需求。
4.2. 试样制备 4.2.1. 将药物制剂样品称取合适的质量,并记录质量值。
4.2.2. 将样品溶解于适量的溶剂中,并充分混合均匀,以得到均一的样品溶液。
4.3. 空白样品制备 4.3.1. 准备相同质量的溶剂,作为空白样品。
4.3.2. 将溶剂倒入试验管中,作为空白样品。
4.4. 振荡测试 4.4.1. 将试样管和空白样品管放入振荡器中。
4.4.2. 设置振荡器的参数,如振荡频率、振荡时间等。
4.4.3. 开始振荡测试,并确保试样管和空白样品管在相同条件下振荡。
4.5. 含量测定 4.5.1. 将振荡结束后的试样管和空白样品管取出。
4.5.2. 使用分析天平分别称取试样管和空白样品管中的溶液质量,并记录质量值。
4.5.3. 计算试样的含量,根据以下公式:含量 = (试样溶液质量 - 空白溶液质量) / 试样质量 x 100%5. 结果评定与记录5.1. 根据所制备的样品,计算每个样品的含量。
5.2. 通过对含量数据进行统计分析,计算均值和相对标准偏差。
5.3. 判断样品的含量均匀度是否符合规定的标准范围。
5.4. 将测试结果进行记录,并进行必要的数据分析和报告。
6. 风险与安全措施6.1. 在操作过程中要注意个人安全,并遵守实验室安全规定。

含量均匀度检查标准操作规程1 简述1。
1 本法适用于中国药典2005年版二部附录X E含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量的均匀度的差异.本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.4 除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg 或主药含量小于每片(个)重量5%者;其他制剂,每个标示量不大于2mg或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效度与毒副反应浓度比较接近的品种或混匀工艺较困难的品种,每片(个)标示量不大于25mg 者,也应检查含量均匀度。
复方制剂仅检查符合上述条件的组分.1。
5 凡检查含量均匀度的制剂,不再检查重(装)量差异.1。
6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4。
1 供试品初试10片(个),复试20片(个).4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量.5 注意事项5。
1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5。
2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定.5。
3 用紫外—可见分光关度法测定含量均匀度时,所用溶剂需一下配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用.6 记录与计算6。
1 应记录所用检查方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,求其均值和标准差S(S= )以及标示量与均值之差的绝对值A(A=|100-|)。

含量均匀度检查法含量均匀度检查法第1页共4页第二版批准李忠华初审吴雅凝起草李鑫含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项含量均匀度检查法第2页共4页第二版批准李忠华初审吴雅凝起草李鑫5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。

含量均匀度操作规程含量均匀度操作规程一、目的和范围为了确保制药工艺中药品含量均匀度的一致性,保证药物的质量,制定本操作规程。
本操作规程适用于制药工艺中含量均匀度的检测和调整。
二、定义1. 含量均匀度:指药品中各组分在一定范围内的分布是否均匀。
2. 均匀度检测:通过一定方法和仪器检测药品中各组分的含量分布情况,以评估均匀度。
3. 均匀度调整:根据均匀度检测结果,针对不符合要求的药品进行调整。
三、原料准备1. 按照生产工艺要求准备所需的原料。
2. 对原料进行检测,确保原料的含量和质量符合要求。
四、装备准备1. 保证使用的仪器设备处于良好的工作状态。
2. 根据检测方法准备所需的仪器和试剂。
3. 对仪器和试剂进行校准和检验,确保准确性和精确度。
五、检测操作1. 按照检测方法,将待检药品取样。
2. 准确称取样品,并将样品置于检测仪器中进行测定。
3. 检测结束后,记录检测结果。
4. 根据检测结果,评估样品的含量均匀度,并判断是否符合要求。
六、调整操作1. 如果样品的含量均匀度符合要求,则不需要进行调整操作。
2. 如果样品的含量均匀度不符合要求,根据不同的情况,采取相应的调整措施。
3. 调整措施可以包括调整原料比例、改变加工工艺、调整设备参数等。
4. 调整完成后,重新取样并进行检测,直到样品的含量均匀度符合要求为止。
七、记录和报告1. 对每次含量均匀度检测和调整操作进行详细记录,包括检测方法、检测结果、调整措施等。
2. 汇总记录,形成相应的报告,并进行归档。
3. 定期进行含量均匀度的总结和分析,分析调整的效果,并根据需要对操作规程进行修订和完善。
八、操作注意事项1. 操作人员必须熟悉检测方法和仪器的操作要求,确保准确性和可靠性。
2. 操作过程中,保持操作环境的清洁与整洁,防止污染样品。
3. 操作中应注意安全,遵守相关的操作规范和安全规程。
4. 定期对仪器设备进行维护和保养,确保其正常运行。
5. 检测和调整过程应记录详细,以便追溯和分析。


含量均匀度检查法操作规程一、仪器和试剂准备1.高效液相色谱仪(HPLC)及其附件;2.所需的标准品和质量控制品;3.色谱柱:选择合适的色谱柱,确保其适应检测的活性成分;4.进样器:设定合适的进样体积,保证样品浓度适中;5.洗涤溶剂和流动相:按照方法要求配置好洗涤溶剂和流动相;6.离心机:用于制备样品溶液;7.干燥器:用于干燥样品或试剂;8.重量计:用于称取试剂和样品;9.pH计:用于测定溶液的pH值;10.紫外可见分光光度计:用于检测溶液的吸光度。
二、操作步骤1.样品的制备(1)将样品药品的数量根据检测要求称取到干燥器中;(2)打开干燥器,将药品在低温下进行干燥,直到其完全干燥;(3)关闭干燥器,等待样品冷却;(4)将干燥后的样品用适量的洗涤溶剂溶解,并进行适当的振荡和离心;(5)取出上清液,即为样品溶液。
2.仪器的配置(1)打开HPLC仪器的电源,并进行预热和平衡;(2)将色谱柱连接好,保证其正常的流动相;(3)调整进样器的体积,设定合适的样品进入量;(4)检查流速、温度和检测波长等参数的设置是否正确。
3.样品的进样(1)用吸管或进样器将样品溶液吸入色谱柱;(2)调整进样器的进样速度和体积,确保样品进入量合适。
4.HPLC方法运行(1)启动HPLC仪器,进入相应的方法运行界面;(2)设置合适的流动相速度,保证样品的快速流动;(3)检测样品的吸光度,记录峰高和峰面积等数据。
5.数据分析与结果记录(1)将样品的吸光度数据转化为样品中活性成分的含量;(2)对各个样品进行含量均匀度分析;(3)判断样品的含量均匀度是否合格;(4)记录各个样品的含量均匀度结果。
6.结果的解释与判断(1)根据含量均匀度检查结果,判断样品的质量是否合格;(2)当样品的含量均匀度达到要求时,判定为合格;(3)当样品的含量均匀度不达标时,判定为不合格;(4)根据不同样品的含量均匀度结果,进行相应的药品调整或重配。
三、操作注意事项1.严格按照方法要求进行操作;2.仔细准备和称取样品和试剂,避免误差;3.所有仪器和试剂都要按照要求进行校准和质量验证;4.样品制备时要避免污染和杂质的存在;5.检查样品进样的速度和体积,保证其准确性和一致性;6.在HPLC方法运行过程中,监测仪器和管路的状态,并及时处理异常情况;7.数据分析和结果判定要准确、客观、合理;8.结果的解释和判断要全面、客观,并根据相应的质量标准进行评价;9.操作结束后,及时清洗和维护仪器设备,确保其正常使用。

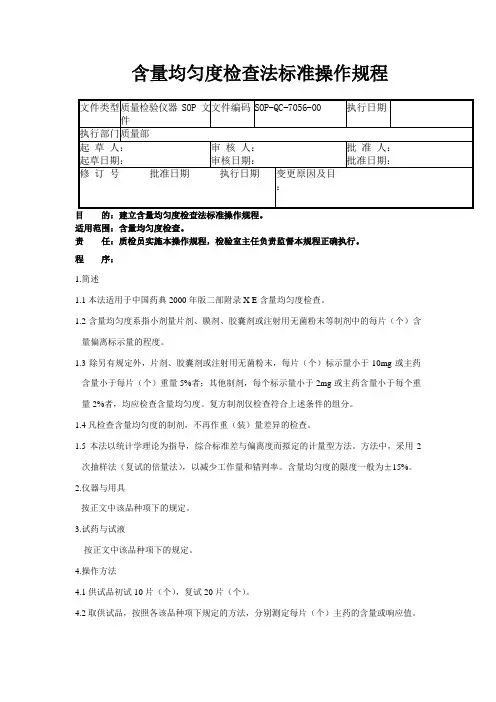
含量均匀度检查法标准操作规程目的:建立含量均匀度检查法标准操作规程。
适用范围:含量均匀度检查。
责任:质检员实施本操作规程,检验室主任负责监督本规程正确执行。
程序:1.简述1.1本法适用于中国药典2000年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量片剂、膜剂、胶囊剂或注射用无菌粉末等制剂中的每片(个)含量偏离标示量的程度。
1.3除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量小于10mg或主药含量小于每片(个)重量5%者;其他制剂,每个标示量小于2mg或主药含量小于每个重量2%者,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.4凡检查含量均匀度的制剂,不再作重(装)量差异的检查。
1.5本法以统计学理论为指导,综合标准差与偏离度而拟定的计量型方法。
方法中,采用2次抽样法(复试的倍量法),以减少工作量和错判率。
含量均匀度的限度一般为±15%。
2.仪器与用具按正文中该品种项下的规定。
3.试药与试液按正文中该品种项下的规定。
4.操作方法4.1供试品初试10片(个),复试20片(个)。
4.2取供试品,按照各该品种项下规定的方法,分别测定每片(个)主药的含量或响应值。
5.注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3用紫外分光光度计法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6.记录与计算6.1应记录检测方法,所用仪器型号,以及每片(个)测得的结果等。
6.2当含量测定方法与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值(如吸收度)求出每片(个)含量情况下,用系数校正法求得每片(个)以标示含量为100的相对含量X 。
6.2.1取供试品10片(个),照该药品含量均匀度项下规定的方法,分别测定,得每片(个)的响应值Y (可为吸收度或峰面积等),并求其均值Y 。

硫酸阿托品的含量均匀度检测
一、含量均匀度 取本品10片,每片单独置具塞试管中,精密加水6.0ml ,密塞,
充分振摇30分钟使硫酸阿托品溶解,离心,取上清液作为供试品溶液,精密量取供试品溶液与对照品溶液各2ml ,分别置预先精密加入三氯甲烷10ml 的分液漏斗中,各加溴甲酚绿溶液(取溴甲酚绿50mg 与邻苯二甲酸氢钾1.021g ,加0.2mol/L 氢氧化钠溶液6.0ml 使溶解,再用水稀释至100ml ,摇匀,必要时滤过)2.0ml ,振摇提取2分钟后,静置使分层,分取澄清的三氯甲烷液,照紫外-可见分光光度法(附录Ⅳ A ),在420nm 的波长处分别测定吸光度,计算,并将结果乘以1.027,即得。
A = ︳100- X ︳ 1
)(2
--=
∑
n X X S i
操作流程图见图16-2。
取本品10片,每片单独置具塞试管中,精密加水 6.0ml ,密塞,充分振摇30分钟使硫酸阿托品溶解;
离心,取上清液作为供试品溶液。
取硫酸阿托品对照品约25mg ,精密称定,置25ml 量瓶中,加水溶解并稀释至刻度,摇匀,精密量取5ml ,至100ml 量瓶中,用水稀释至刻度,摇匀,作为对照品溶液。
照紫外-可见分光光度法,在420nm 的波长处分别测定吸光度,计算,并将结果乘以1.027,即得。
精密量取供试品溶液与对照品溶液各2ml ,分别置预先精密加入三氯甲烷10ml 的分液漏斗中,各加溴甲酚绿溶液2.0ml ,振摇提取2分钟后,静置使分层,分取澄清的三氯甲烷液, 图16-2 溶液的配制及测定。

含量均匀度检查法1简述1.1本法适用于含量均匀度检查。
1.2在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg 或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6含量均匀度的限度应符合各品种项下的规定。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),复试20片(个)。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,_ I °(Xi X)2求其均值X和标准差S(S ■. i 1〔)以及标示量与均值之差的绝对值A(A 100 X )。

目的:制订含量均匀度检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:含量均匀度检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于《中国药典》2010年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.3在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.4除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量不大于每片(个)重量25%者;内容物为非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),如需要复试,另取20片(个)。
取样应随机抽取,不应采用其他的方式筛选。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据6.2根据测定的响应值,分别计算出每片(个)以标示量为100的相对含量X,并求其均值X和标准差S(()12--=∑nXXS)以及标示量与均值之差的绝对值A(XA-=100)。
含量均匀度检查法第1页共4页第二版批准李忠华初审吴雅凝起草李鑫含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项含量均匀度检查法第2页共4页第二版批准李忠华初审吴雅凝起草李鑫5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X ,求其均值X 和标准差)1)((12n X x S S ni i以及标示量与均值之差的绝对值)100(X AA 。
作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 1 页共 4 页第二版批准李忠华初审吴雅凝起草李鑫含量均匀度检查法1简述1.1本法适用于含量均匀度检查。
1.2在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于 25mg 或主药含量小于每一个单剂重量 25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6含量均匀度的限度应符合各品种项下的规定。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),复试20片(个)。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项作业指导书指导书编号TYFDC-SOP-FF-060含量均匀度检查法第 2 页共 4 页第二版批准李忠华初审吴雅凝起草李鑫5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解, 并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X ,求其均值X 和标准差)1)((12--=∑=n X xS S ni i以及标示量与均值之差的绝对值)100(X A A -=。
含量均匀度检查操作规程一、目的与适用范围二、检查设备和材料1.高效液相色谱仪(HPLC)及其附件2.资质合格的色谱柱3.合适的流动相4.校准样品及监控样品5.良好的实验室环境三、操作步骤1.准备样品选取不同批次的药品样品,确保样品的质量符合规定要求。
2.样品预处理根据样品的特性,选择适当的方法进行预处理,如加热、稀释等。
3.样品检测条件设定3.1确定检测波长和吸收峰根据药品成分的特性和前期研究结果,选择适合的检测波长和吸收峰。
3.2流动相配置根据样品的特性和前期研究结果,选择合适的流动相进行配置。
3.3柱温设定根据药品成分的特性和前期研究结果,设定合适的柱温。
4.均匀度检查4.1批间均匀度检查选取不同批次的样品,按照前述步骤进行检测。
根据检测结果,分析各批次样品的含量均匀度。
4.2批内均匀度检查选取同一批次的样品中的不同位置或不同时间点的样品,按照前述步骤进行检测。
根据检测结果,分析同一批次样品的含量均匀度。
5.结果分析与评价5.1计算方差和标准差根据所得数据,计算批间和批内的方差及标准差。
5.2比较均匀度结果将各个批次的含量均匀度结果进行比较,评估批间和批内的一致性。
5.3判定均匀度合格与否根据药品行业或国家药典等相关规定,判断所得结果是否符合合格标准,如果超出合格范围,需要进一步分析原因并采取相应措施。
6.结果记录记录样品信息、检测条件、实验数据、结果分析及评价等情况,并妥善存档。
四、注意事项1.操作过程中应严格按照操作规程执行,确保结果的准确性和可靠性。
2.检测设备应进行定期校验和维护,保证其工作状态良好。
3.样品的选取要具有代表性,以反映实际情况。
4.操作过程中要注意个人防护,避免接触有害物质,注意安全。
五、附录本操作规程为标准操作流程,具体实验操作应根据不同药品特性、设备型号和生产规模等因素进行相应的调整,并严格遵守相关法律法规要求。
含量均匀度检查法操作规程一、仪器设备准备1. 分析天平:保持精确度为0.1mg;2.烘箱:温度范围在50℃-60℃之间;3.恒温槽:温度控制在37℃±2℃;4.磁力搅拌器:控制搅拌速度;5. 分析天平:保持精确度为0.1mg;6.试管、烧杯等化学仪器:用于样品的测量和混合。
二、样品制备1.样品的选取:根据需要,选择符合要求的药品或化学物质样品;2.样品的研磨:取适量样品,用试样研磨器将其研磨成均匀的细末状;3.样品的称量:在精确天平上称取一定质量的样品,记录质量值;4.保存样品:将剩余样品冷藏或密封保存,以备后续使用。
三、实验操作1.样品溶液制备:取适量样品放入容量瓶中,加入适量稀释液,溶解并摇匀;2.容量瓶标定:用稀释液将溶液稀释至定容线,备用;3.标准曲线制备:准备一系列标准溶液,浓度递增,用于建立含量与吸光度的标准曲线;4.仪器预热:将分析仪器预热至固定温度,确保温度稳定;5.吸收光谱测定:将标准曲线各浓度标准溶液和样品溶液分别放置在分光光度计中,测量吸光度值;6.数据记录:记录各标准溶液和样品溶液的吸光度值;7.重复测量:对于每个样品,至少进行3次测量,计算吸光度的平均值。
四、数据处理1.标准曲线拟合:利用吸光度与浓度的线性关系,拟合标准曲线,并计算线性回归方程;2.含量计算:根据样品吸光度值和回归方程,计算出样品中活性成分的含量;3.均匀度计算:计算各个样品的含量偏差,判断含量的均匀度;4.平均值计算:对于多个样品,计算含量值的平均值和标准偏差;5.结果分析:根据均匀度和平均值的统计结果,评价样品的质量。
操作规程应该详细而准确地描述每个操作步骤,以确保实验的可重复性和正确性。
在实施实验前,还应进行前期验证和校准,以确保仪器和试剂的准确性和可靠性。
在实验过程中,应严格按照实验规程操作,及时记录实验数据,并对数据进行分析和处理。
最后,应根据实验结果评价样品的质量,并制定相应的质量控制措施。
含量均匀度检查标准操作规程
1 简述
1.1 本法适用于中国药典2005年版二部附录X E含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量的均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.4 除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg或主药含量小于每片(个)重量5%者;其他制剂,每个标示量不大于2mg或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效度与毒副反应浓度比较接近的品种或混匀工艺较困难的品种,每片(个)标示量不大于25mg 者,也应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具
按正文中该品种项下的规定。
3 试药与试液
按正文中该品种项下的规定。
4 操作方法
4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项
5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光关度法测定含量均匀度时,所用溶剂需一下配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算
6.1 应记录所用检查方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,求其均值和标准差S(S= )以及标示量与均值之差的绝对值A(A=|100- |)。
6.3 当含量测定方法与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值求出每片(个)含量的情况下,用系数校正罚求得每片(个)以标示量为100的相对含量X。
6.3.1 可取供试品10片(个0,照该品种含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸光度或峰面积等),求其均值。
6.3.2 另由含量测定法测得以标示量为100的含量X A,由X A除以响应
值的均值,得比例系数K(K=X A/ )。
6.3.3 将上述诸响应值Y与K相乘,求得每片(个)以标示量为100的相对含量(%)X(X=KY)。
同上法求和S以及A。
7 结果与判定
7.1 如A+1.80S≤15.0,即判为符合规定。
7.2 若A+S>15.0,即判为不符合规定。
7.3若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,即判为符合规定;若A+1.45S>15.0,则判为不符合规定。
7.4 如该品种项下规定含量均匀度的限度为±20%或其它数值时,应将上述各判断式中的15.0改为20.0或其它响应的数值,但各判定式中的系数不变。
除另有规定外,单剂量包装的口服混悬剂、内充混悬物的软胶囊剂、胶囊型或泡囊型粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或半固体制剂限度均应为±20%;透皮贴剂、栓剂限度应为±25%。