单剂量药物制剂含量均匀度测定法操作标准(EP)
- 格式:docx
- 大小:100.37 KB
- 文档页数:6


地西泮的含量均匀度检测
1.测定方法 取本品1片,置100ml 量瓶中,加水5ml ,振摇,使药片崩解后,加0.5%硫酸的甲醇溶液约60ml,充分振摇使地西泮溶解,用加0.5%硫酸的甲醇溶液稀释至刻度,摇匀,滤过,精密量取续滤液10ml ,置25ml 量瓶中,用0.5%硫酸的甲醇溶液稀释至刻度,摇匀,照紫外-可见光分光度法(附录ⅣA ),在284nm 的波长处测定吸光度,按C 16H 13CIN 2O
的吸收系数(%
11cm E )为454计算含量,应符合规定(附录Ⅹ E )。
1.计算
例 取规格为2.5mg 的地西泮片10片,照上述方法测定。
测得的吸光度分别为0.452、0.448、0.441、0.454、0.439、0.455、0.453、0.457、0.460、0.462。
试判定本品含量均匀度是否符合规定?
解 %100%1%%
1cm
1⨯⨯⨯⨯⨯=标示量
标示量E
V D A
式中 A 为吸光度;
%
11cm E 为百分吸收系数;
D 为稀释倍数;
V 为配制的第一个溶液体积。
%3.220%1005
.24541000
10010
25%1%A A =⨯⨯⨯⨯⨯
⨯=
标示量
列表
41.059.99100100=-=-=X A
()
65.11
1047.241
2
=-=
--=
∑n X
X
S
4.36
5.18.141.080.1=⨯+=+S A
即 0.1580.1≤+S A ,含量均匀度符合规定。
可使用计算器的统计功能键进行运算,迅速求得S X 和,比列表计算快捷。
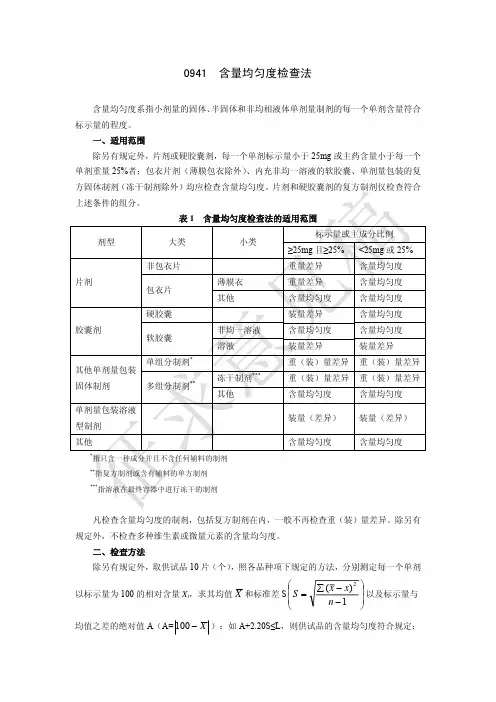
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。


含量均匀度检查法操作规程一、仪器和试剂准备1.高效液相色谱仪(HPLC)及其附件;2.所需的标准品和质量控制品;3.色谱柱:选择合适的色谱柱,确保其适应检测的活性成分;4.进样器:设定合适的进样体积,保证样品浓度适中;5.洗涤溶剂和流动相:按照方法要求配置好洗涤溶剂和流动相;6.离心机:用于制备样品溶液;7.干燥器:用于干燥样品或试剂;8.重量计:用于称取试剂和样品;9.pH计:用于测定溶液的pH值;10.紫外可见分光光度计:用于检测溶液的吸光度。
二、操作步骤1.样品的制备(1)将样品药品的数量根据检测要求称取到干燥器中;(2)打开干燥器,将药品在低温下进行干燥,直到其完全干燥;(3)关闭干燥器,等待样品冷却;(4)将干燥后的样品用适量的洗涤溶剂溶解,并进行适当的振荡和离心;(5)取出上清液,即为样品溶液。
2.仪器的配置(1)打开HPLC仪器的电源,并进行预热和平衡;(2)将色谱柱连接好,保证其正常的流动相;(3)调整进样器的体积,设定合适的样品进入量;(4)检查流速、温度和检测波长等参数的设置是否正确。
3.样品的进样(1)用吸管或进样器将样品溶液吸入色谱柱;(2)调整进样器的进样速度和体积,确保样品进入量合适。
4.HPLC方法运行(1)启动HPLC仪器,进入相应的方法运行界面;(2)设置合适的流动相速度,保证样品的快速流动;(3)检测样品的吸光度,记录峰高和峰面积等数据。
5.数据分析与结果记录(1)将样品的吸光度数据转化为样品中活性成分的含量;(2)对各个样品进行含量均匀度分析;(3)判断样品的含量均匀度是否合格;(4)记录各个样品的含量均匀度结果。
6.结果的解释与判断(1)根据含量均匀度检查结果,判断样品的质量是否合格;(2)当样品的含量均匀度达到要求时,判定为合格;(3)当样品的含量均匀度不达标时,判定为不合格;(4)根据不同样品的含量均匀度结果,进行相应的药品调整或重配。
三、操作注意事项1.严格按照方法要求进行操作;2.仔细准备和称取样品和试剂,避免误差;3.所有仪器和试剂都要按照要求进行校准和质量验证;4.样品制备时要避免污染和杂质的存在;5.检查样品进样的速度和体积,保证其准确性和一致性;6.在HPLC方法运行过程中,监测仪器和管路的状态,并及时处理异常情况;7.数据分析和结果判定要准确、客观、合理;8.结果的解释和判断要全面、客观,并根据相应的质量标准进行评价;9.操作结束后,及时清洗和维护仪器设备,确保其正常使用。


剂量单位均匀度测定法操作标准(EP)目录1.目的 (3)2.适用范围 (3)3.参考文件 (3)4.责任 (3)5.程序或内容 (3)6.变更历史记录 (6)7.再审核记录 (6)1. 目的:规范单剂量药物制剂含量均匀度(EP)检验操作,保证测定结果的准确无误。
2. 适用范围:适用于单剂量药物制剂含量均匀度(EP)的检测。
3. 参考文件:EP现行版。
4. 责任:检验员、检验室负责人、质量控制部负责人、质量保证部负责人对本标准执行负责。
5. 程序或内容5.1 为保证所有制剂剂量单位的均匀性,一批药物中的每个剂量单位的药物含量应在标示量的窄小范围内。
剂量单位是指每单位剂型中含单剂量药物或一个剂量的一部分药物的制剂。
除另有规定,剂量单位均匀度检查法不适用于单剂量包装的外用、皮肤用混悬剂、乳剂、凝胶剂。
多种维生素或微量元素一般不需要检查含量均匀度。
5.2 术语“剂量均匀度”是指各剂量单位中药物含量的均匀性程度。
因此,当剂量单位含有单一组分或多组分药物时,除本药典中另有说明,本章节规定适用于包含在剂量单位中的每个药物成分。
5.3 剂量单位均匀度可以通过两种方法表示:含量均匀度或重量差异(见表1)。
5.3.1 规定剂型的含量均匀度检查是基于测定制剂中单个药物成分的含量,来判定该药物成分的含量是否在设定的限度以内。
含量均匀度检查适用于剂量均匀度检查的所有制剂。
下述剂型可进行重量差异检查。
5.3.1.1 灌封于单剂量容器和软胶囊中的溶液剂。
5.3.1.2 包装在单剂量容器中并不含活性或非活性添加物的固体制剂(包括粉末、颗粒和无菌固体制剂)。
5.3.1.3 包装在单剂量容器中并含或不含活性或非活性添加物,由真溶液直接冻干制得的固体制剂(包括无菌固体制剂),该制剂应在标签上标注制法。
5.3.1.4 固体(包括无菌分针)包装在单次剂量的容器内,由溶液并且经过冷冻干燥而制得,包装于最终的容器中,并贴有标签标示这种剂型的制备方式。

0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。


含量均匀度检查法量均匀度系指小剂量片剂、膜剂、胶囊剂或注射用无菌粉末等制剂中的每片(个)含量偏离标示量的程度。
凡检查含量均匀度的制剂,不再检查重(装)量差异。
除另有规定外,取供试品10片(个),照各药品项下规定的方法,分别测定每片以标示量为100的相对含量X,求其均值X和标准差S①以及标示量与均值之差的绝对值A(A=│100-X|);如A+1.80S≤15.0,即供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
如该药品项下规定含量均匀度的限度为±20%或其他百分数时,应将上述各判断式中的15.0改为20.0或其他相应的数值,但各判断式中的系数不变。
在含量测定与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值(如吸收度)求出每片含量情况下,可取供试品10片(个),照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y。
另由含量测定法测得以标示量为100的含量X<[A]>,由X<[A]>除以响应值的均值Y,得比例系数K(K=X<[A]>/Y)。
将上述诸响应值Y与K相乘,求得每片标示量为100的相对百分含量X(X=KY),同上法求其均值X和S以及A,计算,判定结果,即得。
高效液相色谱法高效液相色谱法是用高压输液泵将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,经进样阀注入供试品,由流动相带入柱内,在柱内各成分被分离后,依次进入检测器,色谱信号由记录仪或积分仪记录。
1.对仪器的一般要求所用的仪器为高效液相色谱仪。

0941 含量均匀度检查法本法用于检查单剂量的固体、半固体和非均相液体制剂含量符合标示量的程度。
除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
凡检查含量均匀度的制剂,一般不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
除另有规定外,取供试品10个,照各品种项下规定的方法,分别测定每一个单剂以标示量为100的相对含量xi,求其均值和标准差以及标示量与均值之差的绝对值A(A=|100-|)。
若A+2.2S≤L,则供试品的含量均匀度符合规定;若A+S>L,则不符合规定;若A+2.2S>L,且A+S<L,则应另取供试品20个复试。
根据初、复试结果,计算30个单剂的均值、标准差S和标示量与均值之差的绝对值A。
再按下述公式计算并判定。
当A<0.25L时,若A2+S2≤0.25L2,则供试品的含量均匀度符合规定;若A2+S2>0.25L2则不符合规定。
当A>0.25L时,若A+1.7S≤L,则供试品的含量均匀度符合规定;若A+1.7S>L,则不符合规定。
上述公式中L为规定值。
除另有规定外,L=15.0;单剂量包装的口服混悬液、内充非均相溶液的软胶囊、胶囊型或泡囊型粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或半固体制剂L=20.0;透皮贴剂、栓剂L=25.0。
如该品种项下规定含量均匀度的限度为±20%或其他数值时,L=20.0或其他相应的数值。
当各品种正文项下含量限度规定的上下限的平均值(T)大于100.0(%)时,若<100.0,则A=100-;若100.0≤≤T,则A=0;若>T,则A=-T。
含量均匀度系指小剂量口服固体制剂、粉雾剂或注射用无菌粉末中的每片(个)含量偏离标示量的程度。
除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量小于10mg 或主药含量小于每片(个)重量5%者;其他制剂,每个标示量小于2mg或主药含量小于每个重量2%者,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
凡检查含量均匀度的制剂,不再检查重(装)量差异。
除另有规定外,取供试品10片(个),照各药品项下规定的方法,分别测定每片以标示量为100的相对含量X,求其均值X和标准差S以及标示量与均值之差的绝对值A(A=∣100-X ∣);如A+1.80S≤15.0,即供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
如该药品项下规定含量均匀度的限度为±20%或其他值时,应将上述各判断式中的15.0改为20.0或其他相应的数值,但各判断式中的系数不变。
在含量测定与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值求出每片含量情况下,可取供试品10片(个),照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y.另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值Y,得比例系数K(K=XA/Y)。
将上述诸响应值Y 与K相乘,求得每片标示量为100的相对含量(%)X(X=KY),同上法求X和S以及A,计算,判定结果,即得。
含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解, 并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X ,求其均值X 和标准差)1)((12--=∑=n X xS S ni i以及标示量与均值之差的绝对值)100(X A A -=。
目的:制订含量均匀度检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:含量均匀度检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于《中国药典》2010年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.3在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.4除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量不大于每片(个)重量25%者;内容物为非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),如需要复试,另取20片(个)。
取样应随机抽取,不应采用其他的方式筛选。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据6.2根据测定的响应值,分别计算出每片(个)以标示量为100的相对含量X,并求其均值X和标准差S(()12--=∑nXXS)以及标示量与均值之差的绝对值A(XA-=100)。
目的:制订含量均匀度检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:含量均匀度检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于《中国药典》2010年版二部附录X E含量均匀度检查。
1.2含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
1.3在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.4除另有规定外,片剂、胶囊剂或注射用无菌粉末,每片(个)标示量不大于25mg或主药含量不大于每片(个)重量25%者;内容物为非均一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和栓剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分。
1.5凡检查含量均匀度的制剂,一般不再检查重(装)量差异。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),如需要复试,另取20片(个)。
取样应随机抽取,不应采用其他的方式筛选。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声波处理,促使溶解,并定量转移至容量瓶中。
5.2用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据6.2根据测定的响应值,分别计算出每片(个)以标示量为100的相对含量X,并求其均值X和标准差S(()12--=∑nXXS)以及标示量与均值之差的绝对值A(XA-=100)。
剂量单位均匀度测定法操作标准(EP)
目录
1.目的 (3)
2.适用范围 (3)
3.参考文件 (3)
4.责任 (3)
5.程序或内容 (3)
6.变更历史记录 (6)
7.再审核记录 (6)
1. 目的:规范单剂量药物制剂含量均匀度(EP)检验操作,保证测定结果的准确无误。
2. 适用范围:适用于单剂量药物制剂含量均匀度(EP)的检测。
3. 参考文件:EP现行版。
4. 责任:检验员、检验室负责人、质量控制部负责人、质量保证部负责人对本标准执行负责。
5. 程序或内容
5.1 为保证所有制剂剂量单位的均匀性,一批药物中的每个剂量单位的药物含量应在标示量的窄小范围内。
剂量单位是指每单位剂型中含单剂量药物或一个剂量的一部分药物的制剂。
除另有规定,剂量单位均匀度检查法不适用于单剂量包装的外用、皮肤用混悬剂、乳剂、凝胶剂。
多种维生素或微量元素一般不需要检查含量均匀度。
5.2 术语“剂量均匀度”是指各剂量单位中药物含量的均匀性程度。
因此,当剂量单位含有单一组分或多组分药物时,除本药典中另有说明,本章节规定适用于包含在剂量单位中的每个药物成分。
5.3 剂量单位均匀度可以通过两种方法表示:含量均匀度或重量差异(见表1)。
5.3.1 规定剂型的含量均匀度检查是基于测定制剂中单个药物成分的含量,来判定该药物成分的含量是否在设定的限度以内。
含量均匀度检查适用于剂量均匀度检查的所有制剂。
下述剂型可进行重量差异检查。
5.3.1.1 灌封于单剂量容器和软胶囊中的溶液剂。
5.3.1.2 包装在单剂量容器中并不含活性或非活性添加物的固体制剂(包括粉末、颗粒和无菌固体制剂)。
5.3.1.3 包装在单剂量容器中并含或不含活性或非活性添加物,由真溶液直接冻干制得的固体制剂(包括无菌固体制剂),该制剂应在标签上标注制法。
5.3.1.4 固体(包括无菌分针)包装在单次剂量的容器内,由溶液并且经过冷冻干燥而制得,包装于最终的容器中,并贴有标签标示这种剂型的制备方式。
5.3.1.5 含药物成分25mg或25mg以上的硬胶囊、未包衣片或薄膜衣片,或药物成分占剂量单位总重量25%或25%以上时的的硬胶囊、未包衣片或薄膜衣片,硬胶囊按内容物重量计;其他重量比例低于25%的药物成分的均匀性检查符合含量均匀度规定的除外。
5.3.2 不满足上述重量差异检查条件的所有其他制剂都需要进行含量均匀度检查。
对于不满足25mg和25%限度规定的产品,当最终剂量单位中的药物成分含量的相对标准差(RSD)不超过2%时,可用重量差异检查代替含量均匀度检查。
这种RSD测定需基于工艺验证和工艺开发数据,或有规定支持这一变更。
这个含量RSD是指每个剂量单位浓度(m/m或者m/V)的RSD,此处每个剂量单位浓度系每个剂量单位的含量测定结果除以单个剂量单位重量而得。
(见表2的RSD相关公式)。
表1含量均匀度(CU)检查和重量差异(MV)检查在制剂中的应用
含量测定和含量均匀度检查的方法不同,必要时应建立一个校正因子对后者的实验结果进行校正。
5.4.1 固体制剂:用适合的分析方法分别测定10个剂量单位的含量,计算接受值(见表2)。
5.4.2 液体或半固体制剂:用适合的分析方法分别测定10个剂量单位的含量。
取单个容器,将内容物混匀,按正常使用说明吸出一定量进行含量测定,结果以给药剂量表示,计算可接受值(见表2)。
5.4.3 计算接受值:用下述公式计算A V值。
-
M+
X
ks
5.5 重量差异:采用适合的分析方法对批内的代表性样本进行药物成分的含量测定,所得数值用标示量的百分比—A来表示(见接受值计算)。
假定药物成分的含量(每剂量单位重量中药物成分的重量)是均一的。
取不少于30个剂量单位,并按如下相应的剂型进行操作。
5.5.1 未包衣或薄膜包衣片剂:取10片,分别精密称重,计算每片含量,即每片重量与含量测定结果的比值,以每片标示量的%表示,计算接受值。
5.5.2 硬胶囊:取10粒胶囊,分别精密称重,小心标记每粒胶囊。
用适宜的方法取出每粒胶囊的内容物,精密称量每粒胶囊壳,从相应的总重量减去胶囊壳重计算出每粒胶囊内容物的净重量。
从每粒胶囊内容物的净重量与含量测定结果计算出每粒胶囊中药物成分含量,计算接受值。
5.5.3 软胶囊:取10粒完整软胶囊,分别精密称重以得出其总重量,小心标记每粒胶囊。
用一清洁、干燥的适合切割工具如剪刀或锋利的开口刀片切开胶囊,并用适宜的溶剂洗出内容物。
室温放置30分钟,让滞留的溶剂从胶囊壳里挥发,注意预防吸收或损失水分。
精密称定胶囊壳重量,并计算内容物净重量。
从每粒胶囊中取出的内容物的重量与含量测定结果计算出每粒胶囊中的药物成分含量,计算接受值。
5.5.4 除片剂和胶囊剂以外的固体制剂:按照硬胶囊下的方法操作,并计算每一单位的含量,计算接受值。
5.5.5 液体或半固体制剂:取10个容器,分别精密称定按正常使用条件取出的全部液
体内容物。
如必要,按测得的溶液密度计算出相应体积。
从单个容器中取出的内容物量与含量测定结果计算出每个容器中的药物成分含量,计算接受值。
5.6 计算接受值:除剂量单位的单个含量被如下表所示的单个估算含量代替外,按含量均匀度项下的规定计算接受值。
这里W
A w x i i *
= =n w w w ,...,21所测剂量单位的单个重量。
A=用适宜分析方法测得的药物成分含量(标示量的%)。
W =重量的平均值。
表2
5.7.1 固体、半固体和液体剂型:
5.7.1.1 如果初试10个剂量单位的接受值小于或等于L1%,则剂量均匀度检查符合规定。
如果接受值大于L1%,则另取20个剂量单位试验,按含量均匀度或重量差异项下所规定的计算接受值。
如果前后30个剂量单位的接受值小于或等于L1%,且没有任何一个单位剂量少于(1-L2×0.01)M,或大于(1+L2×0.01)M,则认为是符合要求的。
除另有规定外,L1 =15.0, L2=25.0。
6. 变更历史记录。