微生物限度、控制菌检查记录
- 格式:docx
- 大小:37.26 KB
- 文档页数:3


【关键字】实验控制菌检查实验报告篇一:控制菌检查方法验证试验记录控制菌检查方法验证试验报告一、目的:确认供试品的抑菌活性及测定方法的可靠性。
二、内容:大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌测定。
三、菌种:金黄色葡萄球菌【CMCC(B)26003】、大肠杆菌【CMCC(F)44102】、乙型副伤寒沙门菌【CMCC(B)50094】、铜绿假单胞菌【CMCC(B)10104】、生孢梭菌【CMCC(B)64941】.四、方法:常规法();培养基稀释法();薄膜法();综合法()(依据《中国药典XX版》二部微生物限度检查法方法验证实验)五、验证方法:(1)试验组取ml供试液及ml(50~100cfu/ml)试验菌加入增菌培养基中,依相应控制菌检查法进行检查(2)阴性菌对照组方法同试验组,验证大肠杆埃希菌、大肠菌群、乙型副伤寒沙门菌检查法时的(本文来自:小草范文网:控制菌检查实验报告)阴性对照菌采用金黄色葡萄球菌;验证铜绿假单胞菌、金黄色葡萄球菌、生孢梭菌检查法时的阴性对照菌采用大肠杆埃希菌。
阴性对照菌不得检出。
六、试验记录:七、结论:通过以上方法学验证实验证明,采用稀释法();培养基稀释法();薄膜法();综合法()阳性代表菌株验证实验均符合要求, 故该方法适用于复核人:试验人:年月日篇二:控制菌检查控制菌检查简述控制菌检查是用于检查某些特定微生物,规定按一次检出结果为准,不再复试。
由于控制菌为一次性报告试验结果,故应注意方法的有效性确证(方法验证或阳性对照)、实验过程保障和结果确证,以提高检验结果的可靠性。
既要躲免漏检造成的假阴性结果,又要躲免实验室污染造成的假阳性结果。
控制菌检查中,涉及实验室监控菌株的分离鉴定、样品阳性菌株的分离分析、方法验证试验中的阳性菌操作等,应在专门的阳性菌实验室进行。
除另有规定外,阳性菌实验室应符合国家二级生物安全标准,阳性菌实验室应配备生物安全柜。
阳性菌操作不得在供试品检验用洁净实验室内进行。
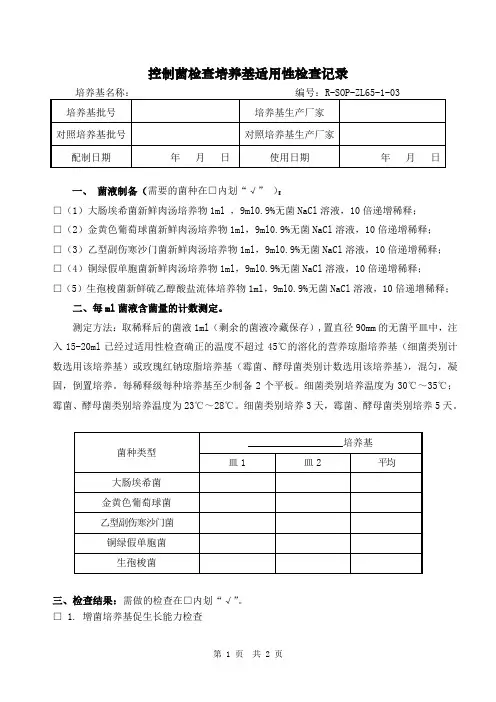
控制菌检查培养基适用性检查记录一、菌液制备(需要的菌种在□内划“√”):□(1)大肠埃希菌新鲜肉汤培养物1ml ,9ml0.9%无菌NaCl溶液,10倍递增稀释;□(2)金黄色葡萄球菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释;□(3)乙型副伤寒沙门菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释;□(4)铜绿假单胞菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释;□(5)生孢梭菌新鲜硫乙醇酸盐流体培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释;二、每ml菌液含菌量的计数测定。
测定方法:取稀释后的菌液1ml(剩余的菌液冷藏保存),置直径90mm的无菌平皿中,注入15-20ml已经过适用性检查确正的温度不超过45℃的溶化的营养琼脂培养基(细菌类别计数选用该培养基)或玫瑰红钠琼脂培养基(霉菌、酵母菌类别计数选用该培养基),混匀,凝固,倒置培养。
每稀释级每种培养基至少制备2个平板。
细菌类别培养温度为30℃~35℃;霉菌、酵母菌类别培养温度为23℃~28℃。
细菌类别培养3天,霉菌、酵母菌类别培养5天。
三、检查结果:需做的检查在□内划“√”。
□ 1. 增菌培养基促生长能力检查分别接种不大于100cfu的试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度及最短培养时间下培养。
与对照培养基管比较,被检培养基管试验菌。
检验标准:与对照培养基管比较,被检培养基管试验菌应生长良好。
结论:□ 2. 固体培养基促生长能力检查检验标准:被检培养基的菌落数与对照培养基菌落数相比大于70%,且菌落形态大小应与对照培养基上的菌落一致。
判该培养基的适用性检查符合规定。
结论:□ 3. 培养基抑制能力检查分别接种试验菌于被检培养基中,在相应控制菌检查规定的培养温度和时间下培养,试验菌。
检验标准:试验菌应不得生长。
结论:□ 4. 培养基指示能力检查分别接种少量试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度和时间下培养。

更改历史微生物限度检查操作规程1.0 目的建立微生物限度检查标准操作规程,规范检验操作,确保检验结果准确2.0 范围适用于本公司采用微生物限度检查法测定的供试品。
3.0 职责质量部负责按本规程的要求执行微生物限度检查操作。
4.0 工作程序4.1 洁净区间的确认微生物计数检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内或隔离系统中进行,其全部过程必须严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品(即待检样品、产品)中微生物的检出。
4.2 培养基4.2.1 应使用按中国药典处方及规定的方法制备的培养基。
4.2.2 所用培养基可按中国药典规定的处方及制备方法自行配制,也可使用按中国药典规定的处方生产的脱水培养基进行配制;或购买商品化的预制培养基。
4.2.3 配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基若不即时使用,应置于无菌密闭容器中,在2~25℃、避光的环境下保存。
4.2.4 胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基用于测定需氧菌总数;沙氏葡萄糖琼脂培养基用于测定霉菌和酵母菌总数。
4.2.5 供试品微生物计数、控制菌检查中所使用的培养基应进行适用性检查。
4.2.6 供试品的微生物计数方法、控制菌检查方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数或控制菌检查。
4.3 菌种及菌液制备检查所用的菌种及菌液制备见附件 1 微生物计数培养基的适用性检查和附件3 控制菌检查培养基的适用性检查。
稀释剂、冲洗液及其制备的要求见附件1 微生物计数培养基的适用性检查。
4.4 培养基的适用性检查供试品微生物计数、控制菌检查中所使用的培养基应进行适用性检查。
微生物限度检查所用的培养基每批均应进行适用性检查,检查可在供试品检查前或与供试品检查同时进行。
具体要求见附件1 微生物计数培养基的适用性检查和附件3 控制菌检查培养基的适用性检查。
4.5 方法适用性试验供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。

文档来源为:从网络收集整理.word 版本可编辑.欢迎下载支持.文件编号:73021微生物限度检查方法及其验证报告目录样品相关信息 基本信息主要仪器设备和试验耗材信息 主要使用的仪器设备 试验用培养基 试验用试剂 试验用菌种 试验环境 无菌室 洁净工作台 生物安全柜 试验方案 验证试验目的微生物限度检查方法草案 方法验证试验菌液制备计数培养基适用性检查控制菌检查用培养基使用性检查 供试液制备 方法验证菌落计数方法验证试验 控制菌检查方法的验证方法验证结论供试品微生物限度检查结果 样品相关信息 基本信息(三批)1 1.12 2.1 2.2 2.3 2.4 3 3.1 3.2 3.3 4 4.1 4.25 5.1 5.2 5.3 5.4 5.5 5.5.15.5.2 5.6 6 1 1.12主要仪器设备和试验耗材信息2.1主要使用的仪器设备2.2试验用培养基2.2.1对照培养基2.2.2试验用培养基2.3试验用试剂2.4试验用菌种3试验环境《中国药典》2015版规定,微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内进行。
本公司微生物限度室、阳性对照室、生物安全柜及超净工作台洁净度检测无特殊情况下每季度进行一次。
3.1无菌室无菌室按《医药工业洁净厂房设计规范》GB50457-2008监测,静态洁净度检测结果符合GB50457-2008对10000级洁净度要求。
3.2超净工作台超净工作台按《医药工业洁净厂房设计规范》GB50457-2008监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。
超净工作台沉降菌检测记录3.3生物安全柜生物安全柜按《生物安全实验室建筑技术规范》GB50346-2011监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。
生物安全柜沉降菌监测记录4试验方案按《中国药典》2015年版第四部:(通则1105)非无菌产品微生物限度检查:微生物计数法、(通则1106)非无菌产品微生物限度检查:控制菌检查法、(通则1107)非无菌药品微生物限度标准及(通则1121)抑菌效力检查法规定,本品微生物限度标准为:1g供试品中,需氧菌总数不得过lOOOcfu,霉菌和酵母菌总数不得过lOOcfu,大肠埃希菌不得检出。

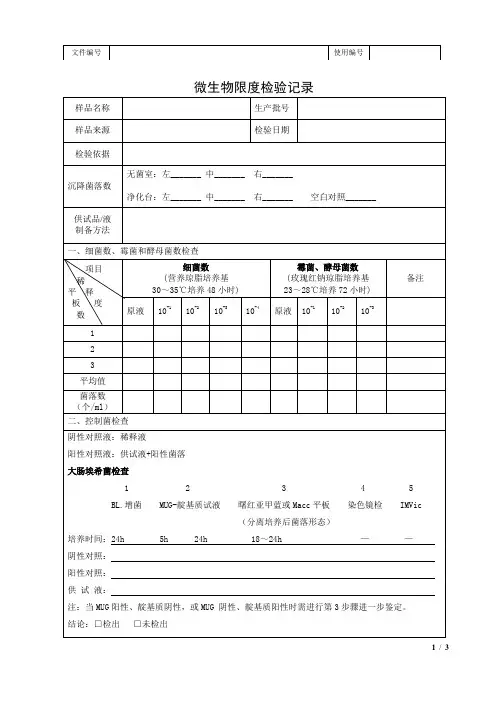
微生物限度检验记录一、检验目的:确认产品是否满足微生物限度要求,保证产品的安全性和质量。
二、检验项目:1.总大肠菌群:用于评估产品是否受到粪便污染。
2.霉菌和酵母菌:用于评估产品是否受到霉菌和酵母菌的污染。
3.沙门氏菌:用于评估产品是否受到沙门氏菌的污染,沙门氏菌是一种常见的食源性病原菌。
4.铜绿假单胞菌:用于评估产品是否受到铜绿假单胞菌的污染,铜绿假单胞菌是一种常见的致病菌。
5.谷氨酰胺酶阳性菌:用于评估产品是否受到谷氨酰胺酶阳性菌的污染,谷氨酰胺酶阳性菌是一种常见的致病菌。
三、检验步骤:1.样品准备:从产品中取得一定量的样品,确保样品的代表性。
2.样品处理:根据产品的不同特性,选择适当的方法进行样品处理,如水解、稀释等。
3.培养基制备:根据所需的检验项目,制备相应的培养基。
4.培养基接种:将处理后的样品接种到相应的培养基中,利用无菌技术确保操作的无菌。
5.培养:将接种过的培养基培养在适宜的温度和湿度条件下,培养一定的时间,一般为24-72小时。
6.检查结果:观察培养基上是否有菌落形成,记录菌落的数量和形态特征。
7.鉴定:对培养出的菌落进行进一步的鉴定,如形态学观察、生理生化特性测试等。
8.统计和分析:根据检查结果,统计并分析微生物的数量,计算出产品的微生物限度。
四、检验结果:1.总大肠菌群:每克不超过100个。
2.霉菌和酵母菌:每克不超过10个。
3.沙门氏菌:每克不得检出。
4.铜绿假单胞菌:每克不得检出。
5.谷氨酰胺酶阳性菌:每克不得检出。
五、检验记录样例:日期:2024年4月1日样品名称:XXX产品检验员:XXX检验项目:1.总大肠菌群结果:每克10个,符合微生物限度要求。
2.霉菌和酵母菌结果:每克2个,符合微生物限度要求。
3.沙门氏菌结果:未检出,符合微生物限度要求。
4.铜绿假单胞菌结果:未检出,符合微生物限度要求。
5.谷氨酰胺酶阳性菌结果:未检出,符合微生物限度要求。
六、结论:根据检验结果,XXX产品符合微生物限度要求,产品安全可靠。

中华人民共和国药典2000版二部微生物限度检查法附录Ⅺ J 微生物限度检查法微生物限度检查法系指非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法,包括染菌量及控制菌的检查。
供试品应随机抽样。
一般抽样量为检验用量(2个以上最小包装单位)的3倍量。
检查的全过程,均应严格遵守无菌操作,严防再污染。
除另有规定外,本检查法中细菌培养温度为30~35℃,霉菌、酵母菌培养温度为25 ~28℃,控制菌培养温度为36℃±1℃。
检验结果的报告以1g、1ml或10cm<2>为单位。
培养基及其制备方法除另有规定外,培养基制备的灭菌条件为121℃20分钟。
1.营养琼脂培养基与营养肉汤培养基见无菌检查法(附录Ⅺ H)2.玫瑰红钠琼脂培养基胨 5g 玫瑰红钠 0.0133g葡萄糖 10g 琼脂 15~20g磷酸二氢钾 1g 水 1000ml硫酸镁 0.5g除葡萄糖、玫瑰红钠外,取上述成分,混合,加热溶化后,滤过,加入葡萄糖、玫瑰红钠,分装,灭菌。
3.酵母浸出粉胨葡萄糖琼脂培养基(YPD)胨 10g 琼脂 15~20g酵母浸出粉 5g 水 1000ml葡萄糖 20g除葡萄糖外,取上述成分,混合,加热溶化后,滤过,加入葡萄糖,分装,灭菌。
4.胆盐乳糖培养基(BL)胨 20g 磷酸二氢钾 1.3g乳糖 5g 牛胆盐 1.3g氯化钠 5g (或去氧胆酸钠0.5g)磷酸氢二钾 4.0g 水 1000ml除乳糖、牛胆盐外,取上述成分,混合,加热使溶解,调节pH值使灭菌后为7.4±0.2, 煮沸,滤清,加入乳糖、牛胆盐,分装,灭菌。
5.曙红亚甲蓝琼脂培养基(EMB)营养琼脂培养基 100ml 曙红钠指示液 2ml20%乳糖溶液5ml 亚甲蓝指示液 1.3~1.6ml 取营养琼脂培养基,加热溶化后,冷至60℃,按无菌操作加入灭菌的其他3种溶液, 摇匀,倾注平皿。
6.麦康凯琼脂培养基(MacC)胨 20g 1%中性红指示液 3ml乳糖 10g 琼脂 15~20g牛胆盐 5g 水 1000ml氯化钠 5g除乳糖、指示液、牛胆盐及琼脂外,取上述成分,混合,加热使溶解,调节pH值使灭菌后为7.2±0.2,加入琼脂,加热溶化后,再加入其余各成分,摇匀,分装,灭菌,冷至60℃,倾注平皿。
青岛**有限公司文件目的建立微生物限度检查操作规程,规范操作,保证结果的准确性。
范围成品、辅料、内包装袋及纯化水的检验。
责任品管部微生物限度检验人员内容概述:本检验操作规程依据中国药典2015年版四部《通则1105 非无菌产品微生物限度检查:微生物计数法》和《通则1106 非无菌产品微生物限度检查:控制菌检查法》进行检查。
微生物计数法一、计数方法1.微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
2、计数方法本法包括平皿法、薄膜过滤法。
3、计数培养基适用性检查和供试品计数方法适用性检查供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确定采用的方法适合于该产品的微生物计数。
4、菌种及菌液的制备4.1试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0袋),并采用适宜的菌种保藏技术进行保藏。
计数培养基适用性检查和计数方法适用性试验见表1。
4.2菌液制备按表1规定培养各试验菌株。
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3-5ml含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。
采用适宜的方法吸出孢子悬液至无菌试管中,用含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢子悬液。
菌液制备后若在室温下放置,应在2小时内使用;若保存在2-8℃,可在24小时内使用。
黑曲霉孢子悬液可保存在2-8℃,在验证过的贮存期内使用。
表1 试验菌液的制备和使用4.3阴性对照为确认试验条件是否符合要求,应进行对照试验,阴性对照试验应无菌生长。
4.4培养基适用性检查按照表1规定,接种不大于100cfu的菌液至胰酪大豆胨液体培养基或胰酪大豆胨琼脂培养基平板或沙氏葡萄糖琼脂培养基平板,置规定的条件下培养。

2020版药典非无菌产品微生物限度检查:控制菌检查法控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
当本法用于检查非无菌制剂及其原、辅料等是否符合相应的微生物限度标准时,应按下列规定进行检验,包括样品取样量和结果判断等。
供试品检出控制菌或其他致病菌时,按一次检出结果为准,不再复试。
供试液制备及实验环境要求同“非无菌产品微生物限度检查:微生物计数法(通则1105)”。
如果供试品具有抗菌活性,应尽可能去除或中和。
供试品检查时,若使用了中和剂或灭活剂,应确认有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
培养基适用性检查和控制菌检查方法适用性试验供试品控制菌检查中所使用的培养基应进行适用性检查。
供试品的控制菌检查方法应进行方法适用性试验,以确认所釆用的方法适合于该产品的控制菌检查。
若检验程序或产品发生变化可能影响检验结果时,控制菌检查方法应重新进行适用性试验。
菌种及菌液制备菌种试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕乙型副伤寒沙门菌(Salmonella paratyphi B)〔CMCC(B)50 094〕白色念珠菌(Candida albicans)〔CMCC(B)98 001〕生孢梭菌(Clostridium sporogenes)〔CMCC(B)64 941〕菌液制备将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门菌分别接种于胰酪大豆胨液体培养基中或胰酪大豆胨琼脂培养基上,30~35℃培养18~24小时;将白色念珠菌接种于沙氏葡萄糖琼脂培养基上或沙氏葡萄糖液体培养基中,20~25℃培养2~3天;将生孢梭菌接种于梭菌增菌培养基中置厌氧条件下30~35℃培养24~48小时或接种于硫乙醇酸盐流体培养基中30~35℃培养18~24小时。
表:2.1-024微生物限度检查记录(通用)1. 常规法:取供试品10為1,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2. 薄膜过滤法:取供试品10mi ,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
吸取1:10的供试液10ml ,过滤,加0.1%无菌蛋白胨水溶液 300ml 分 三次冲洗,每次100ml ;冲洗后,将滤膜正贴于胰酪大豆胨固体培养基和沙氏葡萄糖琼脂培养基 上,每种培养基平行制备 2个平皿。
按平皿法测定其菌数。
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批)麦康凯琼脂培养基(配制批号: )供试液制备微生物限度检查记录、需氧菌总数检查30〜353〜5)、霉菌、酵母菌总数检查20C〜25C,5〜7天)三糖铁琼脂斜面穿刺接种 (18〜24h )三、控制菌检查 (30-35 C )检验者:表:2.1-024号:结论本品经按《中国药典》2015年版“非无菌产品微生物限度检查法”进行检验,结果审核者:微生物限度检查记录(丸剂)供试液制备供试液。
胰酪大豆胨增菌 (18〜24h )RV 沙门选择培养木糖赖氨酸脱氧胆酸分离培养(18〜48h )胰酪大豆胨液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)四、沙门菌检查 (30 °C 〜35C ) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:五、耐胆盐革兰阴性菌检杳胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:审核者:检验者: 表:2.1-024阴性对照阳性对照三、大肠埃希菌检查)、麦康凯液体培养基(配制批结果□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出/g)四、沙门菌检查(30°C〜35C)胰酪大豆东液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:、表: 2.1-024 微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)审核者:检验者:表:2.1-024 微生物限度检查记录(30〜353〜5天)、霉菌、酵母菌总数检查20C〜25C, 5〜7天)1、 口服液体药用聚酯瓶:取数个试瓶,加入1/2标示容量的氯化钠注射液,将盖旋紧,振摇1分钟,即得供试液。
微生物限度检验记录式样名称:________________种类:________________生产批号:___________________检验日期:___________________检验项目:微生物限度检验检验目的:为了评估样品的微生物质量,保证产品的安全性和稳定性。
检验原理:根据国家标准方法,对样品进行微生物限度检验。
检验仪器和试剂:1.培养基:牛肉膏培养基、营养琼脂培养基等2.培养基固化器3.可灭菌离心管4.称量仪5.稀释液6.离心机7.干燥器8.显微镜9.微量移液器和移液枪10.注射器11.恒温培养箱12.培养基平板13.称重天平14.微生物限度试剂15.培养基扩展工具16.无菌培养皿检验步骤:1.样品准备将样品称量约10g,加入已经去离子水或生理盐水中,并使用搅拌棒搅拌均匀,使样品完全悬浮。
2.稀释取1mL悬浮样品加入9mL稀释液中,得到10倍稀释液。
依序对稀释液进行1/10、1/100,求得合适的稀释倍数。
3.培养基涂布取样品稀释液分别用无菌鉴别板扩展在牛肉膏培养基和营养琼脂培养基上,使用温度适宜的顶酵母、肠球菌染色和试纸进行培养基涂布。
4.培养将涂布后的培养基平板密封好,放置在恒温培养箱中,设置适宜的培养温度和时间。
5.细菌计数培养箱培养结束后,取出培养基平板,使用显微镜对每个培养基平板上的细菌进行计数。
计算每个培养基平板上的菌落形成单位(CFU)数目。
6.菌种鉴定依据菌落形态、生理生化反应、药敏试验等方法进行菌种的初步鉴定,记录鉴定结果。
7.结果记录将每个培养基平板上的菌落形成单位数目记录在表格中,并记录每个菌落的特征和形态。
8.结论与建议根据检验结果,评估样品的微生物质量,判断样品是否符合限度标准。
如果有异常菌落存在,则建议进行进一步检验、处理或采取相应的措施。
记录:检验项目,检测结果--------------,-------------------------菌落计数,牛肉膏培养基:__CFU/g营养琼脂培养基:__CFU/菌种鉴定--------------,-------------------------鉴定结果:1.菌种1:________2.菌种2:________3.菌种3:________结论:样品通过微生物限度检验,各指标符合国家标准。
控制菌培养基检查记录菌培养基的控制是确保菌落的生长和繁殖的重要步骤。
在菌培养基检查记录中,需要包括以下内容:1.菌培养基的配制:记录每批菌培养基的配制方法和成分,包括蛋白水解物、肉汤、蔗糖、胰蛋白胨等基础成分的使用量和比例。
2.菌培养基的pH值测定:记录每批菌培养基的pH值,可以使用pH计或试纸进行测定。
pH值的正常范围通常在6.5-7.5之间。
3.菌培养基的差异性检查:记录每批菌培养基的外观、颜色、清澈度等差异性指标。
如果有任何异常现象,如悬浮物、沉淀物或浑浊度增加等,应进行详细描述。
4.菌培养基的温度检查:记录每批菌培养基的温度,可以使用温度计进行测定。
温度要根据菌种的要求进行调整,一般在37℃左右。
5.菌培养基的无菌性检查:记录每批菌培养基的无菌性检查结果。
无菌性检查可以通过培养基接种到无菌培养皿并观察是否有菌落生长来判断。
6.菌培养基的营养性检查:记录每批菌培养基的营养性检查结果。
可以通过接种标准菌种进行培养并观察菌落的生长情况和形态来判断菌培养基的营养性。
7.菌培养基的贮存条件:记录每批菌培养基的贮存条件,包括温度、湿度和光照等。
应确保菌培养基的贮存条件符合要求,以保证培养基的质量和活性。
8.菌培养基的保质期:记录每批菌培养基的保质期,以确保菌培养基的使用时间不超过保质期。
过期的菌培养基可能会导致菌落的生长受到影响。
在记录菌培养基检查时,需要详细、准确地记录每个参数的结果,以便日后的验证和分析。
此外,应定期检查并更新菌培养基检查记录,以保证菌培养基的质量控制和稳定性。