武汉理工大学-相图习题课
- 格式:pdf
- 大小:4.41 MB
- 文档页数:54


![大学物理化学相图题目[整理版]](https://uimg.taocdn.com/32bcaf300622192e453610661ed9ad51f01d5492.webp)
1、已知A 与B 能形成化合物A 3B,A 与B 不形成固溶体, C 点x A =0.5,D 点x A =0.6。
(1) 试完成下列A-B 固液相图;(2) 标明各相平衡区域的相态;(3) 画出从M 点冷却的步冷曲线。
解:ABx AC D800K- 600K- 500K- 400K--1000KM ·2、 等压下,Tl ,Hg 及其仅有的一个化合物 (Tl 2Hg 5) 的熔点分别为 303℃,-39℃,15℃。
另外还已知组成为含 8%(质量分数)Tl 的溶液和含41% Tl 的溶液的步冷曲线如下图。
Hg ,Tl 的固相互不相溶。
(1) 画出上面体系的相图。
(Tl ,Hg 的相对原子质量分别为 204.4,200.6)(2) 若体系总量为 500 g ,总组成为 10%Tl ,温度为 20℃,使之降温至 -70℃时,求达到平衡后各相的量。
解: (1) Tl 2Hg 5的组成204.42(T l )28.93%204.42200.65w ⨯==⨯+⨯,相图绘制如下。
(2) 设 -70℃时,Hg(s) 的质量为 x ,则固体化合物的质量为 (500 g - x ),根据杠杆规则:x (0.1 - 0) = (500 g - x )(0.2893 - 0.1) x = 327.3 g3、假设组分A和B能够形成一个不稳定化合物A2B,A的熔点比B的低,试画出该体系在等压下可能的温度—组成示意图,并标出各相区的相态。
解:A和 B 二组分体系的等压相图如下所示:还有一个可能的相图,A与B换位置。
4、Au和Sb熔点分别为1333K和903K,两者形成一种不稳定化合物AuSb2在1073K时分解,600K时该化合物与Sb形成低共熔混合物。
(1)试画出符合上述数据的示意相图,并填下表;(2)画出Au的质量分数为0.5的熔融物的步冷曲线。
解:相图与上面的类似。
5、利用下列数据,粗略地描绘出Mg -Cu 二组分凝聚系统相图,并标出各区的稳定相。

工程材料_武汉理工大学中国大学mooc课后章节答案期末考试题库2023年1.按照材料结合键的不同,通常把工程材料分、高分子材料、陶瓷材料和复合材料。
参考答案:金属材料2.能源、信息和被人们称为现代技术的三大支柱。
参考答案:材料3.对于同一钢材来说,当采用L=10d和L=5d的试件时,伸长率 d5和d10的关系是参考答案:d5>d104.铁素体是面心立方晶格,致密度是0.68。
()参考答案:错误5.铁碳相图中的ECF线通常叫A1线。
()参考答案:错误6.铁碳合金相图中S点的坐标是(0.77,727)。
()参考答案:正确7.170HBS10/1000/30表示用直径10mm的钢球,在9807 N(1000 kgf)的试验载荷作用下,保持30s时测得的值为170。
参考答案:布氏硬度8.碳钢随着含碳量的增加,其“C”曲线都不同程度地向右移动。
()参考答案:错误9.钢的含碳量越高,淬硬性越好,淬透性也好。
()参考答案:错误10.白口铸铁中或多或少都存在有莱氏体。
()参考答案:正确11.Cr12MoV钢中因为含Cr量较高,所以可以叫不锈钢。
()参考答案:错误12.马氏体的晶体结构是体心正方。
()参考答案:正确13.在平衡状态下,不论是钢还是白口铸铁,其相组成物总是铁素体和渗碳体。
()参考答案:正确14.弹簧热处理后喷丸处理可提高其使用寿命。
参考答案:正确15.如以含碳量为1.2% 的碳素工具钢代替20CrMnTi 钢制造汽车齿轮,不必渗碳而只要淬火加低温回火即可满足齿轮表硬心韧的性能要求。
参考答案:正确16.制造手用锯条应当选用( )。
参考答案:T12钢经淬火和低温回火17.冷冲模应选用下列哪种材料( )。
参考答案:T1218.渗碳体是亚稳定相,高温长时间加热会分解为(铁)和()参考答案:石墨19.45钢与40Cr钢相比,40Cr钢的淬透性(高)些,这是因为Cr使“C曲线”向(右)移动,造成Vk()的结果。


第12章相律与相图1.试计算下列平衡体系的自由度数:(1) 298.15 K、101 325Pa下固体NaCl与其水溶液平衡;(2) I2(s) ? I2(g);(3) NaCl(s)与含有HCl的NaCl饱和溶液。
(答案:①0,②1,③3)解:(1) K = 2, R = 0, b = 0, φ= 2∴C = K-R-b = 2, 又T, p已指定∴f = C -φ + n = 2- 2 + 0 = 0(2) K=1, R = 0, b = 0, φ=2∴C = K-R-b =1- 0- 0 =1则f = C -φ + n = 1- 2 + 2 = 1(3) K=3, R = 0, b = 0, φ=2则C = K-R-b =3–0–0 = 3∴f = C -φ + n =3- 2 + 2 = 32.固体NH4HS和任意量的H2S及NH3气体混合物组成的体系按下列反应达到平衡:NH4HS(s) ? NH3(g)+H2S(g)(1) 求该体系组元数和自由度数;(2) 若将NH4HS放在一抽空容器内分解,平衡时,其组元数和自由度数又为多少?(答案:①2,2,②1,1)解:(1) K=3, R = 1, b = 0, φ=2∴C = K-R-b =st1:chsdate Year="2000" Month="3" Day="1" IsLunarDate="False" IsROCDate="False">3 -1- 0 = 2 即体系组元数为2而体系的自由度数f = C -φ + n = 2 – 2 + 2 = 2(2) K=3, R = 1, b = 1, φ=2∴该体系平衡时的组元数C = K-R-b =3 – 1 – 1 = 1而体系的自由度数 f = C -φ + n = 1- 2 + 2 = 13.求下列体系的组元数和自由度数:(1) 由Fe(s)、FeO(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(2) 由Fe(s)、FeO(s)、Fe3O4(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(3) Na2SO4水溶液,其中有Na2SO4(s)、H2O、H + 和OH -;(4) 已知Na2SO4水溶液中有+、、(l)、(s)、H + 和OH -。

相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“”,错的画“”。
1.相是指系统处于平衡时,系统中物理性质与化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)与H2 S(g)达平衡时有:( )。
(A)C=2,=2,f =2; (B) C=1,=2,f =1;(C) C=1,=3,f =2;(D) C=1,=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液与冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种; (B) 2种; (C) 1种; (D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡: NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H 2O(g)+C(s) H2(g) + CO(g)CO 2(g)+H2(g) H2O + CO(g)CO 2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1; (D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。


第一章绪论1、仔细观察一下白炽灯泡,会发现有多少种不同的材料每种材料需要何种热学、电学性质2、为什么金属具有良好的导电性和导热性3、为什么陶瓷、聚合物通常是绝缘体4、铝原子的质量是多少若铝的密度为2.7g/cm3,计算1mm3中有多少原子5、为了防止碰撞造成纽折,汽车的挡板可有装甲制造,但实际应用中为何不如此设计说出至少三种理由。
6、描述不同材料常用的加工方法。
7、叙述金属材料的类型及其分类依据。
8、试将下列材料按金属、陶瓷、聚合物或复合材料进行分类:黄铜钢筋混凝土橡胶氯化钠铅-锡焊料沥青环氧树脂镁合金碳化硅混凝土石墨玻璃钢9、 Al2O3陶瓷既牢固又坚硬且耐磨,为什么不用Al2O3制造铁锤第二章晶体结构1、解释下列概念晶系、晶胞、晶胞参数、空间点阵、米勒指数(晶面指数)、离子晶体的晶格能、原子半径与离子半径、配位数、离子极化、同质多晶与类质同晶、正尖晶石与反正尖晶石、反萤石结构、铁电效应、压电效应.2、(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求出该晶面的米勒指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的米勒指数。
3、在立方晶系的晶胞中画出下列米勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213), [110],[111],[120],[321]4、写出面心立方格子的单位平行六面体上所有结点的坐标。
5、已知Mg2+半径为,O2-半径为,计算MgO晶体结构的堆积系数与密度。
6、计算体心立方、面心立方、密排六方晶胞中的原子数、配位数、堆积系数。
7、从理论计算公式计算NaC1与MgO的晶格能。
MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。
8、根据最密堆积原理,空间利用率越高,结构越稳定,金钢石结构的空间利用率很低(只有%),为什么它也很稳定9、证明等径圆球面心立方最密堆积的空隙率为25.9%;10、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。
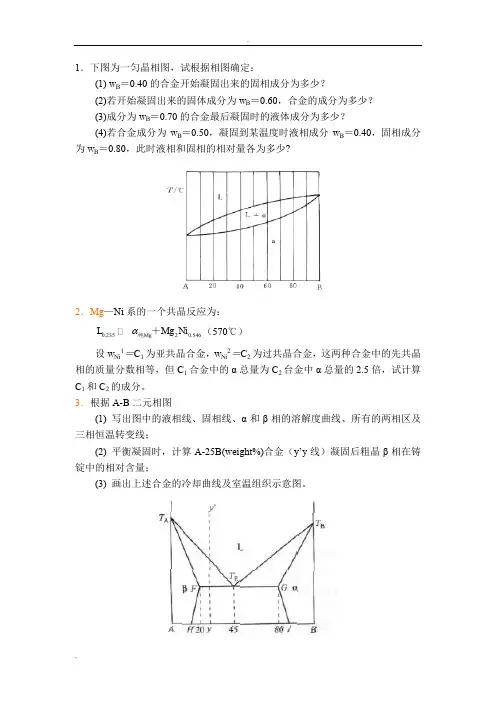
1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。
3.根据A-B 二元相图(1) 写出图中的液相线、固相线、α和β相的溶解度曲线、所有的两相区及三相恒温转变线;(2) 平衡凝固时,计算A-25B(weight%)合金(y ’y 线)凝固后粗晶β相在铸锭中的相对含量;(3) 画出上述合金的冷却曲线及室温组织示意图。
4.根据如图所示的二元共晶相图(1)分析合金I,II的结晶过程,并画出冷却曲线;(2)说明室温下合金I,II的相和组织是什么,并计算出相和组织组成物的相对含量?(3)如果希望得到共晶组织加上5%的 初的合金,求该合金的成分。
(4)合金I,II在快冷不平衡状态下结晶,组织有何不同?5.指出下列相图中的错误:6.试述二组元固溶体相的吉布斯(Gibbs)自由能-成分曲线的特点?(a) (b)(c) (d)1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分约为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分约为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?第1题答案2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。

第六章答案6-1略。
6-2什么是吉布斯相律?它有什么实际意义?解:相律是吉布斯根据热力学原理得出的相平衡基本定律,又称吉布斯相律,用于描述达到相平衡时系统中自由度数与组分数和相数之间的关系。
一般形式的数学表达式为F=C-P+2。
其中F为自由度数,C为组分数,P为相数,2代表温度和压力两个变量。
应用相率可以很方便地确定平衡体系的自由度数。
6-3固体硫有两种晶型,即单斜硫、斜方硫,因此,硫系统可能有四个相,如果某人实验得到这四个相平衡共存,试判断这个实验有无问题?解:有问题,根据相律,F=C-P+2=1-P+2=3-P,系统平衡时,F=0,则P=3,硫系统只能是三相平衡系统。
图6-1 图6-26-4如图6-1是钙长石(CaAl2Si2O)的单元系统相图,请根据相图回解:(1)六方、正交和三斜钙长石的熔点各是多少?(2)三斜和六方晶型的转变是可逆的还是不可逆的?你是如何判断出来的?(3)正交晶型是热力学稳定态?还是介稳态?解:(1)六方钙长石熔点约1300℃(B点),正钙长石熔点约1180℃(C点),三斜钙长石的熔点约为1750℃(A点)。
(2)三斜与六方晶型的转变是可逆的。
因为六方晶型加热到转变温度会转变成三斜晶型,而高温稳定的三斜晶型冷却到转变温度又会转变成六方晶型。
(3)正交晶型是介稳态。
6-5图6-2是具有多晶转变的某物质的相图,其中DEF线是熔体的蒸发曲线。
KE是晶型I 的升华曲线;GF是晶型II的升华曲线;JG是晶型III的升华曲线,回答下列问题:(1)在图中标明各相的相区,并写出图中各无变量点的相平衡关系;(2)系统中哪种晶型为稳定相?哪种晶型为介稳相?(3)各晶型之间的转变是可逆转变还是不可逆转变?解:(1)KEC为晶型Ⅰ的相区,EFBC过冷液体的介稳区,AGFB晶型Ⅱ的介稳区,JGA晶型Ⅲ的介稳区,CED是液相区,KED是气相区;(2)晶型Ⅰ为稳定相,晶型Ⅱ、Ⅲ为介稳相;因为晶型Ⅱ、Ⅲ的蒸汽压高于晶型Ⅰ的,即它们的自由能较高,有自发转变为自由能较低的晶型Ⅰ的趋势;(3)晶型Ⅰ转变为晶型Ⅱ、Ⅲ是单向的,不可逆的,多晶转变点的温度高于两种晶型的熔点;晶型Ⅱ、Ⅲ之间的转变是可逆的,双向的,多晶转变点温度低于Ⅱ、Ⅲ的熔点。
第五章 多相平衡一、填空题1、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于__________。
2、纯物质在一定温度下两相共存时的自由度数等于__________。
3、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的自由度数为______。
4、含KNO 3和NaCl 的水溶液与纯水达到渗透平衡时,其组分数为____,相数为___, 自由度数为____。
5、在氢和石墨的系统中,加一催化剂,H 2和石墨反应生成n 种碳氢化合物,此系统的独立 组分数为______。
6、含有CaCO 3(S )、CaO (S )、CO 2(g )的混合物与CO 2(g )和N 2(g )的混合物达渗透平衡时,该混合体系的物种数S=____, 独立组分数C 为____,相数φ为____,自由度f=____。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸气压有最高值,那么组成为x B =0.4的溶液在 气液平衡时,x B (g )、x B (l )、x B (总)的大小顺序为______。
将x B =0.4的溶液进行 精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独立组分数为___,自由度为___。
10、将AlCl 3溶于水中,全部水解,生成Al(OH)3沉淀,此系统自由度数f=____。
11、已知100o C 时水的饱和蒸气压为101.325KPa,用公式_________可求出25oC 时 水的饱和蒸气压。
二、单选题1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。
第四章 相图 练习题1.在Al-Mg 合金中,x Mg =0.05,计算该合金中Mg 的质量分数(w Mg )(已知Mg 的相对原子质量为24.31,Al 为26.98)。
2.已知Al-Cu 相图中,K =0.16,m =3.2。
若铸件的凝固速率R =3×10-4 cm/s ,温度梯度G =30℃/cm ,扩散系数D =3×10-5cm 2/s ,求能保持平面状界面生长的合金中W Cu 的极值。
3.证明固溶体合金凝固时,因成分过冷而产生的最大过冷度为:⎥⎦⎤⎢⎣⎡-+--=∆GK R K mw R GD K K mw T Cu C Cu C )1(ln 1)1(00max最大过冷度离液—固界面的距离为:⎥⎦⎤⎢⎣⎡-=GDK R K mw R D x Cu C )1(ln 0式中m —— 液相线斜率; w C0Cu —— 合金成分; K —— 平衡分配系数; G —— 温度梯度; D —— 扩散系数; R —— 凝固速率。
说明:液体中熔质分布曲线可表示为:⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛--+=x D R K K w C Cu C L exp 110 4.Mg-Ni 系的一个共晶反应为:546.02)Mg (570235.0Ni Mg ==+⇔w w L NiNi 纯℃α设w 1Ni =C 1为亚共晶合金,w 2Ni =C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2合金中α总量的2.5倍,试计算C 1和C 2的成分。
5.在图4—30所示相图中,请指出:(1)水平线上反应的性质;(2)各区域的组织组成物;(3)分析合金I,II的冷却过程;(4)合金工,II室温时组织组成物的相对量表达式。
6.根据下列条件画出一个二元系相图,A和B的熔点分别是1000℃和700℃,含wB=0.25的合金正好在500℃完全凝固,它的平衡组织由73.3%的先共晶。
和26.7%的(α+β)共晶组成。
相平衡及相图练习1.下列说法对吗?为什么?(1)在一给定的体系中,独立组分数是一个确定的数。
(2)单组分体系的物种数一定等于1。
(3)相律适用于任何相平衡体系。
(4)在相平衡体系中,如果每一相中的物种数不相等,则相律不成立。
提示2.请论证(1)在一定温度下,某浓度的 NaCl 水溶液只有一个确定的蒸气压;(2)在一定温度下,草酸钙分解为碳酸钙和一氧化碳时只能有一个确定的 CO 压力。
提示3.试求下述体系的自由度并指出变量是什么?(1)在压力下,液体水与水蒸气达平衡;(2)液体水与水蒸气达平衡;(3)25℃ 和压力下,固体 NaCl 与其水溶液成平衡;(4)固态 NH4HS 与任意比例的 H2S 及 NH3的气体混合物达化学平衡;(5)I2(s)与 I2(g)成平衡。
提示4.Na2CO3与水可形成三种水合物 Na2CO3·H2O(s),Na2CO3·7H2O(s)和 Na2CO3·10H2O(s)。
问这些水合物能否与 Na2CO3水溶液及冰同时平衡共存?提示5.根据碳的相图,回答下列问题:(1)点 O 及曲线 OA,OB 和 OC 具有什么含义?(2)试讨论在常温常压下石墨与金刚石的稳定性;(3)2000K 时,将石墨变为金刚石需要多大压力?(4)在任意给定的温度和压力下,金刚石与石墨哪个具有较高的密度?提示6.在 1949~2054K 之间,金属 Zr 的蒸气压方程为请得出 Zr 的摩尔升华焓与温度T的关系式。
并估算 Zr 在溶点 2128K 时的摩尔升华焓和蒸气压。
提示7.某物质的固体及液体的蒸气压可分别用下式表示:(固体) (1)(液体) (2)试求其:(1)摩尔升华焓(2)正常沸点(3)三相点的温度和压力(4)三相点的摩尔熔化熵提示8.在海拔 4500m 的西藏高原上,大气压力只有 57.329kPa,水的沸点为84℃,求水的气化热。
提示9.一冰溪的厚度为 400m,其比重为 0.9168,试计算此冰溪底部冰的熔点。