第二章 相图练习题
- 格式:doc
- 大小:1.95 MB
- 文档页数:8


第二章多相多组分系统热力学2007-4-24§2.1 均相多组分系统热力学 练习1 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若 V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系;答: b2: 1kg 溶剂中含溶质的物质的量, b 2=n 2, 112222,,,,2T P n T P n V V V B cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ ∵ V=n 1V 1+n 2V 2( 偏摩尔量的集合公式)∴ V 1=(1/n 1)(V-n 2V 2)= (1/n 1)( V-b 2V 2)= (1/n 1)(A+Bb 2+c(b 2)2-Bb 2-2cb 2)= (1/n 1)[A-c(b 2)2] (2)说明A ,B , A/n 1 的物理意义;由V = A +B b 2+C (b 2)2 , V=A;A: b 2→0, 纯溶剂的体积,即1kg 溶剂的体积B; V 2=B+2cb 2, b 2→0, 无限稀释溶液中溶质的偏摩尔体积A/n 1:V 1= (1/n 1)[A-c(b 2)2],∵b 2→0,V = A +B b 2+C (b 2)2, 纯溶剂的体积为A, ∴A/n 1 为溶剂的摩尔体积。
(3)溶液浓度增大时V 1和V 2将如何变化?由V 1,V 2 的表达式可知, b 2 增大,V 2 也增加,V 1降低。
2哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量? 答: 偏摩尔量定义为,,c B B T P n Z Z n ⎛⎫∂= ⎪∂⎝⎭所以,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭ ,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭ ,,cBB T P n F F n ⎛⎫∂= ⎪∂⎝⎭ ,,cB B T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 化学势定义为:,,c B B T P n G n μ⎛⎫∂=⎪∂⎝⎭= ,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,c B S V n U n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭ 可见,偏摩尔Gibbs 自由能既是偏摩尔量又是化学势。


相图章节选择题:1、下列体系属于单相的是:(a)极细的斜方硫和单斜硫混合物(b)漂白粉(c)大小不一的一堆尿素碎粒(d)墨汁2、CaCO3(s)分解产生 CaO(s)和 CO2(g), 尽管产物之间存在有定量关系, 但在求算自由度时, 这种定量关系不能作为浓度限制条件:(a)因为 CaO(s) 用x表示其浓度, 而CO2(g)用p 表示(b)因为是化学反应(c)因为两者处于不同相(d)因为 CO2的平衡压力等于大气压3、关于三相点,下面的说法中正确的是:(a)单组分体系与多组分体系中均有三相点(b)三相点就是二条两相平衡线的交点(c)三相点的温度可随压力而改变(d)三相点是纯物质的三相平衡共存时温度和压力所决定的相点4、下列说法中正确的是:(a)对于完全互溶的双液混合物可以可用分馏方法将二者分开(b)对于部分互溶的双液混合物可用分馏方法将二者分开(c)对于完全互溶的有恒沸点的双液混合物,不能用简单的分馏方法同时得到两种纯液体(d)水蒸气蒸馏通常用于分离或提纯沸点比较高,相对分子质量比较大的能溶于水的有机化合物5、以下说法中正确的是:(a)相图中的点都是代表系统状态的点(b)在恒定的压力下,根据相律得出某一系统的F=l,则该系统的温度就有一个唯一确定的值(c)单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述(d)自由度就是可以独立变化的变量6、对于 KCl~H2O体系, 平衡共存的相数:(a)只能是1相(b)只能是4相(c)只能是1相或4相(d)可能是1、2、3、4相7、单组分固~(a)V m(l)=V m(s) (b)V m(l)>V m(s)(c)V m(l)<V m(s) (d)无法确定8、A~B 溶液系统T~x图如图所示,下列叙述中不正确的是:(a)adchb 为气相线,aecgb 为液相线;(b)B 的含量x(e,l)>y(d,g),y(h,g)>x(g,l);(c)B 的含量y(e,g)>x(d,l),y(h,g)>x(g,l);(d)B 的含量y(c,g)=x(c,l)相图计算题:1、Pb熔点600K,Sn熔点505K,它们组成二元体系在373K时含Sn30%(以下均以质量百分率表示)体系中发现含两种固体成分,分别为含Sn5%和99.0%,在423K时含有两种固体成分分别为Sn11.3%和98.3%。

相平衡及相图练习1.下列说法对吗?为什么?(1)在一给定的体系中,独立组分数是一个确定的数。
(2)单组分体系的物种数一定等于1。
(3)相律适用于任何相平衡体系。
(4)在相平衡体系中,如果每一相中的物种数不相等,则相律不成立。
提示2.请论证(1)在一定温度下,某浓度的 NaCl 水溶液只有一个确定的蒸气压;(2)在一定温度下,草酸钙分解为碳酸钙和一氧化碳时只能有一个确定的 CO 压力。
提示3.试求下述体系的自由度并指出变量是什么?(1)在压力下,液体水与水蒸气达平衡;(2)液体水与水蒸气达平衡;(3)25℃ 和压力下,固体 NaCl 与其水溶液成平衡;(4)固态 NH4HS 与任意比例的 H2S 及 NH3的气体混合物达化学平衡;(5)I2(s)与 I2(g)成平衡。
提示4.Na2CO3与水可形成三种水合物 Na2CO3·H2O(s),Na2CO3·7H2O(s)和 Na2CO3·10H2O(s)。
问这些水合物能否与 Na2CO3水溶液及冰同时平衡共存?提示5.根据碳的相图,回答下列问题:(1)点 O 及曲线 OA,OB 和 OC 具有什么含义?(2)试讨论在常温常压下石墨与金刚石的稳定性;(3)2000K 时,将石墨变为金刚石需要多大压力?(4)在任意给定的温度和压力下,金刚石与石墨哪个具有较高的密度?提示6.在 1949~2054K 之间,金属 Zr 的蒸气压方程为请得出 Zr 的摩尔升华焓与温度T的关系式。
并估算 Zr 在溶点 2128K 时的摩尔升华焓和蒸气压。
提示7.某物质的固体及液体的蒸气压可分别用下式表示:(固体) (1)(液体) (2)试求其:(1)摩尔升华焓(2)正常沸点(3)三相点的温度和压力(4)三相点的摩尔熔化熵提示8.在海拔 4500m 的西藏高原上,大气压力只有 57.329kPa,水的沸点为84℃,求水的气化热。
提示9.一冰溪的厚度为 400m,其比重为 0.9168,试计算此冰溪底部冰的熔点。


相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“”,错的画“”。
1.相是指系统处于平衡时,系统中物理性质与化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)与H2 S(g)达平衡时有:( )。
(A)C=2,=2,f =2; (B) C=1,=2,f =1;(C) C=1,=3,f =2;(D) C=1,=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液与冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种; (B) 2种; (C) 1种; (D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡: NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H 2O(g)+C(s) H2(g) + CO(g)CO 2(g)+H2(g) H2O + CO(g)CO 2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1; (D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。

名词解释1.匀晶转变:2.包晶转变:3.平衡凝固:4.伪共晶:5.非平衡共晶:6.共晶转变:7.偏晶转变:8.共析反应:9.包析转变:10.熔晶转变11.合晶转变:12.一次相或初生相;13.二次相或次生相14.扩散退火:15.离异共晶:16.钢17.铸铁18.奥氏体:19.莱氏体:20.珠光体:21.三次渗碳体22.调幅分解23.成分过冷24.枝晶偏析25.正偏析26.宏观偏析概念辨析题1、共晶转变与共析转变2、奥氏体与铁素体的异同点:3、二次渗碳体与共析渗碳体的异同点。
4、稳定化合物与不稳定化合物5、均匀形核与非均匀形核6、平衡凝固与非平衡凝固7、光滑界面与粗糙界面8、钢与铸铁9、热过冷与成分过冷10、一次相与二次相11、伪共晶与离异共晶12、正偏析与反偏析相图题一、相图题(20分)1.画出Fe-Fe 3C 相图,填出各区的组织组成物。
(6分)2.分析含碳O.65%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(6分)C e F -e F 3相图为二、相图题(22分)1_画出 相图,填出各区域的组织组成物。
(6分) 2.分析含碳0.4%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示 意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)C e F -e F 3三、相图题(25分)1.画出相图,标出重要点的温度与含碳量,填出各区域的组织组成物。
(7分) 2.分析含碳3.5%的铁碳合金的平衡凝固过程,画出其冷却曲线和室温时的显微组织示意图。
(10分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)四、相图题1、Fe —Fe 3C 相图,结晶过程分析及计算1)分析含碳0.53~0.77%的铁碳合金的结晶过程,并画出结晶示意图。
2) 计算室温下亚共析钢(含碳量为x )的组织组成物的相对量。

相图分析练习题相图分析是研究物质相变和相稳定性的重要手段。
通过练习相图分析题目,我们能够更好地理解和应用相图,为材料科学和化工领域的研究提供指导。
下面是一些相图分析练习题,帮助我们巩固和拓展对相图分析的理解。
1. 假设有一个组成为A-B二元体系的相图,相图中共有3个相区,分别是α、β和γ相区。
请你利用相图分析的方法回答以下问题:a) α相区在相图中的位置是在α相区压力和温度变化的标准条件范围内吗?b) β相区的温度范围是多少?给出其在相图中的位置。
c) γ相区是单相区还是双相区?为什么?2. 给定一个相图,包含两个组成分为X和Y的物质,相图中存在两个液相区,一个液相1和一个液相2。
请回答以下问题:a) 在相图中液相1和液相2之间的平衡线上,组成X和Y的摩尔分数如何变化?b) 假设相图中还存在一个固相区域,请你推测固相区域的组成和相稳定性。
3. 对于一个具有二元组成的相图,已知有五个相区,分别是α、β、γ、δ和ε相区。
请根据以下信息回答问题:a) α相区的温度范围是多少?该相区的组成是什么?b) γ相区与β相区之间的相变类型是什么?在相变过程中组成如何变化?c) δ相区是单相区还是双相区?是否有可能发生共晶反应?4. 某个二元体系的相图如下图所示,请回答以下问题:a) 相图中共有几个相区?b) 在相图中的固相区域中,是否会发生过共晶反应?c) 在相图中,固相α的摩尔分数随温度的升高而如何变化?通过这些相图分析题目的练习,我们可以加深对相图分析的理解并提高解决实际问题的能力。
相图分析在材料和化工领域的研究和应用中起着至关重要的作用,帮助我们设计新材料、改进工艺和优化产品性能。
希望这些练习题对你的学习和实践有所帮助!。

第二章 相图一、名词解释:三元系相图中的液相面,三元系相图中的等温线,相图中的无变量点,三元系相图中的初晶面二、其它1、相律是指______________________。
冶金炉渣三元系的相律表达式为______________________。
2、表示三元系的组成用浓度三角形,浓度三角形内的等含量规则是指_____________________________。
3、三元系的组成用浓度三角形来表示,浓度三角形中的等比规则是指______________________________。
在冶金渣三元系中,若自由度为零,则一定是_____相共存。
4.三元系相图中的等温线表示______________________________,相图中等温线之间相距越近的区域,则说明该区间炉渣组成的改变对_______影响大。
5.三元相图中三元共晶点有________相平衡共存,自由度为___ 。
6.在冶金三元系渣相图中,自由度为零时,相数为_____;四相平衡的三元共晶点处的自由度为_____,其析晶反应可以表示为_________。
7.通常对冶金炉渣,相律的表达式为_________,由此推导出三元冶金炉渣系中最多可能存在的相数为_________,此时的自由度为___。
8、如图,回答下列问题:(1)写出P 点的结晶反应式。
(2)指出自由度为零的点。
(3)写出E e 3线上发生的结晶反应式。
8、如图1所示,回答下列问题:(1)指出化合物D 的稳定性。
(2)相图中三角形ADB 区(即分三角形ADB )可以似为哪一类基本相图?(3)写出1E 点、23e E 线、51e E 线的析晶反应式,并指出其中自由度为零的点或线9.如下所示的相图。
回答下列问题:(1)物系点a,从液体降温过程中首先析出的物质是什么?(2)写出P点的相平衡关系。
(3)P点和E点比较,哪一点的熔点低?(4)绘出b点的步冷曲线。
10.对冶金熔体三元系相图,回答下列问题。
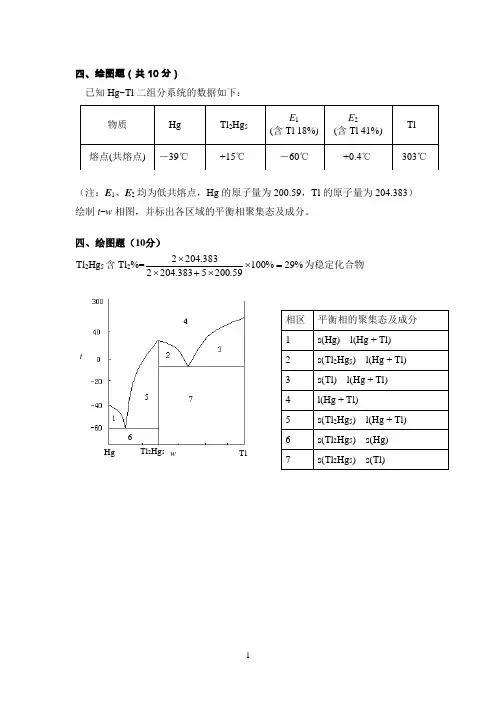
四、绘图题(共10分)已知Hg~Tl 二组分系统的数据如下:(注:E 1、E 2均为低共熔点,Hg 的原子量为200.59,Tl 的原子量为204.383) 绘制t ~w 相图,并标出各区域的平衡相聚集态及成分。
四、绘图题(10分) Tl 2Hg 5含Tl 2%=%29%10059.2005383.2042383.2042=⨯⨯+⨯⨯为稳定化合物HgTlwt576 Tl 2Hg 5五、读图作图题(15分)图(a )是A 、B 系统的熔点-组成图:(1) 填表:(8分)(2)在图(b )中画出系统由点k 降温的步冷曲线。
(3分) (3)填空:(4分)已知C 组成为w B = 0.2,相点D (T =500K, w B =0.6)和相点E (T =400K, w B =0.8), 则10 kg 组成为w B =0.1的熔融液降温时能析出的纯 晶体不大于 kg ;而欲析出纯晶体C, 熔融液的组成w B 范围应在 之间。
{ T }时间图(a )N{ T } A B0.0 0.2 0.4 0.6 0.8 1.0w B C图(b )五、(15分)解:(1)填表:(8分)(2)在图(b )上画出由系统由点k 降温的步冷曲线。
(3分)(3)填空(4分): A ; 8.3(占2分) ; 0.6~0.8。
{ T时间图(a )N{ T } A B0.0 0.2 0.4 0.6 0.8 1.0w B C 图(b )五:(12分)工业生产中有时需要结晶与精馏联合运用方可得到纯净物质,已知A和B 二组分形成的液态互溶、固态完全不互溶的气、液、固相图如下:(1)标出1、2、3、4、5相区内的稳定相;(2)图中①、②、③、④、⑤五条线的名称各是什么?(3)画出系统点a的冷却曲线,并描述过程中的相变化。
(4)现工业中由化学反应只能得到状态为b的混合物。
据相图,要得到纯B和纯A应如何操作?五、(12 分)(1) 1. g;2. l+g;3. l;4. B(s)+l;5. A(s)+B(s)(2) ①气相线,或露点线;②液相线,或泡点线;③溶剂A的凝固点降低曲线;④溶剂B的凝固点降低曲线⑤低共熔线,或三相线。
1、已知A 与B 能形成化合物A 3B,A 与B 不形成固溶体,C 点x A =0.5,D 点x A =0.6。
(1)试完成下列A-B 固液相图; (2)标明各相平衡区域的相态;(3)画出从M 点冷却的步冷曲线。
解:2、等压下,Tl ,Hg 及其仅有的一个化合物(Tl 2Hg 5)的熔点分别为303℃,-39℃,15℃。
另外还已知组成为含8%(质量分数)Tl 的溶液和含41%Tl 的溶液的步冷曲线如下图。
Hg ,Tl 的固相互不相溶。
(1)画出上面体系的相图。
(Tl ,Hg 的相对原子质量分别为204.4,200.6)(2)若体系总量为500g ,总组成为10%Tl ,温度为20℃,使之降温至-70℃时,求达到平衡后各相的量。
ABx AC D800K- 600K- 500K- 400K--1000KM ·解:(1)Tl 2Hg 5的组成204.42(Tl)28.93%204.42200.65w ⨯==⨯+⨯,相图绘制如下。
(2)设-70℃时,Hg(s)的质量为x ,则固体化合物的质量为(500g-x ),根据杠杆规则:x (0.1-0)=(500g-x )(0.2893-0.1)x =327.3g3、假设组分A 和B 能够形成一个不稳定化合物A 2B ,A 的熔点比B 的低,试画出该体系在等压下可能的温度—组成示意图,并标出各相区的相态。
解:A 和B 二组分体系的等压相图如下所示:还有一个可能的相图,A 与B 换位置。
4、Au 和Sb 熔点分别为1333K 和903K ,两者形成一种不稳定化合物AuSb 2在1073K 时分解,600K 时该化合物与Sb 形成低共熔混合物。
(1)试画出符合上述数据的示意相图,并填下表;(2)画出Au 的质量分数为0.5的熔融物的步冷曲线。
5、利用下列数据,粗略地描绘出Mg -Cu 二组分凝聚系统相图,并标出各区的稳定相。
Mg 与Cu 的熔点分别为648℃,1085℃。
1、金属A、B熔融液冷却曲线的转折温度和平台温度如下表所列,请据此画出2、金属A、B形成化合物AB3、A2B3。
固体A、B、AB3、A2B3彼此不互溶,但在液态下能完全互溶。
A、B的正常熔点分别为600℃、1100℃。
化合物A2B3的熔点为900℃,与A形成的低共熔点为450℃。
化合物AB3在800℃下分解为A2B3和溶液,与B 形成的低共熔点为650℃。
根据上述数据(1)画出A-B系统的熔点-组成图,并标示出图中各区的相态及成分;(2)画出x A=0.90、x A=0.10熔化液的步冷曲线,注明步冷曲线转折点处系统相态及成分的变化和步冷曲线各段的相态及成分。
3、已知101.325kPa,固体A和B的熔点分别为500℃和1000℃,它们可生成固体化合物AB(s)。
AB(s)加热至400℃时分解为AB2(s)和x B=0.40的液态混合物。
AB2(s)在600℃分解为B(s)和x B=0.55的液态混合物。
该系统有一最低共熔点,温度为300℃,对应的组成x B=0.10。
(1)根据以上数据,画出该系统的熔点-组成图,并标出图中各相区的相态与成分;(2)将x A=0.20的液态A,B混合物120mol,冷却接近到600℃,问最多可获得纯B多少摩尔?4、金属A、B及其化合物A2B3的熔化温度分别为1200℃,1600℃和1700℃;在1400℃时,含B10%的熔融液与含B20%、30%的两固熔体三相平衡;在1250℃时,含B75%的熔融液与含B65%、90%的两固熔体三相平衡。
根据以上事实粗略画出A-B系统的相图,5、根据下述事实粗略画FeO-SiO2系统的相图。
FeO和SiO2的熔点分别为1541℃和1713℃;(FeO)2·SiO2的熔点为1065℃,FeO·SiO2的熔点为1500℃,;最低共熔点的坐标为:t =1040℃, x(SiO2) = 0.31;t =1010℃, x(SiO2)=0.37;t=1445℃, x(SiO2)=0.6。
相图习题例1 已知NaHCO3(s)热分解反应为 2NaHCO3==Na2CO3(s)+CO2(g)+ H2O(g)今将NaHCO3(s),Na2CO3(s),CO2和H2O(g)按任意比例混合,放入一个密闭容器中,试计算当反应建立平衡时系统的C,φ 及f。
[题解]:R’=0,R=1,S=4 C = S – R – R’ = 4 – 1 –0 = 3 φ = 3f = C–φ +2 = 3 – 3 + 2 = 2[导引]:因NaHCO3(s),Na2CO3(s),CO2和H2O(g)按任意比例混合,不存在浓度限制条件,所以R’=0。
例2 请应用相律论证下列结论的正确性: (1)纯物质在一定压力下的熔点为定值; (2)纯液体在一定温度下有一定的蒸气压。
[题解]:(1)C=1 ,φ =2 ,因压力一定, f =C-φ +1=1-2+1=0 故熔点为定值; (2)C=1,φ =2,因T一定, f =C-φ +1=1-2+1=0 故蒸气压为定值。
[导引]:准确理解自由度数的含义。
例3 在高温下,CaCO3(s)分解为CaO(s)和CO2(g)。
(1) 在一定压力的CO2气中加热CaCO3(s),实验表明加热过程中,在一定温度范围内CaCO3不会分解。
(2) 若??/span>CO2气的压力恒定,实验表明只有一个温度使CaCO3(s)和CaO(s)的混合物不发生变化。
请根据相律说明上述实验事实。
[题解]:系统的物种数S=3,有一个化学反应平衡式CaCO3(s) = CaO(s)+CO2(g)R = 1,R′ = 0,C = S-R-R′ = 3-1 = 2 p一定下,f ′= C-f +1 = 3-f (1)在一定压力的CO2气中加热CaCO3(s),系统存在两相,由相律知f ′=1,这表明温度可在一定范围内变化而不会产生新相,即CaCO3(s)不会分解。
(2)此系统存在三相,据相律f ′=0,故温度为定值。
名词解释1.匀晶转变:2.包晶转变:3.平衡凝固:4.伪共晶:5.非平衡共晶:6.共晶转变:7.偏晶转变:8.共析反应:9.包析转变:10.熔晶转变11.合晶转变:12.一次相或初生相;13.二次相或次生相14.扩散退火:15.离异共晶:16.钢17.铸铁18.奥氏体:19.莱氏体:20.珠光体:21.三次渗碳体22.调幅分解23.成分过冷24.枝晶偏析25.正偏析26.宏观偏析概念辨析题1、共晶转变与共析转变2、奥氏体与铁素体的异同点:3、二次渗碳体与共析渗碳体的异同点。
4、稳定化合物与不稳定化合物5、均匀形核与非均匀形核6、平衡凝固与非平衡凝固7、光滑界面与粗糙界面8、钢与铸铁9、热过冷与成分过冷10、一次相与二次相11、伪共晶与离异共晶12、正偏析与反偏析相图题一、相图题(20分)1.画出Fe-Fe 3C 相图,填出各区的组织组成物。
(6分)2.分析含碳O.65%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(6分)C e F -e F 3相图为二、相图题(22分)1_画出 相图,填出各区域的组织组成物。
(6分) 2.分析含碳0.4%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示 意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)C e F -e F 3三、相图题(25分)1.画出相图,标出重要点的温度与含碳量,填出各区域的组织组成物。
(7分) 2.分析含碳3.5%的铁碳合金的平衡凝固过程,画出其冷却曲线和室温时的显微组织示意图。
(10分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)四、相图题1、Fe—Fe3C相图,结晶过程分析及计算1)分析含碳0.53~0.77%的铁碳合金的结晶过程,并画出结晶示意图。
2)计算室温下亚共析钢(含碳量为x)的组织组成物的相对量。
第二章 相图
一、名词解释:
三元系相图中的液相面,三元系相图中的等温线,相图中的无变量点,三元系相图中的初晶面
二、其它
1、相律是指______________________。
冶金炉渣三元系的相律表达式为______________________。
2、表示三元系的组成用浓度三角形,浓度三角形内的等含量规则是指_____________________________。
3、三元系的组成用浓度三角形来表示,浓度三角形中的等比规则是指______________________________。
在冶金渣三元系中,若自由度为零,则一定是_____相共存。
4.三元系相图中的等温线表示______________________________,相图中等温线之间相距越近的区域,则说明该区间炉渣组成的改变对_______影响大。
5.三元相图中三元共晶点有________相平衡共存,自由度为___ 。
6.在冶金三元系渣相图中,自由度为零时,相数为_____;四相平衡的三元共晶点处的自由度为_____,其析晶反应可以表示为_________。
7.通常对冶金炉渣,相律的表达式为_________,由此推导出三元冶金炉渣系中最多可能存在的相数为_________,此时的自由度为___。
8、如图,回答下列问题:
(1)写出P 点的结晶反应式。
(2)指出自由度为零的点。
(3)写出E e 3线上发生的结晶反应式。
8、如图1所示,回答下列问题:
(1)指出化合物D 的稳定性。
(2)相图中三角形ADB 区(即分三角形ADB )可以似为哪一类基本相图?
(3)写出1E 点、23e E 线、51e E 线的析晶反应式,并指出其中自由度为零的点或线
9.如下所示的相图。
回答下列问题:
(1)物系点a,从液体降温过程中首先析出的物质是什么?
(2)写出P点的相平衡关系。
(3)P点和E点比较,哪一点的熔点低?
(4)绘出b点的步冷曲线。
10.对冶金熔体三元系相图,回答下列问题。
(1)最多能有多少相共存?
(2)浓度三角形内的等温线是如何绘制的?
(3)已知组成的物系点,就可由相图查找得到其液体冷却过程中的初晶物质吗?
11.如图1所示的三元系相图中的物系点a,试确定其熔点。
依据分三角形的划分规则,该物系点位于三角形CS-C3S2—C2AS内,试确定该渣系点凝固后
的相成分。
12.三元系相图中的等温线是如何绘制的?举例说明其应用。
13.如图1所示,回答下列问题:
e点中哪一点的温度最低?
(1)指出图中B、D、
3
(2)指出图中自由度为零的点?并写出析晶反应式
14、(10分)图2是具有一个不稳定二元化合物的三元系相图,分析其中m点
在温度降低过程中液相及固相的变化。
并绘制步冷曲线图。
15、如图2示,回答下列问题:(1)物系点m 和n 的初晶物是什么?(2)指出图中自由度为零的点?
16.如图1所示。
(1)物系点1O 、2O 、3O 点的结晶终点是什么?
装 订 线
(2)1O 、2O 凝固终了时,析出的固相物分别是什么?
(3)写出P 和E 点的析晶反应。
17、如图1所示A-B-C 三元系相图。
(1)写出E 点处和PE 线上的结晶反应。
(2)指出物系点b 的初晶物质。
(3)指出物系点b 的结晶终点。
18、依据图1,回答下列问题:
(1)物系点m 的组成?
(2)m 的熔点?
(3)将组成为m 点的液态渣冷却,其初晶物是什么?
19、如图1示。
回答下列问题:
(1)指出化合物D 的稳定性。
(2)写出/1e 、E 1点的析晶反应。
(3)写出11E e 线上的析晶反应。
(4)指出物系点a 的初始结晶物质和结晶终点。