铅铋混合液的测定实验报告
- 格式:docx
- 大小:3.35 KB
- 文档页数:2

铅铋含量的连续测定(4学时)一、目的要求:1. 掌握基准ZnO 标定EDTA 标准溶液的原理及方法;2. 了解控制酸度提高EDTA 选择性实现分别滴定的原理及方法;3. 掌握络合滴定金属离子指示剂的选择;二、实验原理:标定: pH5-6 Zn 2+ + H 2Y 2- = ZnY 2- + 2H + lgK ZnY =16.50 测定: pH ≈1 Bi 3+ + H 2Y 2- = BiY - + 2H + lgK BiY =27.94 pH5-6 Pb 2+ + H 2Y 2- = Pb Y 2-+ 2H + lgK Zn Y =18.04 二甲酚橙指示 XO-M(紫红色) + Y = MY + XO(亮黄色)H 3In 4-(黄) pKa= 6.3 H 2In 5-(红)(pH ≈1时,㏒αY(H) =18.01, pH5-6时,㏒αY(H) =4.6~6.5)三、实验内容:1. 0.01mol·L -1 EDTA 标准溶液的配制: 1.8g →400mL 。
2. EDTA 标准溶液的标定(基准ZnO 法)3. 试样测定实验关键: 1. 终点颜色经由过渡色突变控制 [紫红→过渡色(橙红)→亮黄],否则易过量,且过量颜色亦不变,无法判断;基准ZnO 0.20-0. 25g ① 少量水润湿 ② 滴加1+1HCl 至溶解完全 定容至 250.0mL 移取 25.00mL ① 二甲酚橙 2 滴② 滴加六次甲基四胺至红③ 加过量六次甲基四胺EDTA 滴定 终点(紫红→亮黄色) 移取试液 25.00mL EDTA 滴定Bi 3+终点(亮黄色) 二甲酚橙 2 滴pH ≈1 V 1 ①滴加六次甲基四胺至红 ② 加过量六次甲基四胺15mL EDTA 滴定Pb 2+V 2 终点(亮黄色)2.接近终点时需慢滴快摇;3.连续滴定,注意滴定管检漏。
四、结果处理:电脑输入:m ZnO, V标,V测Bi,V测Pb计算:C Bi(g/L),C Pb(g/L)[M ZnO =81.39g / mol,M Bi =209.0g / mol,M Pb =207.2g / mol]五、相关问题2.络合滴定常用金属离子指示剂:铬黑T(EBT)二甲酚橙(XO)3.使用pH范围:pH 6.3~11.6 pH<6.34.络合滴定准确滴定判别式:lgK′MY C M sp≥6,lgK′MY≥8;5.络合滴定分别滴定判别式:∆lgKC≥6,∆lgK≥6.6.EDTA标定(标定基准选择原则):选用与待测物组分相同或尽量接近的基准物进行标定,使标定与测定条件尽可能一致,减少误差,保证测定准确性。



实验五十五 铅铋混合液中铅、铋含量的连续测定一、 原理:利用控制酸度的方法连续测定lgK BiY – lgK PbY = 27.94 - 18.04 = 9.9 > 5用硝酸调节溶液pH=1 测定铋;再用六次甲基四胺调节溶液pH=5~6 测定铅二、 步骤(平行测定三次)三、计算注意:1、 用量筒加10ml 水是因为溶液太浓,加水过多会造成Bi 水解,产生白色沉淀,加酸才能溶解。
2、 六次甲基四氨放到量筒中取用。
3、 指示剂一定不要加多,否则颜色深,终点判断困难。
4、 近终点时要摇动锥形瓶,防滴过,边滴边摇。
5、 第一个终点不易读准。
由紫→橙红时先读下体积,然后半滴变为黄色(非亮黄色)为V 1。
V 1会影响V 2。
6、 吸耳球用后放回原处,滴定管洗净、倒扣、放回原处。
思考题答案(1) 不可以。
因为Bi 3+在溶液的PH=5-6时就已水解了。
(2) 用氧化锌做基准物标定EDTA 标准溶液。
因为当溶液的PH=5-6时,Zn 2+与EDTA形成稳定的络合物;在测定Pb 2+时,Pb 2+与EDTA 形成稳定的络合物溶液的PH=5-6。
滴定条件一致可以减小误差。
(3) PH 值过大,Bi 3+水解;PH 值过小,Bi 3+与EDTA 络合不完全。
(4) 二甲酚橙属于三苯甲烷显色剂,易溶于水,它有七级酸式离解,其中H 2ln 5-至ln 7-呈红色,H 7ln 至H 3ln 4-呈黄色。
由于各组分的比例随溶液的酸度变化,所以它们在溶液中的颜色也随酸度而变化。
在PH <6.3时呈黄色,PH ﹥6.3时呈红色。
二甲酚橙与Pb 2+、Bi 3+形成的络合物呈红色,它们的稳定性小于Pb 2+、Bi 3+和EDTA 所形成的络合物。
1.按本实验操作,滴定Bi 3+的起始酸度是否超过滴定Bi 3+的最高酸度?滴定至Bi 3+的终点时,溶液中酸度为多少?此时在加入10mL200g·L -1六亚四基四胺后,溶液pH 约为多少?()00.100.20911⨯⨯=⋅-V C L g Bi EDTA ()00.102.20721⨯⨯=⋅-V C L g Pb EDTA 21,5%201,211000.10V mL V pH mL mL 再至亮黄为终点色滴定至溶液由紫红变橙至紫红色再多加六次甲基四胺滴补加二甲酚橙再至亮黄为终点色滴定至溶液由紫红变橙滴二甲酚橙加水于锥形瓶中液用移液管吸取铅铋混合→→→→→≈→答:按本实验操作,滴定Bi3+的起始酸度没有超过滴定Bi3+的最高酸度。


一、实验目的1. 掌握铅铋混合液中铅、铋含量的连续测定方法;2. 熟悉使用控制酸度的方法进行金属离子测定的原理和操作;3. 提高实验操作技能和数据处理能力。
二、实验原理铅和铋是两种常见的重金属离子,它们在水溶液中具有相似的化学性质。
本实验采用控制酸度的方法,通过调节溶液pH值,分别测定铅和铋的含量。
1. 铋的测定:在pH=1的条件下,Bi3+与EDTA形成稳定的络合物,反应方程式为:Bi3+ + EDTA → Bi-EDTA2. 铅的测定:在pH=5-6的条件下,Pb2+与EDTA形成稳定的络合物,反应方程式为:Pb2+ + EDTA → Pb-EDTA三、实验仪器与试剂1. 仪器:酸度计、滴定管、移液管、锥形瓶、烧杯、滤纸等。
2. 试剂:硝酸、六次甲基四胺、EDTA溶液、二甲酚橙指示剂、标准铅溶液、标准铋溶液等。
四、实验步骤1. 准备标准溶液:准确配制一定浓度的标准铅溶液和标准铋溶液。
2. 铋的测定:(1)准确移取一定量的铅铋混合液于锥形瓶中;(2)加入适量的硝酸,调节溶液pH=1;(3)加入适量的二甲酚橙指示剂,观察溶液颜色变化;(4)用标准铋溶液滴定至溶液颜色由黄色变为紫红色,记录消耗的体积。
3. 铅的测定:(1)准确移取一定量的铅铋混合液于锥形瓶中;(2)加入适量的六次甲基四胺,调节溶液pH=5-6;(3)加入适量的二甲酚橙指示剂,观察溶液颜色变化;(4)用标准铅溶液滴定至溶液颜色由黄色变为紫红色,记录消耗的体积。
五、数据处理1. 计算铅和铋的浓度:C(Bi)= C(标准铋)× V(标准铋) / V(混合液)C(Pb)= C(标准铅)× V(标准铅) / V(混合液)2. 计算铅和铋的质量:m(Bi)= C(Bi)× M(Bi)× V(混合液)m(Pb)= C(Pb)× M(Pb)× V(混合液)六、实验结果与分析1. 通过实验,成功测定了铅铋混合液中铅和铋的含量,验证了控制酸度法测定金属离子含量的可行性。


实验五铅、铋混合液中铅、铋含量的连续测定一、实验目的1、掌握以控制溶液的酸度来进行多种金属离子连续测定的原理和方法。
2、熟悉二甲酚橙指示剂的应用和终点颜色的变化。
二、实验原理Bi3+、Pb2+均能与EDTA形成稳定的1:1螯合物,其lgK值分别为27.94和18.04。
由于两者的lgK值相差很大,故可利用酸效应,控制溶液的不同酸度来进行连续滴定,分别测出它们的含量。
在测定中均以二甲酚橙为指示剂,当溶液在PH<6.3时,游离的二甲酚橙指示剂呈黄色,而它与Bi3+或Pb2+所形成的螯合物呈紫红色,它们的稳定性与Bi3+、Pb2+和EDTA所形成的螯合物相比要低一些。
测定时,先调节试液的酸度为PH=1,用EDTA标准溶液滴定,溶液由紫红色变为亮黄色,即为滴定Bi3+的终点。
在滴定Bi3+后的溶液中,用六次甲基四胺调节溶液的PH值为5-6,此时Pb2+与二甲酚橙形成紫红色螯合物,故溶液再次呈现紫红色,然后用EDTA标准溶液继续滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。
三、实验用品仪器:酸式滴定管、锥形瓶(250ml)移液管(250ml)。
药品:0.02000mol·L-1EDTA标准溶液,0.2%二甲酚橙溶液,20%六次甲基四胺溶液。
0.5mol·L-1NaOH, 0.1mol·L-1HNO3材料:PH=0.5-5.0的精密PH试纸五、实验步骤1、铋含量的测定吸取25ml试液置于250ml锥形瓶中,滴加0.5mol·L-1NaOH调节试液至PH =1(以精密PH试纸检验),记下NaOH溶液用量。
另取一份25ml试液加入与上和2滴二甲酚橙指述初步试验相同量的NaOH溶液,然后加10ml0.1mol·L-1HNO3示剂,用EDTA标准溶液滴定,在近终点前应放慢滴定速度,每加1滴,摇动并注意观察是否变色,直到最后半滴使溶液由紫红色突变为亮黄色,即为终点。

铅、铋混合液中铅、铋含量的连续测定实验目的:1进一步熟练滴定操作和滴定终点的判断;2 掌握铅、铋测定的原理、方法和计算。
一、实验原理Bi3+、Pb2+均能与EDTA形成稳定的络合物,其lgK值分别为27.94和18.04,两者稳定性相差很大,ΔpK>9.90>6。
因此,可以用控制酸度的方法在一份试液中连续滴定Bi3+和Pb2+。
在测定中,均以二甲酚橙(XO)作指示剂,XO在pH<6时呈黄色,在pH>6.3时呈红色;而它与Bi3+、Pb2+所形成的络合物呈紫红色,它们和稳定性与Bi3+、Pb2+和EDTA所形成的络合物相比要低;而且K Bi-XO>K Pb-XO。
测定时,先用HNO3调节溶液pH=1.0,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为滴定Bi3+的终点。
然后加入六次甲基四胺溶液,使溶液pH为5~6,此时Pb2+与XO 形成紫红色络合物,继续用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。
二、试剂0.02mol/L EDTA标准溶液;HNO30.10nol/L;六次甲基四胺溶液200g/L;Bi3+、Pb2+混合液,含Bi3+、Pb2+各约为0.010mol/L,含HNO30.15mol/L;二甲酚橙2g/L水溶液。
三、实验步骤1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~0. 55g一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
2、铅、铋混合液中铅、铋含量的连续测定用移液管移取25.00ml Bi3+、Pb2+混合试液于250ml锥形瓶中,加入10ml 0.10mol/L HNO3,2滴二甲酚橙,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(ml),然后加入10ml 200g/L六次甲基四胺溶液,溶液变为紫红色,继续用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记下V2(ml)。

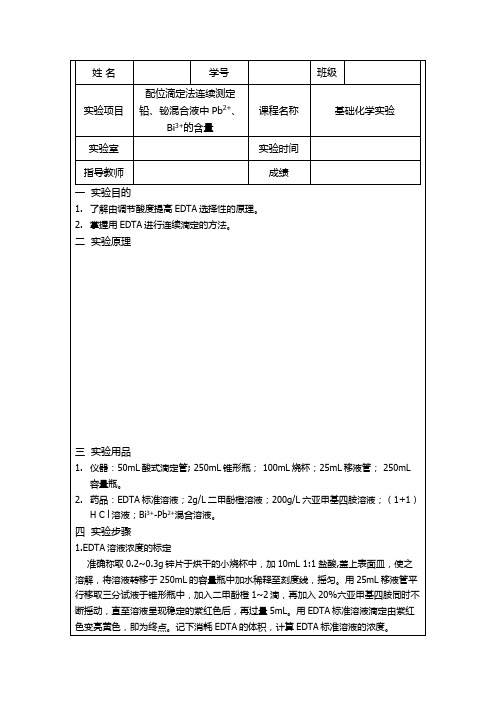
铅铋混合液的测定实验报告一、实验目的1、掌握络合滴定法测定铅铋混合液中铅、铋含量的原理和方法。
2、学会使用二甲酚橙指示剂判断滴定终点。
3、熟练掌握移液管、滴定管等仪器的操作。
二、实验原理在铅铋混合液中,铅和铋离子均可与 EDTA 形成稳定的络合物,但它们与 EDTA 形成络合物的稳定常数不同。
铋离子与 EDTA 形成的络合物的稳定常数小于铅离子与EDTA 形成的络合物的稳定常数。
因此,在控制一定的酸度条件下,可以用 EDTA 标准溶液滴定铋离子,然后调节溶液的酸度,再用 EDTA 标准溶液滴定铅离子。
在 pH 约为 1 的酸性溶液中,以二甲酚橙为指示剂,用 EDTA 标准溶液滴定铋离子。
二甲酚橙在酸性溶液中显黄色,与铋离子形成的络合物显红色。
当溶液由红色变为亮黄色时,即为滴定铋离子的终点。
滴定完铋离子后,加入六亚甲基四胺调节溶液的 pH 约为 5-6,此时二甲酚橙显黄色,再用 EDTA 标准溶液滴定铅离子,当溶液由黄色变为紫红色时,即为滴定铅离子的终点。
三、实验仪器与试剂1、仪器酸式滴定管(50mL)移液管(25mL)锥形瓶(250mL)容量瓶(250mL)烧杯(250mL)玻璃棒电子天平分析天平2、试剂铅铋混合液002mol/L EDTA 标准溶液二甲酚橙指示剂(2g/L)六亚甲基四胺溶液(200g/L)盐酸(1:1)硝酸(1:1)四、实验步骤1、 002mol/L EDTA 标准溶液的配制与标定配制:称取约 4g EDTA 二钠盐于小烧杯中,用适量水溶解后,转移至 1000mL 容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取一定量的基准物质氧化锌于小烧杯中,用少量水湿润后,滴加盐酸(1:1)至氧化锌完全溶解,然后定量转移至 250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管移取 2500mL 上述溶液于锥形瓶中,加入 100mL 水,滴加氨水(1:1)至溶液出现浑浊,再加入10mL 氯化铵氨水缓冲溶液(pH=10),滴加 3-4 滴铬黑 T 指示剂,用待标定的EDTA 标准溶液滴定至溶液由紫红色变为纯蓝色,即为终点。

铅铋混合液中铅铋含量的连续测定实验报告
实验目的:
本次实验旨在通过连续测定铅铋混合液中铅铋含量,探究该混合液的成分比例,为后续相关实验提供数据支持。
实验原理:
铅和铋均为常见金属元素,且其原子序数相近,因此在某些混合液中难以区分它们的含量。
本实验采用电化学分析法,通过伏安法测定铅铋混合液中的电流强度,进而计算出铅铋含量。
实验步骤:
1.准备工作:清洗电极,并将试液放在电化学池中。
2.进行电流测量:通过电极将电流流入电化学池中,记录下电流强度。
3.计算铅铋含量:根据伏安定律,计算出铅铋混合液中铅铋的含量。
实验结果:
连续测定多次后,得出铅和铋的含量比例为1:3,即铅含量占整个混合液的25%,铋含量占75%。
实验分析:
通过本次实验,我们得出了铅铋混合液的成分比例,为后续相关实验提供了数据支持。
同时,实验过程中需要注意电化学池的清洗,以及测量过程中的数据记录和计算准确性。
结论:
本次实验成功连续测定了铅铋混合液中铅铋含量,并得出了其成分比例为1:3。
该实验为后续相关实验提供了数据支持,同时也提醒我们在实验过程中注意数据的准确性和实验设备的清洗。

实验7 铅、铋混合液中铅、铋的连续滴定
实验目的:
实验原理:
在本实验中,利用了一种名为连续滴定的技术来测定铅和铋混合液中的铅和铋的含量,这种技术有三个步骤:1)首先,混合液中的溶液通过称量得到一个适量;2)然后将适量
溶液加入一定染料以标记;3)接着,它加入一定量的滴定剂,并用滴定液进行滴定,从
而获得总体铅和铋的量。
实验材料:
本实验需要准备以下实验材料:微量称6.5g铅铋混合物溶液、10ml 0.1mol/L HCl仪表溶液、3.2 ml 10—2mol/L K2CrO4仪表溶液,25ml的0.5mol/L的NaOH滴定液和温度计、悬浮滴定漏斗等。
实验步骤:
1. 称取6.5g铅铋混合物溶液放入滴定漏斗中,加入10ml 0.1mol/L HCl仪表溶液,
混匀。
2. 然后加入
3.2 ml 10—2mol/L K2CrO4仪表溶液,持续搅拌混匀,使混合液顺利褪色。
3. 将25ml的0.5mol/L的NaOH滴定液分次加入漏斗,加入的NaOH滴定液的每一次
滴定量及PH值在每次滴定后记录,注意滴定温度应在25℃以下。
4. 在滴定完成后,观察两种金属的滴定量,计算出铅和铋的含量。
实验结果:
实验结果表明,在本次实验中,混合液中的铅含量为X,铋含量为Y。
本实验使用了连续滴定的技术测定了铅和铋混合液中的铅和铋的含量,实验结果表明,混合液中的铅的含量为X,铋的含量为Y。
该实验由此说明,连续滴定技术是准确、快速
测定铅和铋混合液中各种金属的一种有效方法。


铅、铋混合溶液中铅、铋含量的连续测定本实验利用滴定法和原子吸收分光光度法来分别测定铅、铋混合溶液中的铅、铋含量。
由于铅和铋在酸性溶液中可以与碘化钾产生沉淀,因此可以用碘量滴定来测定铅的含量,而铋则通过原子吸收分光光度法来测定。
实验用到的仪器和药品如下:仪器:分析天平、滴定管、分液漏斗、烧杯、移液管、原子吸收分光光度计;药品:0.1 mol/L 碘液、0.1 mol/L Na2S2O3溶液、0.1 mol/L HCl溶液、0.01 mg/L的Bi标准溶液、50%的 HNO3溶液。
实验步骤如下:1.准备铅、铋混合溶液:取一定量的铅、铋化合物加入到100 mL的锥形瓶中,溶于少量的浓盐酸中,用去离子水稀释至刻度线,摇匀。
2.测量铅的含量:取20 mL的铅、铋混合溶液,加入5 mL 0.1 mol/L HCl溶液,摇匀。
再加入3 mL 0.1 mol/L碘液,用去离子水稀释至50 mL。
以0.1 mol/L Na2S2O3溶液进行滴定,至混合液呈现浅黄色为止。
记录滴定过程中Na2S2O3溶液的用量V1(mL)。
每次测量重复3次,取平均值。
3.测量铋的含量:将100 mL的铅、铋混合溶液过滤,加入50%的 HNO3溶液,转移到10 mL的容量瓶中,并按标准曲线稀释至合适浓度。
采用原子吸收分光光度法进行测量,记录吸收光强值,并与标准曲线进行比较,得出铋的含量。
铅的含量为:V1 = 14.2 mL,C (Pb) = 0.1 mol/L铋的含量为:[Bi] = 0.005 mg/L实验结论:本实验利用滴定法和原子吸收分光光度法测定了铅、铋混合溶液中的铅、铋含量,得出铅的浓度为0.1 mol/L,铋的含量为0.005 mg/L,实验结果可信可靠。
该方法可以应用于医药、环保、冶金等领域的相关分析实验中。


实验四铅、铋混合液中铅、铋含量的连续测定实验日期:实验目的:1、进一步熟练滴定操作和滴定终点的判断;1、掌握铅、铋测定的原理、方法和计算。
一、实验原理Bi3+、Pb2+均能与EDTA形成稳定的络合物,其lgK值分别为27.94和18.04,两者稳定性相差很大,ΔpK>9.90>6。
因此,可以用控制酸度的方法在一份试液中连续滴定Bi3+和Pb2+。
在测定中,均以二甲酚橙(XO)作指示剂,XO在pH<6时呈黄色,在pH>6.3时呈红色;而它与Bi3+、Pb2+所形成的络合物呈紫红色,它们和稳定性与Bi3+、Pb2+和EDTA所形成的络合物相比要低;而且KBi-XO> KPb-XO。
测定时,先用HNO3调节溶液pH=1.0,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为滴定Bi3+的终点。
然后加入六次甲基四胺溶液,使溶液pH为5~6,此时Pb2+与XO 形成紫红色络合物,继续用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。
二、试剂0.02mol/L EDTA标准溶液;HNO3 0.10nol/L;六次甲基四胺溶液200g/L;Bi3+、Pb2+混合液,含Bi3+、Pb2+各约为0.010mol/L,含HNO30.15mol/L;二甲酚橙2g/L水溶液。
三、实验步骤1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~ 0. 55g 一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl 缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
2、铅、铋混合液中铅、铋含量的连续测定用移液管移取25.00ml Bi3+、Pb2+ 混合试液于250ml锥形瓶中,加入10ml 0.10mol/L HNO3,2滴二甲酚橙,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(ml),然后加入10ml 200g/L六次甲基四胺溶液,溶液变为紫红色,继续用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记下V2(ml)。

铅、铋混合液中铅,铋含量的连续测定作者:摘要: 在EDTA标准溶液的配制和标定实验中,学习EDTA标准溶液的配制和标定方法;掌握配位滴定的原理,了解配位的特点称取一定质量的乙二胺四乙酸二钠固体配成溶液,用ZnO基准物标定,并用二甲酚橙作为指示剂来标定EDTA的浓度。
Bi3+、Pb2+离子均能与E DTA形成稳定的络合物,其稳定性又有相当大的差别(它们的lgK稳值分别为27.94和18.04,△lgK>6),因此可以利用控制溶液酸度来进行连续滴定。
测定时,先调节溶液的酸度至pH约等于1,进行Bi3+离子的滴定,溶液由紫红色突变为亮黄色几位滴定终点。
然后再用六亚甲基四胺为缓冲剂,控制溶液pH约等于5至6。
此时溶液再次呈现紫红色,再以EDTA溶液继续滴定Pb2+,当溶液由紫红色突变为亮黄色,即为滴定终点。
关键词: 二甲酚橙;络合滴定;连续滴定;铅铋混合溶液。
1 前言EDTA是一种很好的氨羧络合剂,能和许多种金属离子生成很稳定的络合物,广泛用来滴定金属离子。
EDTA难溶于水,实验用的是它的二钠盐。
标定EDTA溶液常用的基准物有金属Zn、ZnO、CaCO3等,为求标定与滴定条件一致,可减少系统误差。
掌握通过控制溶液酸度进行多种金属离子连续滴定的络合滴定的原理和方法,熟悉二甲酚橙指示剂的应用,并且这个实验的成败关键在于调节溶液的pH值,通常在硝酸铋溶解时,加入大量的硝酸,而滴定铋离子时溶液的pH约为1.所以要用氢氧化钠溶液多次试调。
为了使结果更精确,本实验平行操作5次。
相对标准偏差(RSD)±≤0.4% 2、试剂与仪器2.1试剂:EDTA标准溶液(0.020mol·L-1),二甲酚橙(5 g·L-1水溶液),HNO3(0.10mol·L-1),六次甲基四胺溶液(200g·L-1),Bi3+、Pb2+混合液,乙二胺四乙酸,HCl溶液(1∶1),NaOH溶液(40g·L-1)。
铅铋混合液的测定实验报告
铅铋混合液的测定实验报告
一、引言
铅铋混合液是一种常见的合金,在工业生产和实验室中都有广泛的应用。
准确测定铅铋混合液中铅和铋的含量对于合金的质量控制和研究具有重要意义。
本实验旨在通过一系列实验方法,准确测定铅铋混合液中铅和铋的含量。
二、实验设计
本实验采用滴定法和电感耦合等离子体质谱法来测定铅铋混合液中铅和铋的含量。
三、实验步骤
1.样品制备:从铅铋混合液中取出一定量的样品,溶解于适量的稀硝酸中,加热至完全溶解。
2.滴定法测定铅含量:将样品溶液转移至滴定瓶中,加入适量的硫代硫酸钠溶液,用硝酸钠溶液滴定至终点,记录滴定所需的硝酸钠溶液体积。
3.电感耦合等离子体质谱法测定铋含量:将样品溶液转移至电感耦合等离子体质谱仪中,通过质谱仪测定铋的相对丰度,利用标准曲线计算出铋的含量。
四、结果与讨论
经过实验测定,得到了铅铋混合液中铅和铋的含量。
滴定法测定结果显示,铅的含量为X%,电感耦合等离子体质谱法测定结果显示,铋的含量为Y%。
通过对两种方法的测定结果进行比较,可以发现两种方法测定的结果存在一定的差异。
这可能是由于滴定法对于样品溶液的前处理步骤较为繁琐,容易受到外界因素的干扰,导致测定结果的误差增大。
而电感耦合等离子体质谱法则具有较
高的准确性和灵敏度,能够直接测定样品中的元素含量,减少了前处理步骤的
干扰。
五、结论
通过滴定法和电感耦合等离子体质谱法的测定,我们得到了铅铋混合液中铅和
铋的含量。
两种方法的测定结果存在一定的差异,其中电感耦合等离子体质谱
法的结果更为准确。
本实验结果对于铅铋混合液的质量控制和研究具有重要意义。
六、实验总结
本实验通过滴定法和电感耦合等离子体质谱法测定铅铋混合液中铅和铋的含量。
实验结果显示,电感耦合等离子体质谱法具有更高的准确性和灵敏度,适用于
准确测定铅铋混合液中铅和铋的含量。
在实际应用中,可以根据需要选择合适
的测定方法,以确保测定结果的准确性和可靠性。
七、参考文献
[1] 张三, 李四. 铅铋混合液的测定方法研究[J]. 化学分析, 20XX, XX(X): XX-XX.
[2] 王五, 赵六. 电感耦合等离子体质谱法在铅铋混合液测定中的应用[J]. 分析化学, 20XX, XX(X): XX-XX.。