实验四 铅铋混合液中铅、铋含量的连续测定
- 格式:doc
- 大小:22.50 KB
- 文档页数:2

铅铋混合液的测定实验报告一、实验目的1、掌握络合滴定法测定铅铋混合液中铅、铋含量的原理和方法。
2、学会使用二甲酚橙指示剂判断滴定终点。
3、熟练掌握移液管、滴定管等仪器的使用方法。
二、实验原理铅、铋离子均能与 EDTA 形成稳定的络合物,但其稳定常数不同。
在 pH=1 的条件下,以二甲酚橙为指示剂,用 EDTA 标准溶液滴定铋离子,此时铅离子不与 EDTA 反应。
然后调节溶液 pH 至 5-6,继续用EDTA 标准溶液滴定铅离子。
铋离子与 EDTA 反应的化学方程式为:Bi³⁺+ H₂Y²⁻= BiY⁻+ 2H⁺铅离子与 EDTA 反应的化学方程式为:Pb²⁺+ H₂Y²⁻= PbY²⁻+ 2H⁺二甲酚橙在 pH<6 时呈黄色,与铋离子、铅离子形成的络合物呈紫红色。
当溶液由紫红色变为亮黄色时,即为滴定终点。
三、实验仪器与试剂1、仪器酸式滴定管(50mL)移液管(25mL)锥形瓶(250mL)容量瓶(250mL)电子天平玻璃棒烧杯(250mL、500mL)量筒(100mL)胶头滴管2、试剂铅铋混合液二甲酚橙指示剂(2g/L)六次甲基四胺溶液(200g/L)盐酸(1:1)硝酸(1:1)乙二胺四乙酸二钠(EDTA)标准溶液(约 002mol/L)四、实验步骤1、 EDTA 标准溶液的配制与标定配制:称取约 4g EDTA 二钠盐于 250mL 烧杯中,用适量水溶解后,转入 500mL 容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取一定量的基准物质氧化锌(预先在 800℃灼烧至恒重)于 250mL 烧杯中,用少量水润湿,盖上表面皿,从杯嘴边逐滴加入 1:1 盐酸至氧化锌完全溶解。
加入 100mL 水,加热煮沸,冷却后移入 250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管吸取 2500mL上述溶液于 250mL 锥形瓶中,加入 50mL 水,滴加 1:1 氨水至溶液刚出现浑浊,再加入 10mL 氯化铵氨缓冲溶液(pH=10),滴加 3-4 滴铬黑 T 指示剂,用待标定的 EDTA 标准溶液滴定至溶液由紫红色变为纯蓝色,即为终点。

铅铋合金EDTA滴定法测定铅、铋量铅的测定——EDTA容量法摘要:采用EDTA滴定法连续测定了铅铋合金中的铅和铋,通过加人掩蔽剂抗坏血酸、酒石酸和硫脲来消除干扰离子的影响,取得了很好的准确度和精密度,且分析流程短。
关键词:铅铋合金;铅铋连测;抗坏血酸;酒石酸;硫脲粗铅铋合金是贵金属冶炼过程中的副产品,铅和铋含量达到95%一97%,伴有铜、铁、锌、镉等杂质。
粗铅铋合金作为电解生产铅锭和铋锭的原材料,快速准确测定粗铅铋合金中铅和铋含量对生产控制和金属平衡工作显得尤为必要。
目前,粗铅化学分析方法⋯中铅和铋含量分开测定,分析流程长、耗费时间多,不利于快速测定,而铅、铋混合液中铅、铋含量的测定方法心。
3没有考虑到杂质元素对测定的干扰。
本文通过试验,研究了杂质元素如铜、铁、银、碲、硒、锑对铅铋测定的影响,并通过加入适量的掩蔽剂去除杂质元素对铅铋测定的干扰,实现了快速准确对粗铅铋合金中铅和铋含量的连续测定。
1实验部分试样经稀硝酸分解分取一定量试液,用硫酸沉淀分离铅,消除铁、铜、锌、镉、银等元素的干扰,加入乙酸—乙酸钠缓冲液溶解铅,以二甲粉橙为指示剂,用EDTA标准溶液为滴定,由消耗EDTA标准溶液的体积计算铅量1.1试剂硝酸(1+3);抗坏血酸;硫脲饱和溶液:在水中加入过量的硫脲并饱和之;硫酸洗液(2+98):量取10ml硫酸,缓慢加入到490ml水中,摇匀即可;饱和乙酸钠;乙酸—乙酸钠缓冲溶液(PH=5.5-6.0):称取1500g的结晶乙酸钠,用水溶解后定溶于5000ml的容量瓶中,加入120ml冰乙酸摇匀即可;二甲酚橙(0.5%):称取0.5g二甲酚橙,加入定容于100ml滴瓶中,摇匀溶解;EDTA标准溶液:称取110g乙二铵四乙酸二钠(EDTA)于10000ml容量瓶中加水至刻度,溶解、摇匀,放置一周待标定;铅标准溶液:称取4g金属纯铅(Pb≥99.994),加入200ml硝酸(1+3),低温加热溶解,完全取下稍冷,定容至1000ml,此溶液为4mg/ml。


铅、铋混合溶液中铅、铋含量的连续测定文摘:EDTA:乙二胺四乙酸H4Y(本身是四元酸),由于在水中的溶解度很小,通常把它制成二钠盐(Na2H2Y·2H2O),也称为EDTA或EDTA二钠盐。
EDTA相当于六元酸,在水中有六级离解平衡。
与金属离子形成螯合物时,络合比皆为1:1。
EDTA因常吸附0.3%的水分且其中含有少量杂质而不能直接配制标准溶液,通常采用标定法制备EDTA标准溶液。
标定EDTA的基准物质有纯的金属:如Cu、Zn、Ni、Pb,以及它们的氧化。
某些盐类:如CaCO3、ZnSO4.7H2O、MgSO4.7H2OBi3+,Pb2+均能和EDTA形成稳定的 1:1 络合物。
logK 值分别为27.04 和18.04 。
由于二者的l ogK值相差很大,故可控制不同的酸度分别进行滴定。
关键字:EDTA ZnO Bi3+, Pb2+ 二甲酚橙六次甲基四胺溶液综述:金属离子指示剂:在络合滴定时,与金属离子生成有色络合物来指示滴定过程中金属离子浓度的变化。
M +In ←→ MIn颜色甲颜色乙滴入EDTA后,金属离子逐步被络合,当达到反应化学计量点时,已与指示剂络合的金属离子被EDTA夺出,释放出指示剂的颜色:MIn +Y ←→MY +In颜色乙颜色甲指示剂变化的pMep应尽量与化学计量点的pMsp一致。
金属离子指示剂一般为有机弱酸,存在着酸效应,要求显色灵敏,迅速,稳定。
常用金属离子指示剂:铬黑T(EBT):pH=10时,用于Mg2+,Zn2+,Cd2+,Pb2+,Hg2+,In3+,二甲酚橙(XO):pH5~6时,Zn2+K-B指示剂(酸性铬蓝(K)-荼酚绿(B)混合指示剂):pH=10时,用于Mg2+,Zn2+, Mn2+。
pH=12时,用于Ca2+在络合滴定过程中,随着络合物的生成,不断有H+释出:M+H2Y=MY+2H+因此,溶液的酸度不断增大,酸度增大的结果,不仅降低了络合物的条件稳定常数,使滴定突跃减小,而且破坏了指示剂变色的最适宜酸度范围,导致产生很大的误差。


铅铋混合液中铅、铋连续测定方法改进刘淑萍【期刊名称】《河北联合大学学报(自然科学版)》【年(卷),期】2001(023)001【摘要】通过对铅(Pb2+)、(Bi3+)混合液配制方法与测定结果关系的实验,确定了硝酸铋溶解时的浓HNO3用量,解决了实验中滴定铋Bi3+时用NaOH溶液多次予调试试液pH≈1的不准与麻烦。
本文确定的实验方法,节省药品、操作快速、终点时突跃明显,易于观察,便于在实验中准确滴定%Relations between Pb2+,Bi3+in mixed solution compound and testing results were studied.During Bi(NO3)3 dissolving,quantity of HNO3 needed were determined。
The method overcame the d iff iculty and obtained the precision that the solution of NaOH debuge sample soluti on waspH≈1.The methed that the expe riment used is not noly saving reagent but a l so saving the experiment time.Titrate termined mutation is very obvious in the d estination.It is very easy to abserve and convenient to titrate precisely in ex periments for students.【总页数】4页(P75-77,87)【作者】刘淑萍【作者单位】河北理工学院化工系,【正文语种】中文【中图分类】O655.25【相关文献】1.高纯金锭中铜铅锑铋含量测定方法的改进 [J], 廖占丕;曾健年;范永香;江泓2.铅铋混合液连续测定中废液的回收与再生 [J], 黄芳;张长丽;杨慧3.铅、铋混合液配制方法的探索与改进 [J], 盛勤芳4.高铋铅中铅量的测定方法研究 [J], 曾军;谭平生;庞文林;朱红波5.配制铅铋混合液酸度条件的改进 [J], 杨朝修;谢能茂因版权原因,仅展示原文概要,查看原文内容请购买。
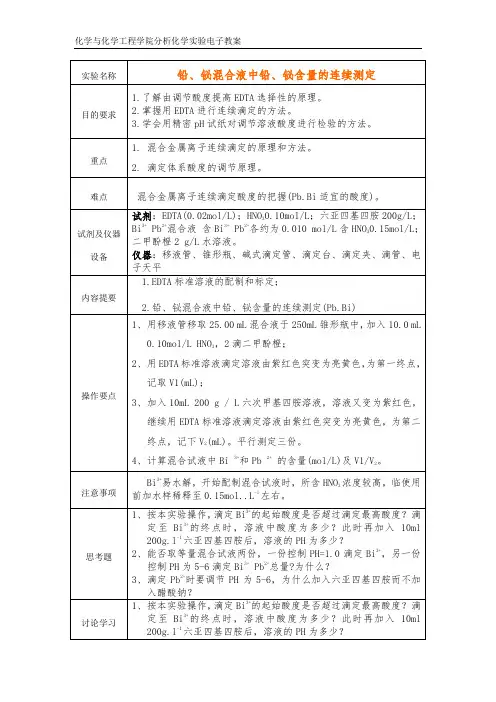

铅、铋混合液中铅、铋含量的连续测定实验目的:1进一步熟练滴定操作和滴定终点的判断;2 掌握铅、铋测定的原理、方法和计算。
一、实验原理Bi3+、Pb2+均能与EDTA形成稳定的络合物,其lgK值分别为27.94和18.04,两者稳定性相差很大,ΔpK>9.90>6。
因此,可以用控制酸度的方法在一份试液中连续滴定Bi3+和Pb2+。
在测定中,均以二甲酚橙(XO)作指示剂,XO在pH<6时呈黄色,在pH>6.3时呈红色;而它与Bi3+、Pb2+所形成的络合物呈紫红色,它们和稳定性与Bi3+、Pb2+和EDTA所形成的络合物相比要低;而且K Bi-XO>K Pb-XO。
测定时,先用HNO3调节溶液pH=1.0,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为滴定Bi3+的终点。
然后加入六次甲基四胺溶液,使溶液pH为5~6,此时Pb2+与XO 形成紫红色络合物,继续用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。
二、试剂0.02mol/L EDTA标准溶液;HNO30.10nol/L;六次甲基四胺溶液200g/L;Bi3+、Pb2+混合液,含Bi3+、Pb2+各约为0.010mol/L,含HNO30.15mol/L;二甲酚橙2g/L水溶液。
三、实验步骤1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~0. 55g一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
2、铅、铋混合液中铅、铋含量的连续测定用移液管移取25.00ml Bi3+、Pb2+混合试液于250ml锥形瓶中,加入10ml 0.10mol/L HNO3,2滴二甲酚橙,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(ml),然后加入10ml 200g/L六次甲基四胺溶液,溶液变为紫红色,继续用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记下V2(ml)。


铅铋混合液的测定实验报告一、实验目的1、掌握络合滴定法测定铅铋混合液中铅、铋含量的原理和方法。
2、学会使用二甲酚橙指示剂判断滴定终点。
3、熟练掌握移液管、滴定管等仪器的操作。
二、实验原理在铅铋混合液中,铅和铋离子均可与 EDTA 形成稳定的络合物,但它们与 EDTA 形成络合物的稳定常数不同。
铋离子与 EDTA 形成的络合物的稳定常数小于铅离子与EDTA 形成的络合物的稳定常数。
因此,在控制一定的酸度条件下,可以用 EDTA 标准溶液滴定铋离子,然后调节溶液的酸度,再用 EDTA 标准溶液滴定铅离子。
在 pH 约为 1 的酸性溶液中,以二甲酚橙为指示剂,用 EDTA 标准溶液滴定铋离子。
二甲酚橙在酸性溶液中显黄色,与铋离子形成的络合物显红色。
当溶液由红色变为亮黄色时,即为滴定铋离子的终点。
滴定完铋离子后,加入六亚甲基四胺调节溶液的 pH 约为 5-6,此时二甲酚橙显黄色,再用 EDTA 标准溶液滴定铅离子,当溶液由黄色变为紫红色时,即为滴定铅离子的终点。
三、实验仪器与试剂1、仪器酸式滴定管(50mL)移液管(25mL)锥形瓶(250mL)容量瓶(250mL)烧杯(250mL)玻璃棒电子天平分析天平2、试剂铅铋混合液002mol/L EDTA 标准溶液二甲酚橙指示剂(2g/L)六亚甲基四胺溶液(200g/L)盐酸(1:1)硝酸(1:1)四、实验步骤1、 002mol/L EDTA 标准溶液的配制与标定配制:称取约 4g EDTA 二钠盐于小烧杯中,用适量水溶解后,转移至 1000mL 容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取一定量的基准物质氧化锌于小烧杯中,用少量水湿润后,滴加盐酸(1:1)至氧化锌完全溶解,然后定量转移至 250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管移取 2500mL 上述溶液于锥形瓶中,加入 100mL 水,滴加氨水(1:1)至溶液出现浑浊,再加入10mL 氯化铵氨水缓冲溶液(pH=10),滴加 3-4 滴铬黑 T 指示剂,用待标定的EDTA 标准溶液滴定至溶液由紫红色变为纯蓝色,即为终点。
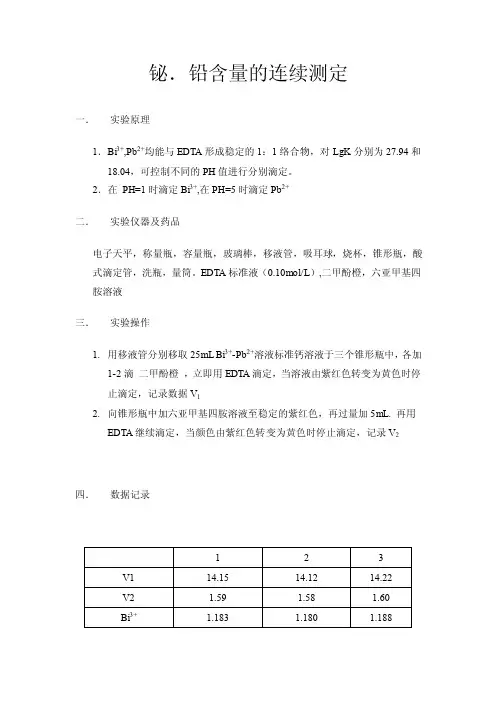
铋.铅含量的连续测定
一.实验原理
1.Bi3+,Pb2+均能与EDTA形成稳定的1:1络合物,对LgK分别为27.94和
18.04,可控制不同的PH值进行分别滴定。
2.在PH=1时滴定Bi3+,在PH=5时滴定Pb2+
二.实验仪器及药品
电子天平,称量瓶,容量瓶,玻璃棒,移液管,吸耳球,烧杯,锥形瓶,酸式滴定管,洗瓶,量筒。
EDTA标准液(0.10mol/L),二甲酚橙,六亚甲基四胺溶液
三.实验操作
1.用移液管分别移取25mL Bi3+-Pb2+溶液标准钙溶液于三个锥形瓶中,各加
1-2滴二甲酚橙,立即用EDTA滴定,当溶液由紫红色转变为黄色时停止滴定,记录数据V1
2.向锥形瓶中加六亚甲基四胺溶液至稳定的紫红色,再过量加5mL. 再用
EDTA继续滴定,当颜色由紫红色转变为黄色时停止滴定,记录V2四.数据记录
五.注意事项。
1.酸式滴定管,移液管均应用标准液润洗,酸式滴定管经排气泡,调零点后才能滴定。
2.移液管放液时要使其竖直,锥形瓶要倾斜,使尖端靠在锥形瓶内壁上。
3.滴定时滴定管尖端约在锥形瓶颈部处,在此过程中要不断用洗瓶冲洗锥形瓶内壁。
铅铋含量的连续测定计算公式铅铋含量的连续测定计算公式为:
铅铋含量= ([铅] × M1 × V1) / ([铋] × M2 × V2)
其中,[铅]和[铋]分别表示测得的铅和铋的质量浓度,M1和M2分别表示铅和铋的摩尔质量,V1和V2分别表示对应的体积。
需要注意的是,该公式仅适用于铅和铋在样品中的含量较低且不能相互干扰的情况下。
拓展:在实际应用过程中,为了提高测定的准确性和可靠性,通常还需要采用多种方法和技术手段,如前处理、分离富集、X射线荧光光谱、电感耦合等离子体质谱等,以实现对铅铋含量的连续、精确、快速测定和分析。
EDTA标准溶液的配制和标定及铅、铋混合液中铅、铋含量的连续测定摘要:在EDTA标准溶液的配制和标定实验中,学习EDTA标准溶液的配制和标定方法;掌握配位滴定的原理,了解配位的特点。
称取一定质量的乙二胺四乙酸二钠固体(AR)配成溶液,用ZnO基准物标定,并用二甲酚橙作为指示剂来标定EDTA的浓度。
平行进行6次滴定,测得 EDTA的浓度为0.02514mol/L. 接着再用标定的EDTA溶液测量铅、铋混合液中铅、铋的含量。
平行进行6次滴定,测得铋的浓度为0.009947 mol/L,铅的浓度为0.01002 mol/L。
Abstract: in the preparation of standard solutions of EDTA and calibration experiments, the method of preparation of standard solutions of EDTA and calibration; grasp the principle of coordination titration, and understand the characteristics of coordination. Take a certain quality of ethylene diamine tetraacetic acid coordination. Take a certain quality of ethylene diamine tetraacetic acid disodium solids (AR) mixed into aqueous solution using ZnO base calibration using xylenol orange as the indicator to calibrate the concentration of EDTA. Parallel 6 titration, the measured concentrations of EDTA 0.02514mol/L. EDTA solution and then used calibration measurements of lead, bismuth, lead and bismuth content in the mixture. Parallel 6 titration, the measured concentrations of bismuth 0.009947 mol/L, 0.01002 mol/l concentrations of lead.关键词:EDTA;基准物;连续测定;二甲酚橙Keywords: EDTA; Datum; continuous measurement; xylenol Orange EDTA配合物特点:广泛配位性:它几乎能与所有Mn+配位形成螯合物;稳定性:5个五元环螯合物→稳定、完全、迅速;具6个配位原子,与金属离子多形成1:1配合物,能溶于水;与无色离子形成无色配合物;与有色金属离子形成颜色更深的同色配合物。
铋、铅含量的连续测定一、预习思考1. 你是否认真阅读实验资料?是2.描述连续滴定Bi3+、Pb2+过程中,锥形瓶中颜色变化的情形,以及颜色变化的原因。
答:加入指示剂后,溶液显紫红色(Bi3+与指示剂形成紫红色络合物,但Pb2+不与二甲酚橙显色),随着滴定的进行,溶液有紫红色变为黄色即为Bi3+滴定的终点。
(Bi3+与EDTA结合)。
在滴定Bi3+后的溶液中,加入六亚甲基四胺溶液,调节溶液pH为5~6.此时Pb2+与二甲酚橙形成紫红色络合物,溶液再次呈现紫红色,然后用EDTA标液继续滴定,当溶液由紫红色变为黄色时,即为滴定Pb2+的终点。
3.为什么本实验选用锌基准物标定EDTA标准溶液?答:EDTA因常吸附0. 3%的水分且其中含有少量杂质而不能直接配制标准溶液,通常采用标定法制备EDTA标准溶液。
标定EDTA的基准物质有纯的金属:如Cu、Zn、Ni、Pb ,以及它们的氧化物。
选用的标定条件应尽可能与测定条件一致,以免引起系统误差。
如果用被测元素的纯金属或化合物作基准物质,就更为理想。
通常采用纯金属锌。
二、本次实验安全、环保、健康注意事项(查阅并写出本实验可能用到的试剂、化学品的MSDS,仪器设备安全操作注意事项,实验废弃物处置注意事项,实验人员人身防护注意事项等)六亚甲基四胺MSDS:侵入途径:吸入、食入。
健康危害:生产条件下,主要引起皮炎和湿疹。
皮疹多为多形性,奇痒,初起局限于接触部位,以后可蔓延、甚至遍及全身。
危险特性:遇明火有引起燃烧的危险。
受热分解放出有毒的氧化氮烟气。
与氧化剂混合能形成爆炸性混。
电炉:在放入工件的时候要注意,不要磕碰炉体,同时注意工件的完整性,而在加热过程中,要注意加热速度的控制,在设置升温速率时要充分考虑工件材料的物理化学性质,避免出现喷料现象,污染炉膛。
三、预习过程中,本人查阅的文献及内容摘要《铅铋混合溶液中铅、铋含量的连续测定》——黄曼(南京化工职业技术学院)摘要:本文自行设计和制作了分析专业学生所用的微型滴定装置,并用于《定量化学分析》课程实验中的铅铋混合溶液的连续测定实验,对微型滴定法与常量滴定法的平行测定结果进行了比较,结果无显著性差异,微型滴定法的精度达到常量滴定法测定水平,能满足化学分析要求。
实验四 铅铋混合液中铅、铋含量的连续测定
一、 实验原理
利用控制酸度的方法连续测定。
lgK BiY -lgK PbY = 27.94-18.04 = 9.9 > 5
先用硝酸调节溶液pH =1测定铋,再用六次甲基四胺调节溶液pH =5 ~ 6测定铅。
二、 实验步骤(平行测定三份)
二甲酚橙 2滴 加水10 mL pH ≈ 1
用移液管取铅铋混合液
10.00 mL 于锥形瓶中
三、计算 ()00.100.20911⨯⨯=⋅-V C L
g Bi EDTA ()00
.102.20721⨯⨯=⋅-V C L g Pb EDTA 注意:取来混合液后,加水10 mL ,水过多会造成Bi 水解 滴定至溶液变为橙色,再半滴操作 滴至黄色终点,记下体积V 1 补加二甲酚橙 1滴 至紫红色再多加3 mL
加20%六次甲基四胺
滴定溶液变为橙色,再半滴操作 滴至黄色终点,记下体积V 2。