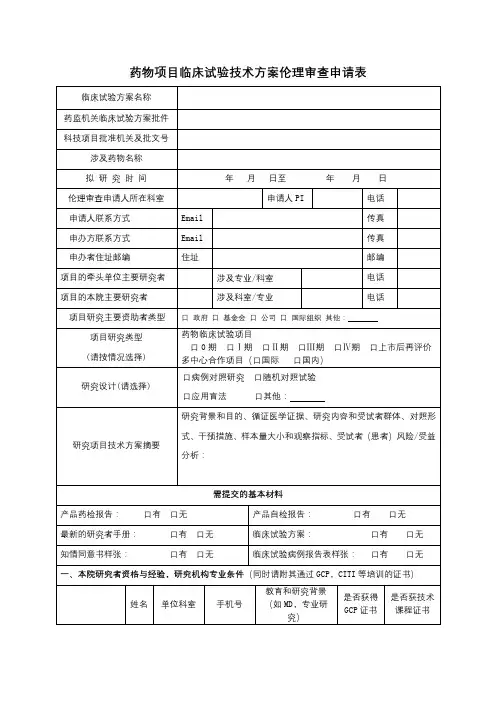
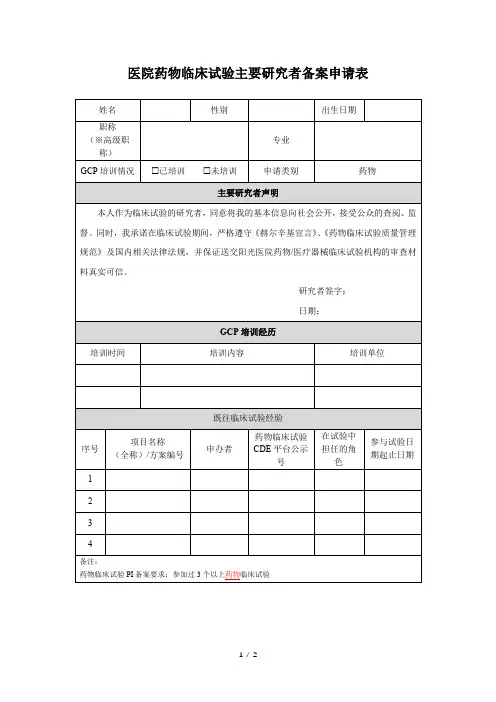
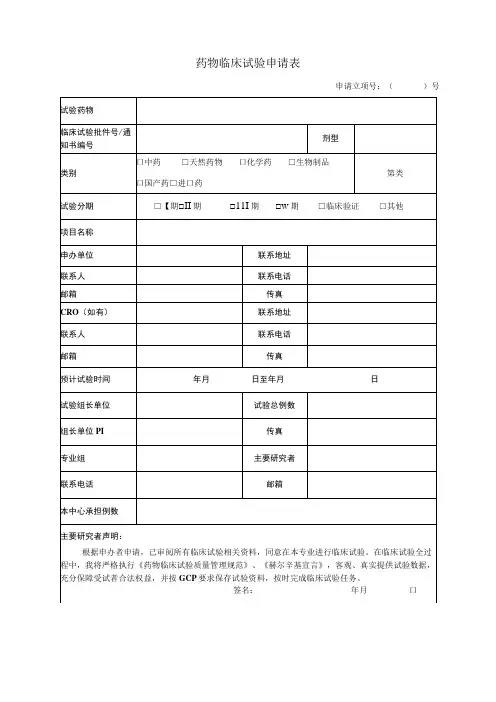
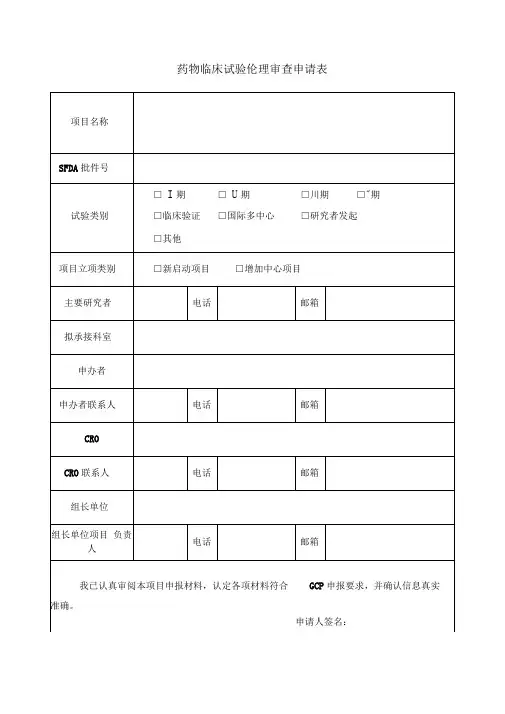
药物临床试验申请表
- 格式:docx
- 大小:8.24 KB
- 文档页数:2


临床实验方案申请表申请人姓名:_____________________申请日期:_____________________一、研究方案概述研究题目:研究目的:研究设计类型:研究受试者人数估计:研究地点:研究周期:研究经费预算:二、研究背景与目的请简要描述研究的背景,并明确研究的目的。
三、研究设计与方法1. 研究类型请标明该实验属于哪种类型的研究(例如前瞻性队列研究、随机对照试验等),并说明为什么选择此种研究设计。
2. 研究受试者请描述研究计划中受试者的招募标准,并说明研究受试者的数量及受试者的来源。
3. 干预措施请详细描述研究计划中的干预措施,包括药物、手术、治疗等。
4. 观测指标请列出研究计划中的主要观测指标,并解释为什么选择这些指标。
5. 数据收集和处理请描述数据的收集方式和数据处理的方法,并解释为什么选择这些方法。
6. 伦理准备是否已获得相关伦理委员会的批准?若已获得,请提供伦理委员会的批准文件的编号和日期。
7. 预期结果请简要描述你预期的研究结果,以及对该领域的贡献。
四、研究计划及预算请详细描述研究计划的时间表和研究经费的预算。
请列出每个时间节点的主要工作内容与预计完成时间,以及各项经费的具体用途。
五、团队成员及分工请列出参与研究计划的研究人员姓名和职称,并说明每位成员的具体分工。
六、科研保密及知识产权保护声明请就科研保密和知识产权保护方面做出明确的声明,确保研究成果的合法性和权益保护。
七、参考文献请列出参考文献,确保研究计划的科学性和可靠性。
以上为临床实验方案申请表的内容,申请人请按照表格要求填写相关信息,并提交至相关部门审核。
祝您申请成功,研究顺利!。
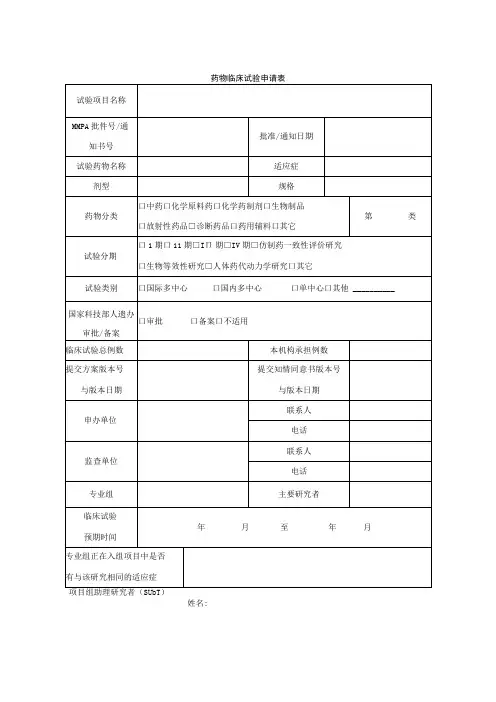

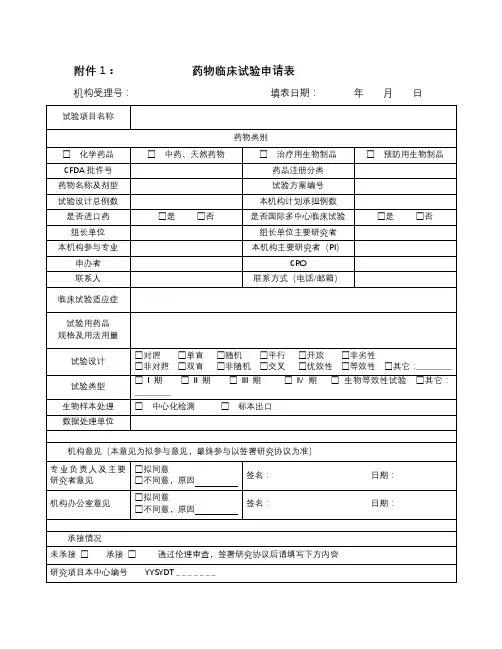
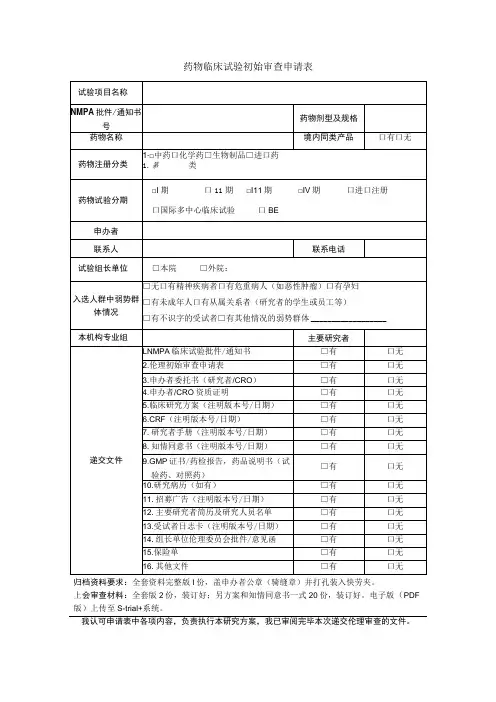
药物临床试验初始审查申请表一、研究信息药物临床试验分期口1期口11期口11I期□IV期口生物等效性试验口临床验证□其他: __________________方案设计类型口实验性研究口观察性研究:口回顾性分析口前瞻性研究□其他: __________________研究信息数据与安全监察委员会:口无,口有多中心临床试验:口否,□是τ口国际多中心组长单位,口国际多中心参加单位□国内多中心组长单位,□国内多中心参加单位本研究是否已在其他中心启动:口是,口否,口不适用研究使用人体生物标本情况:口研究中采集,口利用以往保存的,口不使用涉及人类遗传资源管理情况:口备案,口批准,口不涉及研究类型:口未上市,药品注册研究;口已上市,用于申请修改说明书研究;口已上市,非注册性、非修改说明书研究试验是否为两阶段适应性设计:□否口是T在本中心开展阶段:,若非首阶段研究,前期研究是否已完成并提交研究数据:口是,口否研究是否取得国家药监部门同意:口是,口否一口有与国家药监局的沟通交流会议记要:T请同时递交。
口与递交国家药监局资料一致,口与递交国家药监局资料不一致,说明:试验设计总例数:,本中心计划招募受试者人数:预期研究时间:年月至年月(伦理收费及批准研究时间以此为准)招募方式及人群招募者:口医生,口研究人员,口中介公司,口其他:招募方式:口发布招募广告,口临床诊疗过程,口数据库,□其他:研究是否涉及弱势人群或个体:□否口是T弱势的具体特征:________________________________________________________ 针对性的附加保护措施:__________________________________________________ 受试者补偿和支付计划口无补偿口有补偿:口货币补偿,补偿理由及数额:_____________________________________________ 口非货币补偿,说明:____________________________________________________ 支付计划(请详细描述发放周期及流程):受试者参与研究的费用谁支付研究干预和研究程序的费用:研究药物费用支付者:□申办者,口受试者,口其他:研究理化检查费用支付者:□申办者,口受试者,口其他:其他,说明:____________________________________________________________知情同意谁获取知情同意:口主要研究者,口研究者,口其他:获取知情同意地点:口私密房间/受试者接待室,口诊室,口病房,口其他:知情同意签字:口受试者签字,口监护人签字知情同意的例外口否,口是τ口申请变更知情同意,口申请豁免知情同意理由: _______________________________________________________________ 研究者其他研究工作本人在研的研究项目数:—项,其中与本项目目标疾病相同的项目数:一项。
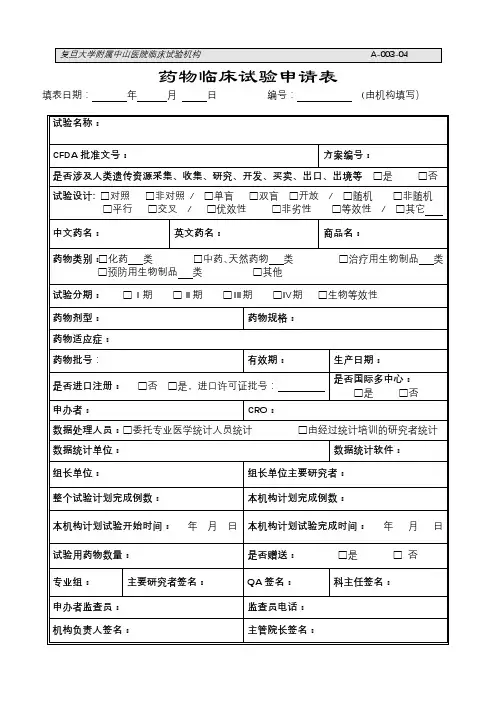
药物临床试验申请表
一、项目名称:
试验类别:Ⅰ期 Ⅱ期 Ⅲ期 Ⅳ期 生物利用度□再评价□其他临床试验批文号:
是否是国际多中心试验: 是 否
是否获重大项目资助:
二、试验用药物
1.试验药物
中文名:
英文名:
商品名:
剂型及规格:
2.对照药物
中文名:
英文名:
商品名:
剂型及规格:
三、申办方/CRO
申办单位/CRO名称:
联系人姓名:职务/职称:
联系电话/传真/手机
Email:
四、项目团队
项目负责人:N/A 职务/职称:N/A
专业:N/A
参加项目主要人员:
CRC:联系方式:
是否为项目组长单位:是 否 (如选择否请注明组长单位名称及负责人) N/A 五、试验方案要点
试验方案编号:
随机分配方法:
随机号分配方法:
试验配置:盲法:
项目总例数:本中心例数:
预期开始/完成日期:
适应症:
禁忌症:
六、给药方案
七、受试者知情同意关键信息是否完整
是 否
八、可能出现的不良反应
九、对不良事件的相应防治措施
十、项目负责人承诺
项目负责人(签名):
日期:十一、专业负责人(签名):
日期:十二、机构意见
日期:。