临床试验递送资料目录(药物类别)
- 格式:doc
- 大小:53.00 KB
- 文档页数:3

药物临床试验立项提供资料目录v2.0
武汉市传染病医院国家药物临床试验机构附件SOP-5-3 GCP certified site of Wuhan Infectious Diseases Hospital V 2.0 药物临床试验机构立项提供资料目录
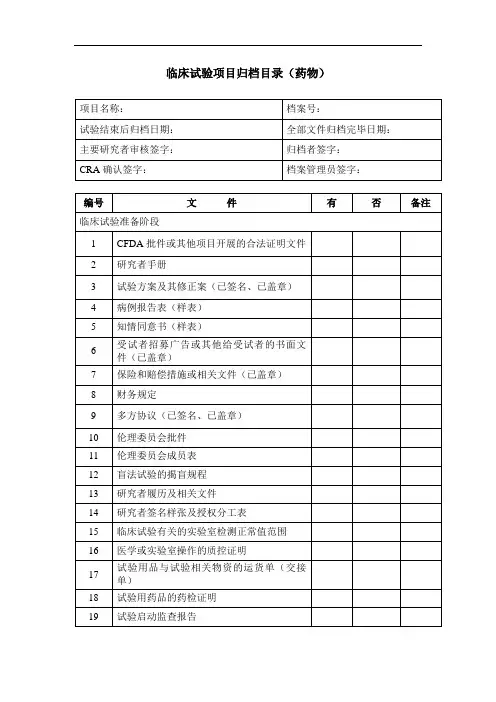
0.机构立项递交信
1.临床试验立项申请表
2.国家食品药品监督管理局批件
3.组长单位伦理委员会批件及成员表(如适用)
4.药品注册申请人的营业执照、生产许可证、相应的GMP证书等(复印件
加盖单位红章)
5.委托书(如申办者委托CRO公司、申办方/CRO委托临床机构、申办方
/CRO委托SMO(若有)、CRO对CRA委托(含CRA资质))
6.CRO、SMO(若有)公司营业执照(复印件均加盖单位红章);
7.研究者手册
8.试验方案(申办方/CRO盖章)
9.知情同意书(样表)
10.受试者招募广告及其它提供给受试者的书面文件
11.病例报告表(样表)
12.主要研究者履历及相关文件(包括:执照及职称证、GCP证书、履历)
13.试验药物的相关证明(BE/BA试验包括:受试制剂检验报告、说明书(如
有);参比制剂检验报告、说明书、进口药品批件及通关单(如适用)。
其他试验包括:药验报告等,按批次加盖申办单位红章)
14.试验用药品标签、外包装(注:可以体现药品批号、有效期等)
15.保险声明
16.其他。

附件1 药物临床试验报送资料目录
药物临床试验报送资料目录
附件2 药物临床试验信息简表
药物临床试验信息简表
备注:一式两份
附件3 药物临床试验委托书(样板)
药物临床试验委托书(样板)
依据《中华人民共和国合同法》《药物临床试验质量管理规范》《药品注册管理办法》等法规的有关规定,经双方协商,公司委托延安大学咸阳医院科教授具体负责实施医疗器械(方案名称)的临床试验。
委托单位:
联系人:
(申办方/CRO签字、盖章)
地址:
邮编:
电话:
被委托人:
时间:
(Pl签字)
备注:一式两份。
附件4 药物临床试验立项审议表
临床试验立项审议表
附件5药物临床试验研究团队成员表(仅供参考)
药物临床试验研究团队成员表
备注:
1.人员组成必须有:①临床医师;②病区护土;③药物管理人员;④药代研究人员(如必要);⑤相关科室人员(如必要)。
2.研究团队成员必须经《药物临床试验质量管理规范》培训。
3.临床医务人员必须为本院在职在岗人员。
4.一式两份。
附件6 临床试验文件归档登记表
临床试验文件归档登记表
归档人签名:归档时间:资料管理员签名:时间:
附件7药物临床试验结题签认表。

临床试验需提供资料列表清单药品类一、药品基本信息资料1、药品名称:包括通用名、商品名、化学名。
2、药品成分:列出药品的所有活性成分和非活性成分。
3、药品剂型与规格:说明药品的剂型(如片剂、胶囊、注射剂等)以及各种规格。
4、药品的生产工艺:包括原材料的来源、合成或提取过程、制剂工艺等。
5、药品的质量控制标准:包括各项质量指标的检测方法和限度。
二、药品研发相关资料1、前期研究报告:如药物的筛选、合成路线的确定、药理毒理的初步研究等。
2、药学研究报告:包括处方设计、稳定性研究、溶出度研究等。
3、药理毒理研究报告:涵盖药效学、药代动力学、急性毒性、长期毒性、致畸致癌致突变等试验的研究结果。
三、临床试验方案相关资料1、临床试验方案:详细描述试验的目的、设计、方法、纳入和排除标准、治疗方案、观察指标、随访时间等。
2、知情同意书:向受试者提供的关于试验的详细说明,包括试验的风险和受益,以获取受试者的自愿同意。
3、研究者手册:为研究者提供关于药品的全面信息,包括药品的药理作用、毒理作用、临床前研究结果、用法用量、不良反应等。
四、临床试验机构和研究者相关资料1、临床试验机构的资质证明:如医疗机构执业许可证、伦理委员会批件等。
2、研究者的资质证明:包括医师资格证书、执业证书、培训经历等。
3、研究者的简历和相关经验介绍。
五、药品生产和质量相关资料1、药品生产企业的资质证明:如药品生产许可证、GMP 证书等。
2、药品的生产批件或注册证。
3、药品的检验报告:包括出厂检验报告、抽检报告等。
4、药品的稳定性研究数据:包括长期稳定性和加速稳定性研究结果。
六、安全性相关资料1、药品的不良反应报告:包括已有的临床应用中的不良反应记录,以及动物试验中的不良反应观察结果。
2、风险控制计划:针对可能出现的风险制定的相应控制措施和应急预案。
七、统计学相关资料1、样本量计算依据:说明确定试验所需样本量的方法和依据。
2、统计分析计划:详细描述试验数据的统计分析方法和流程。

药物临床试验递交资料清单项目名称:备注:请在□勾划如“■”提交资料的名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单份)□伦理审查申请书;□国家食品药品监督管理局临床试验批件或注册批件;□临床试验药品及对照药品合格检验报告(某些特殊药品需要中国药品生物制品检定所组织实施的合格质检报告);□申办者资质证明及临床试验药品生产的证书复印件(如果有);□药品说明书;□研究方案及摘要(含版本号:、版本日期:);□知情同意书(含版本号:、版本日期:);□研究者手册(含版本号:、版本日期:);□病例报告表(含版本号:、版本日期:);□临床前研究综述资料;□项目负责人履历;□其他伦理委员会或者管理机构对该临床试验的伦理审查批件;□上市药临床试验须提交申办者的委托函及赠药证明(如果有);□申办者对的委托函(如有);□药物临床研究的申办者与药物临床试验批件的申办者不一致时,提供相关证明文件;□其他资料(如果有:□受试者须知、□受试者日记、□招募广告、□保险声明、□利益冲突的声明等)。
申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日科研项目递交资料清单项目名称:备注:请在□勾划如“■”提交资料的名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单份)1.□伦理审查申请书2.□课题申请书研究方案及摘要(版本号:、版本日期:) 3.□知情同意书(版本号:、版本日期:)4.□病例报告表或流调表量表(版本号:、版本日期:) 5.□课题负责人履历6.□项目负责人及主要研究人员或相关培训证书7.□专业科室人员配备及设备设施情况介绍8.□研究者手册9.□受试者日记卡和或其他问卷表10.□临床前研究综述资料11.□既往其他伦理委员会或管理机构对本科研课题的重要决定12.□招募受试者的材料(版本号:、版本日期:) (申报课题须提供、、、、、项相关资料,已批准课题须提供、、、、、、项相关资料)申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日药物临床试验临床科研伦理审查申请书(初始审查)填写说明一、此表适用于药物临床研究或临床研究项目在我院申请伦理初始审查。

可编辑修改精选全文完整版药物临床试验递交资料清单项目名称:备注:请在□勾划如“■”提交资料的名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单份)□伦理审查申请书;□国家食品药品监督管理局临床试验批件或注册批件;□临床试验药品及对照药品合格检验报告(某些特殊药品需要中国药品生物制品检定所组织实施的合格质检报告);□申办者资质证明及临床试验药品生产的证书复印件(如果有);□药品说明书;□研究方案及摘要(含版本号:、版本日期:);□知情同意书(含版本号:、版本日期:);□研究者手册(含版本号:、版本日期:);□病例报告表(含版本号:、版本日期:);□临床前研究综述资料;□项目负责人履历;□其他伦理委员会或者管理机构对该临床试验的伦理审查批件;□上市药临床试验须提交申办者的委托函及赠药证明(如果有);□申办者对的委托函(如有);□药物临床研究的申办者与药物临床试验批件的申办者不一致时,提供相关证明文件;□其他资料(如果有:□受试者须知、□受试者日记、□招募广告、□保险声明、□利益冲突的声明等)。
申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日科研项目递交资料清单项目名称:备注:请在□勾划如“■”提交资料的名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单份)1.□伦理审查申请书2.□课题申请书研究方案及摘要(版本号:、版本日期:) 3.□知情同意书(版本号:、版本日期:)4.□病例报告表或流调表量表(版本号:、版本日期:) 5.□课题负责人履历6.□项目负责人及主要研究人员或相关培训证书7.□专业科室人员配备及设备设施情况介绍8.□研究者手册9.□受试者日记卡和或其他问卷表10.□临床前研究综述资料11.□既往其他伦理委员会或管理机构对本科研课题的重要决定12.□招募受试者的材料(版本号:、版本日期:) (申报课题须提供、、、、、项相关资料,已批准课题须提供、、、、、、项相关资料)申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日药物临床试验临床科研伦理审查申请书(初始审查)填写说明一、此表适用于药物临床研究或临床研究项目在我院申请伦理初始审查。
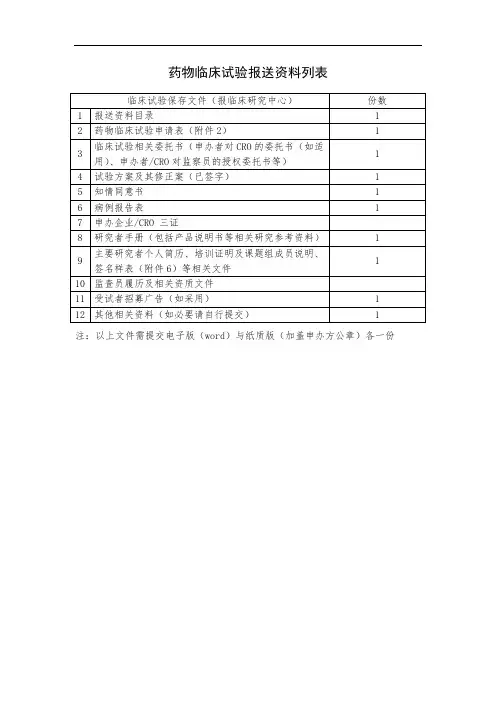
药物临床试验报送资料列表
注:以上文件需提交电子版(word)与纸质版(加盖申办方公章)各一份
药物临床试验申请表
机构受理号:填表日期:年月日
非注册类临床试验声明
本次申请的临床试验项目,其目的不是申请CFDA注册,试验数据不提交CFDA或药监部门,特此声明。
声明人姓名(正楷):
签名:
年月日
临床试验费用支付申请
费用支付说明
范例说明:由于“康柏西普安全性与有效性试验”的四期临床研究项目50例已顺利完成出组,现拟对本研究的检查费(见下表明细)及临床观察费进行结算。
望领导批准并请财务协助办理。
(按需填写,不涉及部分可删除)
项目经办人:
主要研究者:
部门负责人:
主管院领导:
院长:
临床研究中心
年月日
临床科研基金项目进展报告
主要研究者签字:日期:年月日
研究组主要成员
归档人签名:归档时间:管理员签名:时间:
结题证明
我单位与天津医科大学眼科医院于年月日签订的“ ”技术合同,现天津医科大学眼科医院已完全按合同约定全面履行完毕,我单位同意该项目结题,没有任何经济与法律纠纷。
特此证明
单位(公章)
年月日
以下由该项目负责人填写:。

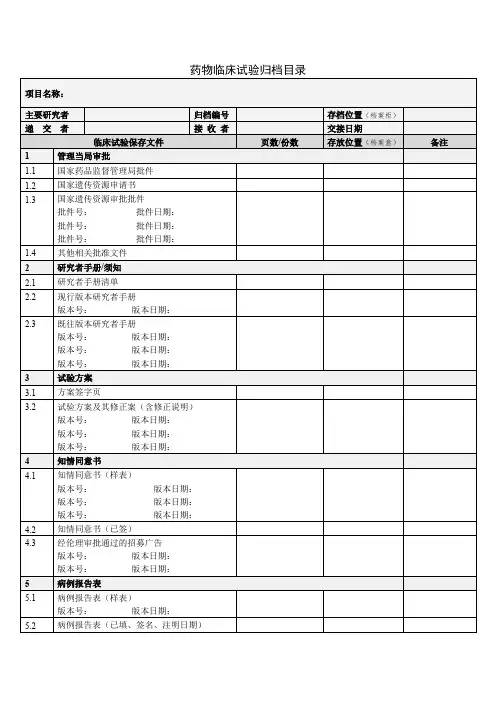
临床试验递送资料目录(药物类别)备注:1.文件夹请使用打孔的硬皮文件夹;2.药品类须提供所有研究者履历(签名)及所有成员的GCP证书复印件;3.伦理批件:提供组长单位的批件(必要时提供其他参加单位伦理批件);4.按要求注明版本号及日期,所有文件若有英文版本则一并提供中文翻译版本;5.所有材料一式三份,并加盖申办方及CRO红章,超过一页须同时加盖骑缝章。
清单中所列项目请按原顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;6.递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。
落款是主要研究者。
申办方或CRO在空白处盖章。
(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容)7.另有增加的项目请续在最后;8.提供电子版文件一份;9. 受理申请表只需递交一份。
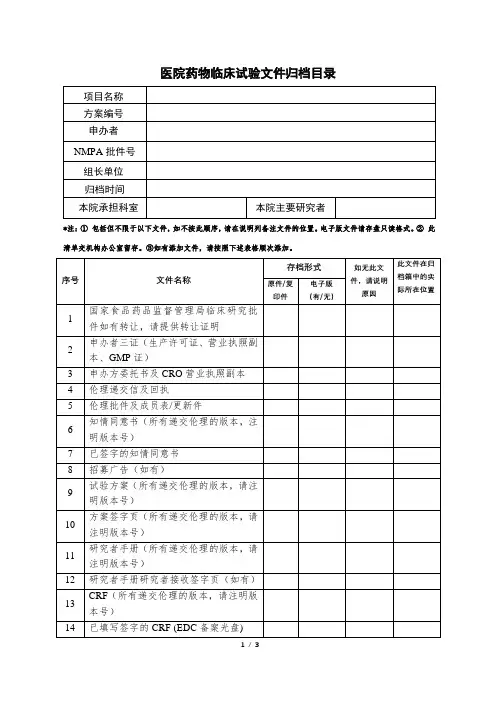
临床试验递送资料目录(器械及诊断试剂类别)资料递交说明:1.文件夹请使用打孔的硬皮文件夹;2.伦理批件:提供其他参加单位伦理批件;3.按要求注明版本号;所有文件若有英文版本则一并提供中文翻译版本;4.所有材料一式三份,并加盖申办方及CRO红章,清单中所列项目请按原顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;5另有增加的项目请续在最后;6递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。
落款是主要研究者。
申办方或CRO在空白处盖章。
(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容);7.提供电子版文件一份;8.立项申请表只需递交一份。
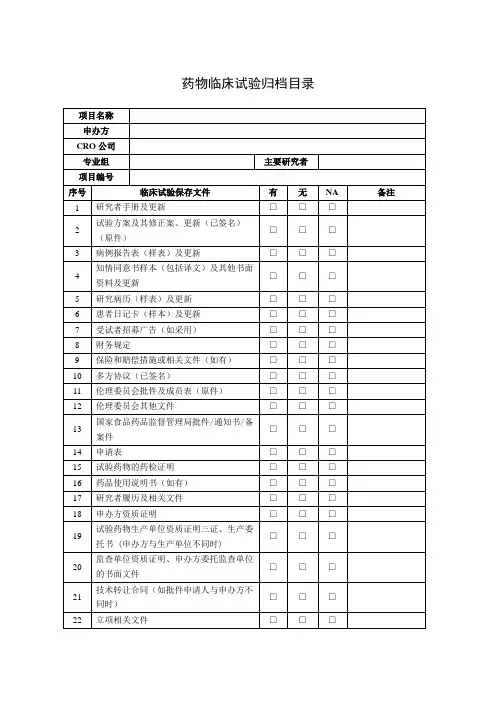
临床试验递送资料目录(药物类别)
备注:
1.文件夹请使用打孔的硬皮文件夹;
2.药品类须提供所有研究者履历(签名)及所有成员的GCP证书复印件;
3.伦理批件:提供组长单位的批件(必要时提供其他参加单位伦理批件);
4.按要求注明版本号及日期,所有文件若有英文版本则一并提供中文翻译版本;
5.所有材料一式三份,并加盖申办方及CRO红章,超过一页须同时加盖骑缝章。
清单中所列项目请按原
顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;
6.递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。
落款是主要研究者。
申办方或CRO
在空白处盖章。
(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容)
7.另有增加的项目请续在最后;
8.提供电子版文件一份;
9. 受理申请表只需递交一份。
临床试验递送资料目录(器械及诊断试剂类别)
资料递交说明:1.文件夹请使用打孔的硬皮文件夹;2.伦理批件:提供其他参加单位伦理批件;3.按要求注明版本号;所有文件若有英文版本则一并提供中文翻译版本;4.所有材料一式三份,并加盖申办方及CRO红章,清单中所列项目请按原顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;5另有增加的项目请续在最后;6递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。
落款是主要研究者。
申办方或CRO在空白处盖章。
(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容);7.提供电子版文件一份;8.立项申请表只需递交一份。