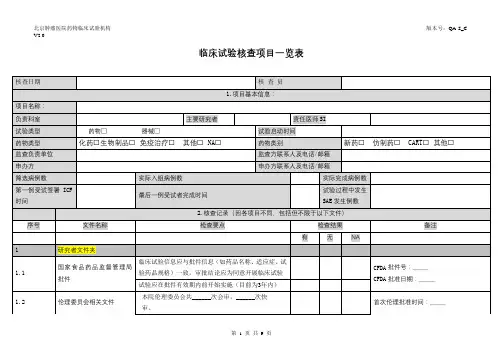
临床试验核查项目一览表【模板】
- 格式:docx
- 大小:33.41 KB
- 文档页数:9


附件415.(2.5.P.)临床试验信息汇总表本套格式申报资料主要适用于以药动学参数为终点评价指标的生物等效性试验资料的申报。
对于需要进行临床试验的特殊制剂等,信息汇总表应参照注册分类3的格式撰写。
基于目前的认识制定本套格式申报资料,可根据化合物的性质和试验特点做适当优化和补充。
须按时间顺序提交所进行的每项生物等效性试验的相关信息。
应以下级目录形式逐个研究项目填写“生物等效性试验信息汇总表”(“如2.5.P.1空腹生物等效性试验;2.5.P.2餐后生物等效性试验”),共用内容集中填写于首个试验项目中,其余项目参见首个试验,并注明标题编号。
2.5.P.1 XX药的空腹生物等效性试验表1(注:依次编号,下同):基本信息表xx:试验药物信息表xx: 处方信息(举例)应提交所有规格的处方信息表xx:体外溶出试验概要精选资料,欢迎下载应提交受试制剂和参比制剂所有规格的溶出试验结果。
精选资料,欢迎下载表xx: 试验设计表xx: 试验报告及生物样品储存信息*: 长期保存稳定性研究应在保存温度范围的上限条件下进行表xx: 完成生物等效性试验的受试者信息(举例)表xx:不良事件发生率统计(举例)表xx: 受试者退出试验情况* 应说明退出时间、所在给药组(受试制剂或参比制剂),退出原因(如果退出原因不是个人原因)等。
表xx: 方案偏离情况表xx: 试验结果表xx:调整评价标准的生物等效性试验数据汇总表(若适用)*经对数转化后的药动学参数表xx:生物样品分析方法学验证结果(举例)上述信息表格请按每个待测物分别提交。
表xx:生物样品分析的标准曲线和质控数据概要*(举例)*如果有多个待测物,应分别提交上述表格表xx :试验样品重复测定情况*重复计算:指样品重复测定后,采用复测值进行计算的情况。
表xx:餐后生物等效性试验中试验餐的组成表xx:浓度数据汇总表(适用于采用体内药代法进行的生物等效性试验)(代码的定义详见后续表格)a)受试制剂组的药物浓度精选资料,欢迎下载精选资料,欢迎下载b)参比制剂组的药物浓度精选资料,欢迎下载精选资料,欢迎下载表xx:药动学参数汇总表(表格中代码的定义详见后续表格)(举例)a)受试制剂药动学参数精选资料,欢迎下载*达峰时间T max的统计值以中位数表示。
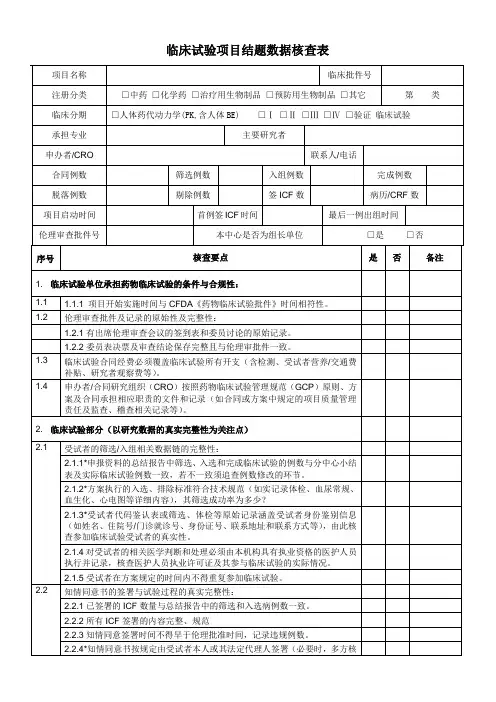

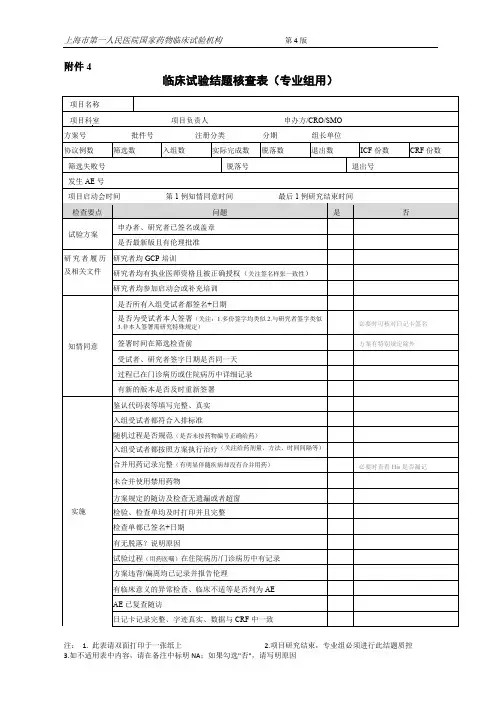
药物临床试验数据核查表(浙大一院)药物名称:注册分类:申办者及联系方式:CRO 及联系方式:含各方在临床试验项目中职责落实)1.1* 临床试验单位承担药物临床试验的条件与合规性:1.1.1 临床试验须在具有药物临床试验机构资格的医院内进行 (含具有一次性临床试验机构资格认定的批件),落实临床试验条件是否支持试验项目实际的实施过程。
1.1.2 具有合法的《药物临床试验批件》。
1.1.3 核对项目开始实施时间与国家食品药品监督管理总局《药物临床试验批件》时间相符性。
1.2 伦理审查批件及记录的原始性及完整性:1.2.1 试验过程的所有伦理审查活动,包括初始审查、加快审查、持续审查等。
1.2.2 核对伦理审查时相应提交资料的完整性。
1.3 临床试验合同经费必须覆盖临床试验所有开支(含检测、受试者营养/交通费补贴、研究者观察费等)。
1.4 申办者/合同研究组织(CRO)按照药物临床试验管理规范(GCP) 原则、方案及合同承担相应职责的文件和记录(如合同或者方案中规定的项目质量管理责任及监查、稽查相关记录等)。
以研究数据的真实完整性为关注点)2.1 受试者的筛选/入组相关数据链的完整性:2.1.1*申报资料的总结报告中筛选、入选和完成临床试验的例数与分中心小结表及实际临床试验例数一致,若不一致须追查例数修改的环节。
2.1.2*方案执行的入选、排除标准符合技术规范(如实记录体检、血尿常规、血生化、心电图等详细内容),其筛选成功率为多少?(含有证据的初筛受试者例数)。
2.1.3*受试者代码鉴认表或者筛选、体检等原始记录涵盖受试者身份鉴别信息(如姓名、住院号/门诊就诊号、身份证号、联系地址和联系方式等),由此核查参加临床试验受试者的真实性。
2.1.4 对受试者的相关医学判断和处理必须由本机构具有执业资格的医护人员执行并记录,核查医护人员执业许可证及其参与临床试验的实际情况。
2.2 2.3 2.1.5 受试者在方案规定的时间内不得重复参加临床试验。

医疗器械临床试验核查项目汇总表XX年医疗器械临床试验核查项目汇总表试验用医疗备案号器械名称器械类别试验用医疗临床试验名称临床试验机构同时注明代理人)申办者吉林省中医药科学院第一临床医院吉林省赛凯生物技术有限公司β-葡聚糖液体敷料境内Ⅱ类β-葡聚糖液体敷料治疗急慢性鼻炎临床试验吉林邦安宝医用设备有限公司β-葡聚糖阴道灌洗液β-葡聚糖阴道灌洗液长春中医药大学附属医院治疗细菌性阴道炎、外境内Ⅱ类阴阴道假丝酵母菌病吉林省中医药科学院临床试验第一临床医院β-葡聚糖液体敷料治疗生殖器疱疹的临床试验长春中医药大学附属医院吉林省中医药科学院第一临床医院吉林邦安宝医用设备有限公司β-葡聚糖液体敷料境内Ⅱ类吉林邦安宝医用设备有限公司1脂蛋白相关磷脂脂蛋白相关磷脂酶A2北华大学第一附属医酶A2活性测定院境内Ⅱ类活性测定试剂盒试剂盒(速率法)临床吉林市人民医院(速率法) 试验长春恒晓生物科技有限责任公司中性粒细胞载脂蛋白检测试剂盒中性粒细胞载脂蛋白检测试剂盒视黄醇结合蛋白测定试剂盒中性粒细胞载脂蛋白境内Ⅱ类检测试剂盒临床试验中国人民解放军第二零八医院长春博德生物技术有限公司中性粒细胞载脂蛋白境内Ⅱ类检测试剂盒临床试验吉林大学第一医院长春博德生物技术有限公司中国人民解放军第视黄醇结合蛋白测定吉林普阳医用科技医院境内Ⅱ类试剂盒临床试验葛洲坝集团中心医院中国人民解放军第血清淀粉样蛋白A测吉林普阳医用科技医院境内Ⅱ类定试剂盒临床试验葛洲坝集团中心医院血清淀粉样蛋白A测定试剂盒2中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒境内Ⅱ类抗环瓜氨酸肽抗体测定试剂盒胱抑素C测定试剂盒中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒临床试验中国人民解放军第医院葛洲坝集团中心医院吉林普阳医用科技有限公司中国人民解放军第抗环瓜氨酸肽抗体测吉林普阳医用科技医院境内Ⅱ类定试剂盒临床试验葛洲坝集团中心医院中国人民解放军第胱抑素C测定试剂盒吉林普阳医用科技医院境内Ⅱ类临有限公司床试验葛洲坝集团中心医院β2微球蛋白测β2微球蛋白测定试剂定试剂盒α1-微球蛋白测定试剂盒境内Ⅱ类盒葛洲坝集团中心医院临床试验α1-微球蛋白测定试剂盒临床试验中国人民解放军第医院葛洲坝集团中心医院。

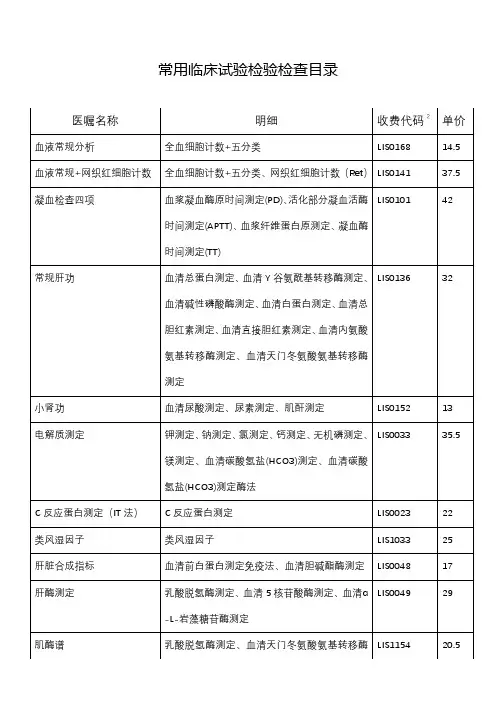
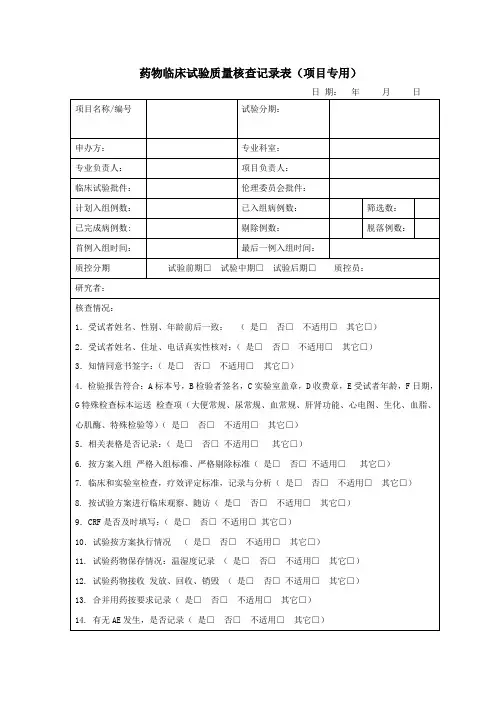
药物临床试验检查内容表药物临床试验是指在受控环境中对新药物进行安全性和有效性评价并确定最佳用药方案的过程。
临床试验需要一系列检查来评估患者的身体状况,确保试验的可靠性和患者的安全。
以下是药物临床试验中常见的检查内容表。
基本信息试验的基本信息需要在受试者入组之前记录:•患者的基本情况,如姓名、年龄、性别、身高、体重等;•疾病的诊断情况和病程;•患者的用药史和过敏史;•患者是否接受其他试验项目;•患者是否有心理和认知障碍,是否需要翻译或口译。
生命体征检查生命体征检查是用来评估患者的身体状况, includes:•血压、脉搏、呼吸等生命体征;•体温;•血液生化检查,包括血糖、血脂、肝肾功能等指标。
疾病诊断与评估为确保受试者符合试验入组标准,还需要进行诊断和评估:•完整的疾病史记录;•确认疾病的诊断和严重程度;•检测疾病相关的生物标志物,如血清学检查、肿瘤标志物等。
身体状况评估对于不同的药物临床试验,需要进行不同的身体状况评估:•心血管系统评估:包括心电图、超声心动图等检查;•呼吸系统评估:包括肺功能测试、肺部影像学检查等;•皮肤评估:包括皮肤过敏性反应等;•肝功能评估:包括肝功能检查等;•肾功能评估:包括肾功能检查等。
药物代谢与排泄评估药物代谢与排泄评估是通过了解药物在人体中的代谢和排泄情况,评估药物的安全性和有效性:•药物代谢酶的基因多态性检测;•药物代谢酶和药物转运蛋白的酶活性检测;•尿液和粪便中药物代谢产物的检测。
不良反应记录药物临床试验需要记录患者在试验过程中的不良反应和不良事件,以评估药物的安全性和可耐受性。
常见的不良反应包括:•恶心、呕吐、腹泻等消化系统反应;•皮肤过敏、荨麻疹、药疹等皮肤反应;•头痛、头晕、失眠等神经系统反应;•血清学反应等。
药物临床试验的检查内容多种多样,根据不同药物的特性和试验的特殊要求而有所不同。
不过,无论是何种试验,都需要对受试者进行全方位的身体评估和检查,以确保试验的安全和可靠性。
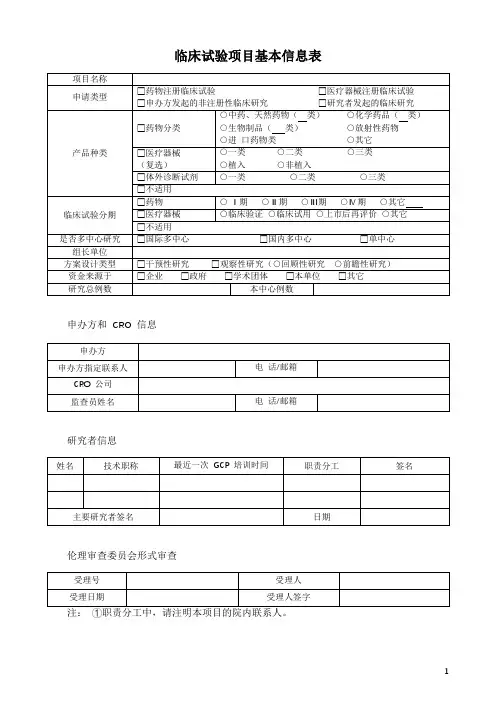
临床试验项目质控检查表
1. 项目基本信息
2. 准备阶段保存文件
文件目录参考GCP法规;研究者空格部分不强制要求;适用于项目启动前;研究文件保存于研究团队,必要时在机构备案,项目结束时均保存于机构办公室
3. 研究者
4. 受试者
5. 知情同意
6. 原始资料填写
7. 病例报告表
8. 试验用药物
9. CRA和CRC
10. 不良事件(AE)与严重不良事件(SAE)管理
备注:
1、检查不只限于表中内容,项目运行中出现任何问题都可以记载于该表中,且须详细记载。
2、医疗器械临床试验质量检查参照药物临床试验进行。
临床试验项目质控检查表
11. 项目基本信息。