第二章 材料的晶体结构
- 格式:ppt
- 大小:3.81 MB
- 文档页数:1

材料科学基础第2章材料中的晶体结构晶体是由原子、离子或分子按照一定的规则排列而成的固体。
晶体结构是指晶体中原子,离子或分子的排列方式。
晶体结构的特点是重复性和周期性。
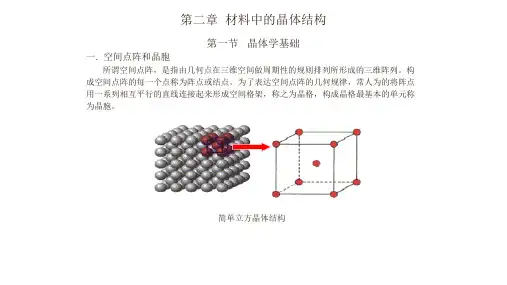
晶体结构可以通过晶体的晶胞来描述,晶胞是晶体中最小重复单元,是由若干个原子,离子或分子组成的。
晶体结构的分类可以根据晶体的对称性进行。
常见的晶体结构类型有立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系、六角晶系和三角晶系。
立方晶系是最常见的晶体结构类型,它具有最高的对称性。
立方晶系包括体心立方晶体、面心立方晶体和简单立方晶体。
体心立方晶体每个晶胞中有一个原子位于立方体的中心,面心立方晶体每个晶胞中有一个原子位于每个立方体的面心,简单立方晶体每个晶胞中只有一个原子。
四方晶系的晶体中,晶胞的底面为矩形,其中一个边与底面垂直。
正交晶系的晶胞基本上和四方晶系相似,但它的底面为正方形。
单斜晶系的晶胞有一个倾斜的边,它是在不同轴上分别有两面成直角。
三斜晶系的晶体是最复杂的结构类型,它的晶胞没有任何对称性。
六角晶系的晶体结构可以看作是体心立方晶体和单斜晶体的组合,晶胞为底面呈六角形的棱柱。
三角晶系的晶体结构最特殊,晶胞为三角形。
晶体结构的研究对于材料科学非常重要。
通过了解晶体结构,我们可以预测和解释材料的物理性质,如硬度、热膨胀系数和电导率等。
晶体结构还对材料的合成和制备起到了指导作用。
例如,通过改变晶体结构,可以改变材料的性质,如增加或减少导电性。
总之,材料中的晶体结构是材料科学基础中的重要内容。
了解晶体结构有助于我们理解材料的性质和行为,并为材料设计和合成提供基础。
晶体结构的研究对于材料科学的发展非常重要,并在材料的合成和制备中起到了指导作用。








材料化学导论第2章-完美晶体的结构第2章完美晶体的结构绝⼤多数材料以固体形态使⽤。
因此研究固体的结构⼗分重要。
固体可以划分为如下种类:⽆定形体和玻璃体[固体中原⼦排列近程有序、远程⽆序](Amorphous and Glassy)固体(Solid states) 完美晶体[原⼦在三维空间排列⽆限延伸(Perfect crystals)有序,并有严格周期性]晶体(Crystals)缺陷晶体[固体中原⼦排列有易位、错(Defect crystals)位以及本体组成以外的杂质] 由于晶体结构是固体结构描述的基础,我们在本章中描述完美晶体的结构,下⼀章则讲授缺陷晶体的结构。
§2.1 晶体的宏观特征和微观结构特点§2.1.1晶体的宏观特征晶体的宏观特征主要有四点:1.规则的⼏何形状所有晶体均具有⾃发地形成封闭的⼏何多⾯体外形能⼒的性质。
规则的⼏何多⾯体外形表明晶体内部结构是规则的。
当然晶体的外形由于受外界条件的影响,往往同⼀晶体物质的各种不同样品的外形可能不完全⼀样。
因此,晶体的外形不是晶体品种的特征因素。
例如,我们⼤家熟知的⾷盐晶体在正常结晶条件下呈⽴⽅晶体外形,当在含有尿素的母液中结晶时,则呈现出削取顶⾓的⽴⽅体甚或⼋⾯体外形。
2.晶⾯⾓守恒在适当条件下晶体能⾃发地围成⼀个凸多⾯体形的单晶体。
围成这样⼀个多⾯体的⾯称作晶⾯。
实验测试表明,同⼀晶体物质的各种不同样品中,相对应的各晶⾯之间的夹⾓保持恒定,称作晶⾯⾓守恒。
例如,⽯英晶体根据结晶条件不同,可有各种⼏何外形,但对应晶⾯之间的夹⾓却是不变。
晶体的晶⾯相对⼤⼩和外形都是不重要的,重要的是晶⾯的相对⽅向。
所以,可以采⽤晶⾯法线的取向表征晶⾯的⽅位,⽽共顶点的晶⾯法线的夹⾓表⽰晶⾯之间的夹⾓。
3.有固定的熔点晶体熔化过程是晶体长程序解体的过程。
破坏长程序所需的能量就是熔化热。
所以晶体具有特定的熔点。
反之,也说明晶体内部结构的规则性是长程有序的。

第二章晶体结构内容提要大多数无机材料为晶态材料,其质点的排列具有周期性和规则性。
不同的晶体,其质点间结合力的本质不同,质点在三维空间的排列方式不同,使得晶体的微观结构各异,反映在宏观性质上,不同晶体具有截然不同的性质。
1912年以后,由于X射线晶体衍射实验的成功,不仅使晶体微观结构的测定成为现实,而且在晶体结构与晶体性质之间相互关系的研究领域中,取得了巨大的进展。
许多科学家,如鲍林(Pauling)、哥希密特(Goldschmidt)、查哈里阿生(Zachariason)等在这一领域作出了巨大的贡献,本章所述内容很多是他们研究的结晶。
要描述晶体的微观结构,需要具备结晶学和晶体化学方面的基本知识。
本章从微观层次出发,介绍结晶学的基本知识和晶体化学基本原理,以奠定描述晶体中质点空间排列的理论基础;通过讨论有代表性的无机单质、化合物和硅酸盐晶体结构,以掌握与无机材料有关的各种典型晶体结构类型,建立理想无机晶体中质点空间排列的立体图像,进一步理解晶体的组成-结构-性质之间的相互关系及其制约规律,为认识和了解实际材料结构以及材料设计、开发和应用提供必要的科学基础。
2.1 晶体化学基本原理由于天然的硅酸盐矿物和人工制备的无机材料制品及其所用的原料大多数是离子晶体,所以在这一节主要讨论离子晶体的晶体化学原理。
一、晶体中键的性质(键性的判别)过去的教学中,以电子云的重要情况讨论键型。
Na-Cl认为是典型的离子键。
硅酸盐晶体中比较典型的结合键方式:Si-O Al-O M e-O (M代表许多碱、碱土金属)Me-O、Al—O键通常认为是比较典型的离子键,而Si-O键中Si-O键离子键、共价键成分相当。
为了方便,通常也认为是离子键。
那么键的成分是如何确定的?即通常如何判断键的类型呢?Pauling通过大量的研究发现,可以根据各元素的电负性差别判断键的类型(由于电负性反映元素粒子得失电子的能力)。
元素电子的电负性x=元素电子的电离能力I+元素原子的电子亲和能E。