高三复习海水的综合利用讲解
- 格式:ppt
- 大小:254.50 KB
- 文档页数:30




第二节海水的综合利用一、教材分析海水的综合利用是高中化学教材《选修2》第二单元课题2的内容,通过介绍海水资源的综合利用的情况,将蒸馏、蒸发、过滤、萃取等实验方法应用于海水资源的开发中,在做实验中,增强学生的感性认识,感受实验方法的实际用途。
在学习从海水中获取资源的同时,重温了粗盐提纯、离子反应、电解原理、等知识点,通过家庭自制消毒器使学生学以致用,对所学知识再加工。
不仅是让学生认识和感受化学知识在开发利用自然资源的重要作用,化学研究和应用在科技进步中的价值,而且对于学生总结复习已学习过的知识十分重要。
学习本节内容一方面从学科角度,有利于学生以了解认识海水资源开发利用为载体,将之前所学知识复习、梳理、归纳和拓展。
另一方面从科学、技术和社会相互作用背景的角度,有利于学生加深体会应用化学知识可开发海水资源,为人类生存和社会发展提供必要的物质和能源基础,同时学会辩证地看待人类和自然协调发展中可能会遇到的问题,走可持续发展道路,树立资源保护意识及合理开发意识。
二、学情分析本节内容紧紧联系着必修1、必修2、及选修4《电解池》这些内容,因为学生的基础比较薄弱,所学习过的知识记忆不强,因此,我在设计时依据学生的实际适当复习了以前的知识,并将目标设定为两个:一是知道盐田的形成条件、组成部分及晒盐过程,二是能够判断电解饱和食盐水装置的阴阳极和电极反应类型,并正确书写电极反应方程式。
同时,本节教学信息量需求很大,并且海水资源利用设计工业领域,学生对此内容很少有感性认识,因此信息呈现方式宜采用多样化,需要从网络获取信息及多媒体资源。
【三维目标】1、知识与技能:(1)知道从海水资源的特点,了解海水资源开发和利用的前景。
(2)了解氯碱工业反应原理;正确书写电极反应方程式和电解的总化学方程式。
(3)常识性介绍以氯碱工业为基础的化工生产。
(4)初步培养解决问题的能力、自主查阅资料的能力和信息素养。
(5)了解盐田的形成条件、组成部分及晒盐过程2、过程与方法:(1)通过数据列表、图片、视频等多种形式的内容展现过程,认识海水资源的特点以及水资源和化学资源的获取方法及化学原理,从感性认识上升到理性认识。



【高中化学】高中化学知识点:海水资源的综合利用海水资源的综合利用:浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。
可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。
目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断冷却,氯化钠等盐结晶划出。
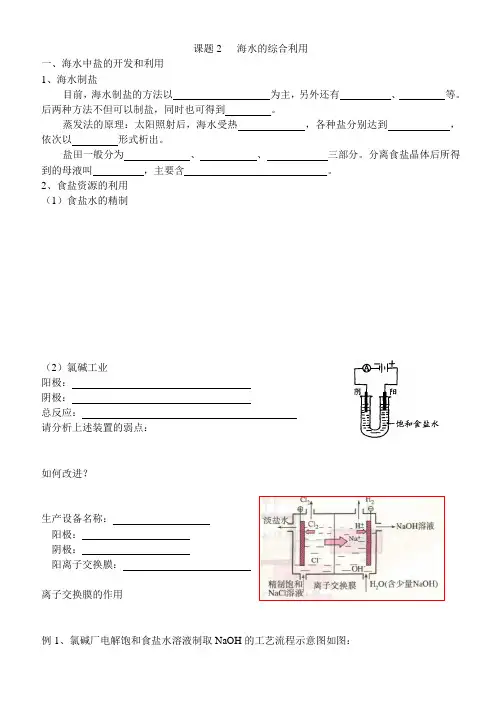
(3)海水晒盐的流程氯碱工业:(1)食盐水的精制(2)电极反应阴极:阳极:总反应::(3)主要设备色谱法膜电解槽一一阳极用金属钛(表面涂抹存有钛、绑氧化物层)做成,阴极用碳钢(覆有镍镀层)做成。
阳离子膜具备挑选借由性,只容许na+借由,而cl-、oh一和气体无法借由。
(4)产品及用途烧碱:可以用作造纸、玻璃、肥皂等工业氯气:可用于制农药、有机合成、氯化物的合成氢气:可以用作金属炼钢、有机合成、盐酸的制备海水提溴:(1)氯化氯化氧化溴离子,在ph=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹起出来当海水中的br一被氧化成br2以后,用空气将其吹出。
另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)稀释目前比较多的是用二氧化硫作还原剂,使溴单质转化为hbr,再用氯气将其氧化得到溴产品。
化学方程式如下:海水加镁:(1)工艺流程(2)主要化学反应①制备石灰乳:②结晶③制备从海水中抽取重水:提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。
常用方法:化学交换法(硫化氢一水双温交换法)铀和重水目前就是核能研发中的关键原料,从海水中抽取铀和重水对一个国家来说具备战略意义,化学在研发海洋药物方面也将充分发挥越来越小的促进作用。
潮汐能、波浪能也就是越来越受到重视的新型能源。

课题2 海水的综合利用一、海水中盐的开发和利用1、海水制盐目前,海水制盐的方法以为主,另外还有、等。
后两种方法不但可以制盐,同时也可得到。
蒸发法的原理:太阳照射后,海水受热,各种盐分别达到,依次以形式析出。
盐田一般分为、、三部分。
分离食盐晶体后所得到的母液叫,主要含。
2、食盐资源的利用(1)食盐水的精制(2)氯碱工业阳极:阴极:总反应:请分析上述装置的弱点:如何改进?生产设备名称:阳极:阴极:阳离子交换膜:离子交换膜的作用例1、氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如图:依据图,完成下列填空:(1)粗盐中含有的较多的可溶性杂质(氯化镁、氯化钙、硫酸钠等)和。
(2)工业食盐含有较多杂质,精制过程中加NaOH的作用是。
(3)在电解过程中,与电源正极相连的电极上所发生的反应为。
与电源负极相连的电极附近,溶液的pH .(填“升高”、“不变”、“降低”)(4)粗盐中硫酸钠含量较高,必须添加钡试剂除去硫酸根离子,该钡试剂可以是A.Ba(OH)2 B.Ba(NO3)2C.BaCl2(5)为了有效地除去氯化镁、氯化钙、硫酸钠,加入试剂的合理顺序为A.先加入NaOH,后加入Na2CO3,再加入钡试剂B.先加入NaOH,后加入钡试剂,再加入Na2CO3C.先加入钡试剂,后加入NaOH,再加入Na2CO3D.先加入钡试剂,后加入Na2CO3,再加入NaOH(6)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过(填写操作名称)、冷却、过滤除去NaCl.(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,Cl2和NaOH溶液充分接触,产物是NaClO和氯化钠和水,请写出Cl2和NaOH溶液反应的化学方程式。
※海水中提取化学物质的一般方法二、海水提溴——法基本流程:1、氯化氯化之前要将海水,原因是。
氯化反应:2、吹出用或将溴吹出。
3、吸收用还原剂使溴单质变为HBr,再用将其氧化成溴产品。


2021-2022学年高一化学期末复习重点专题突破专题16 海水资源的综合利用方法探究一、海水的淡化1.海水淡化的方法通过从海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
海水淡化的方法有蒸馏法(最先使用,技术成熟,但成本高)、电渗析法(成本低,但未能大量生产)、离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)。
2.海水的整理(1)原理(2)注意事项①烧瓶需垫石棉网加热。
②烧瓶所盛液体不能超过烧瓶容量的23,也不能少于13。
③需向烧瓶中加几粒沸石或几片碎瓷片,以防液体暴沸。
④冷凝器里的冷却水要从冷凝器的下口进、上口出。
二、海水化学资源的开发利用1.海带中碘的提取与检验海水中碘的浓度很低,碘一般从海带或海藻等植物中提取。
使I−变成单质碘,可供选择的常见氧化剂有Cl2和H2O2。
单质碘用苯或四氯化碳萃取,分液后用蒸馏的方法将碘和有机溶剂分开。
2.海水提溴的方法3.海水提镁的方法典例剖析例1 空气吹出法是工业规模海水提溴的常用方法,流程如下:浓缩海水−−−−−→氯气①粗产品溴−−−−−−−→通空气和水蒸气②溴蒸气−−−−−−→③二氧化硫物质X−−−−−→氯气④产品溴下列说法错误的是A.①中发生的主要反应为Cl2+2Br-=Br2+2Cl-B.物质X为HBrOC.②③的目的是富集溴元素D.空气吹出法利用了溴易挥发的性质【答案】B【解析】浓缩海水中通入氯气将溴离子置换成溴单质,再通入空气和水蒸气将溴形成蒸汽,用二氧化硫吸收生成HBr和H2SO4,HBr再与氯气生成溴单质。
A.浓缩海水中通入氯气将溴离子置换成溴单质,发生反应为Cl2+2Br-=Br2+2Cl-,故A正确;B.溴与二氧化硫反应生成HBr和H2SO4,所以物质X为HBr和H2SO4,故B错误;C.②通入空气和水蒸气将溴形成蒸汽,与③二氧化硫反应,目的是富集溴元素,故C正确;D.溴易挥发,空气吹出法利用了溴易挥发的性质形成溴蒸汽再被二氧化硫吸收,故D正确;故答案为B。