海水的综合利用归纳
- 格式:doc
- 大小:1.86 MB
- 文档页数:4

证对市爱幕阳光实验学校铁路高三化学复习:第二章课题2 海水的综合利用一.海水中盐的利用——氯碱工业(1)设备:离子交换膜电解槽。
离子交换膜只允许Na+通过。
(2)化学反阴极:2H++2e-===H2↑(复原反)阳极:2Cl--2e-===Cl2↑(氧化反)化学方程式:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
(3)粗盐的精制①目的:除去泥沙,使Ca2+、Mg2+、Fe3+、SO42-离子的含量到达要求。
②原因:Ca2+、Mg2+在碱溶液中形成的沉淀及泥沙会破坏离子交换膜,而SO42-会引入杂质。
③试剂:BaCl2、Ca(OH)2、Na2CO3、稀盐酸。
用BaCl2除去SO42-,用Ca(OH)2除去Mg2+、Fe3+,用Na2CO3除去Ba2+及Ca2+,所加沉淀剂稍过量。
④工艺流程在进入电解槽前需通过离子交换树脂进一步除去Ca2+、Mg2+离子,以防破坏离子交换膜。
⑤有关反方程式Ba2++SO42- ===BaSO4↓,Mg2++2OH-===Mg(OH)2↓,Fe3++3OH-===Fe(OH)3↓,Ca2++CO32-===CaCO3↓,Ba2++CO32- ===BaCO3↓,CO32-+2H+===H 2O +CO2↑。
二.海水提溴(1)工艺流程(2)反原理Cl2+2NaBr===2NaCl+Br23Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑三.海水提镁(1)工艺流程(2)主要化学反①制备石灰乳:CaCO 3CaO+CO2↑CaO+H2O===Ca(OH)2②沉淀Mg2+:Mg2++Ca(OH)2===Mg(OH)2↓+Ca2+③制备MgCl2:Mg(OH)2+2HCl===MgCl2+2H2O④电解MgCl2:MgCl2(熔融) Mg+Cl2↑(3)生产中用的平衡原理①沉淀溶解平衡原理a.向海水中参加沉淀剂Ca(OH)2,由于c(OH-)增大,Mg(OH)2的溶解度小于Ca(OH)2,那么最大程度地将Mg2+转化为Mg(OH)2沉淀。






【高中化学】高中化学知识点:海水资源的综合利用海水资源的综合利用:浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。
可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。
目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断冷却,氯化钠等盐结晶划出。
(3)海水晒盐的流程氯碱工业:(1)食盐水的精制(2)电极反应阴极:阳极:总反应::(3)主要设备色谱法膜电解槽一一阳极用金属钛(表面涂抹存有钛、绑氧化物层)做成,阴极用碳钢(覆有镍镀层)做成。
阳离子膜具备挑选借由性,只容许na+借由,而cl-、oh一和气体无法借由。
(4)产品及用途烧碱:可以用作造纸、玻璃、肥皂等工业氯气:可用于制农药、有机合成、氯化物的合成氢气:可以用作金属炼钢、有机合成、盐酸的制备海水提溴:(1)氯化氯化氧化溴离子,在ph=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹起出来当海水中的br一被氧化成br2以后,用空气将其吹出。
另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)稀释目前比较多的是用二氧化硫作还原剂,使溴单质转化为hbr,再用氯气将其氧化得到溴产品。
化学方程式如下:海水加镁:(1)工艺流程(2)主要化学反应①制备石灰乳:②结晶③制备从海水中抽取重水:提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。
常用方法:化学交换法(硫化氢一水双温交换法)铀和重水目前就是核能研发中的关键原料,从海水中抽取铀和重水对一个国家来说具备战略意义,化学在研发海洋药物方面也将充分发挥越来越小的促进作用。
潮汐能、波浪能也就是越来越受到重视的新型能源。

利用海水的例子利用海水是一种重要的资源,可以用于多个方面,以下是符合题目要求的十个例子:1. 海水淡化:海水淡化是将海水转化为可饮用水或农业用水的过程。
通过蒸发和冷凝,可以去除海水中的盐分和杂质,从而得到淡水资源。
2. 海洋能利用:海水中蕴含着丰富的能量,可以通过潮汐能、海流能和波浪能等方式进行利用。
这种能源的开发可以为人类提供清洁、可再生的能源替代品。
3. 海水浴疗:海水中富含多种矿物质和微量元素,对皮肤有保湿、滋养和抗菌的作用。
因此,海水浴疗被广泛用于皮肤疾病的治疗和保养。
4. 海水养殖:海水中的盐分和矿物质对于某些动植物的生长和发育具有促进作用。
因此,海水养殖被用于养殖海产品,如海带、海藻、贝类等。
5. 海水药物开发:海洋中的生物资源具有很高的药用价值,海水中的微生物和海洋植物可以提供多种天然药物和化学物质,用于治疗各种疾病。
6. 海水热能:海水中的温度差异可以用来产生热能。
通过利用海水和深海水的温差,可以发电、供暖和制冷等。
7. 海水运输:海水可以用作交通运输的媒介。
水上运输是一种环保、高效的运输方式,可以大量减少陆地运输的能源消耗和环境污染。
8. 海水体育活动:海水提供了各种水上运动和娱乐活动的场所,如游泳、冲浪、帆船运动等。
这些活动不仅锻炼身体,还能带来乐趣和放松。
9. 海水环境保护:海水是一种宝贵的生态环境,需要得到保护和管理。
海洋环境保护可以保护海洋生物多样性,维护海洋生态平衡。
10. 海水文化传承:海洋是人类文化的重要组成部分,海水和海洋生物在艺术、文学、音乐和传统民俗中扮演着重要角色。
通过传承和弘扬海洋文化,可以丰富人们的生活和思维方式。
以上是利用海水的十个例子,这些例子展示了海水在人类生活和发展中的重要作用,同时也提醒我们要合理利用和保护海水资源。


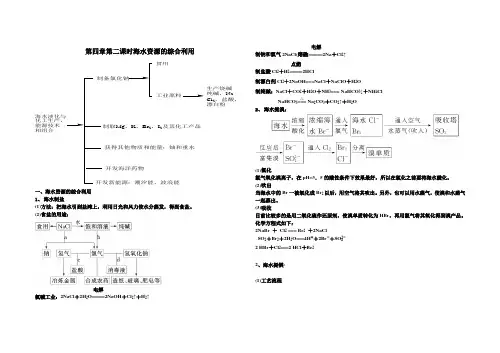
第四章第二课时海水资源的综合利用海水淡化与化工生产,能源技术相组合制备氯化钠食用工业原料生产烧碱纯碱,Na Cl 2,盐酸,漂白粉制取Mg ,K ,Br 2,I 2及其化工产品获得其他物质和能量:铀和重水开发海洋药物开发新能源:潮汐能,波浪能一、海水资源的综合利用1、 海水制盐(1)方法:把海水引到盐滩上,利用日光和风力使水分蒸发,得到食盐。
(2)食盐的用途:氯碱工业:2NaCl +2H 2O=====电解2NaOH +Cl 2↑+H 2↑制钠和氯气2NaCl(熔融)=====电解2Na +Cl 2↑ 制盐酸Cl 2+H 2=====点燃2HCl制漂白剂Cl 2+2NaOH===NaCl +NaClO +H 2O制纯碱:NaCl +CO 2+H 2O +NH 3=== NaHCO 3↓+NH 4Cl NaHCO 3=== Na 2CO 3+CO 2↑+H 2O2、 海水提溴:(1)氯化氯气氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出当海水中的Br 一被氧化成Br 2以后,用空气将其吹出。
另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr ,再用氯气将其氧化得到溴产品。
化学方程式如下:2NaBr + Cl 2 === Br 2 +2NaClSO 2+Br 2+2H 2O===4H ++2Br -+SO 2-42 HBr +Cl 2===2 HCl +Br 2 2、海水提镁: (1)工艺流程△(2)主要化学反应①制备石灰乳:CaCO 3 === CaO + CO 2 ↑ ,CaO + H 2O === Ca(OH)2 ②沉淀Mg 2+: MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2③制备MgCl 2:Mg(OH)2+2HCl===MgCl 2+2H 2O, MgCl 2·6H 2O=====HClMgCl 2+6H 2O 制备Mg: MgCl 2(熔融)=====电解Mg +Cl 2↑3、海水提碘(1)工业海带中提碘1)流程:海带―→浸泡―→氧化―→过滤―→提纯―→碘单质 2)主要反应的原理:Cl 2+2KI===2KCl +I 2 (2)海带中含有碘元素的检验1)主要反应的原理:H ++2I -+H 2O 2===I 2+2H 2O二、侯氏制碱法NaCl +CO 2+H 2O +NH 3=== NaHCO 3↓+NH 4ClNaHCO 3=== Na 2CO 3+CO 2↑+H 2O 物质分离的几种方法:定义:物质的分离是指通过适当的方法,把混合物中的几种物质分开(要还原成原来的形式),分别得到几种比较纯净的物质。
海水的综合利用归纳
南靖一中沈建忠2010、09、15
海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、碘、锶等。
海水资源包括:能量、生物、化学、矿物、及空间资源。
利用潮汐能量发电,各种化学物质被综合利用,海水还是人类未来重要的淡水来源、新的能源和人类的空间资源。
问题1:海水的综合利用有哪些方面?(1)海水的直接利用;(2)海水的淡化;(3)制
盐和以盐为原料的盐化工;(4)提取海水中溶存的有用元素。
一、海水中水资源的利用——获取淡水
1、途径:通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2、海水淡化的方法及其特点:海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
原理:蒸溜法分离海水;优点:蒸馏法的历史最久,技术和工艺也比较完善;
缺点:成本较高,难推广应用。
二、海水中的化学资源
1、特点:种类多、总储量大、富集程度低
含80多种元素,以氢、氧、氯、钠、镁、硫、钙、钾等较多。
被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。
氘有50亿吨足够人类用上千万年
2、从海水中提取物质的方法
(1)从海水中提取食盐
如何制盐?NaCl、海水晒盐
A 、粗盐的成份及精制:a 、粗盐:含较多的氯化镁和氯化钙及泥沙b 、提纯实验步骤:溶解、过滤、结晶。
(请说说:过滤操作的要点;玻璃棒的使用;结晶操作要点;)c 、请设计实验室除去NaCl 中混有的Ca 2+、Mg 2+离子的方法(需要仪器及实验步骤):
(答案:溶解,加稍过量的氢氧化钙,再加入稍过量的碳酸钠溶液,过滤;在滤液中加入稍过量的盐酸,蒸发结晶。
)
B 、海水晒盐后的“卤水”中还有哪些盐含量较高?
氯化镁 碘化钾 溴化钾 (2)海水提取镁
试剂①溶液Mg(OH)2
沉淀
试剂②MgCl 2溶液Mg
无水MgCl 2熔融电解(1)Ca(OH)2
(2)过滤
(3)盐酸
(4)MgCl 2(熔融)电解Mg + Cl 2 ↑
海水
(含Mg 2+)
过量
(3)、海带中提取碘的实验 原理: I - —— I 2 检验I 2: 用淀粉溶液检验,看它
是否变蓝。
问题3:怎样分离溶液与不溶物,操作时应注意些什么? 答案:
过滤,操作时注意:一贴二低三靠。
海带提碘:
海带海带灰溶解过滤灼烧
残渣
含I -的溶液
稀H 2SO 4
H 2O 2
含I 2的溶液含I 2的有机溶液
萃取加H 2O 2溶液变褐色,加淀粉变蓝。
现象:2KI +H 2O 2+H 2SO 4= I 2+2H 2O+K 2SO 4
(4)、空气吹出法制溴的实验设计问题4:海水里有大量的Br -,工业上需用Br 2,实现
该转化的原理是什么?
原理:在实际生产Br 2中,过程比较复杂,请设计
制溴的步骤(根据书第91页资料卡片,用
框图表示步骤,标出每步所加的物质)写出
相关的化学反应方程式.
讨论2:Br -Br 2
加氧化剂2NaBr +Cl 2 === B r 2+2NaCl
化学方程式:
在自然资源的开发利用过程中,化学技术、方法
起到关键作用。
结论:步骤:
浓缩海水
产品溴
HBr 溴水通入Cl 2
加SO 2通入空气和水蒸气通入Cl 2
问题5:在溴、碘的开发过程中,化学方法、技术起了
重要作用,对其他自然资源的开发也是如此吗?
2HBr +Cl 2=== Br 2+2HCl
Br 2+SO 2+2H 2O === 2HBr +H 2SO 4
三 海水综合利用
海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。
如从海水中制得的氯化钠除食用外,还用作工业原料,如生产烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等含氯化工产品。
从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。
例如,铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义。
化学在开发海洋药物方面也将发挥越来越大的作用。
潮汐能、波浪能等也是越来越受到重视和开发的新型能源。
四、从海水中提取重水:硫化氢——水双温交换法
H 2O(l)+HDS(g)=HDO(l)+H 2S(g)
重水熔点为3.8℃,沸点是101.4℃,比重是1.1,比普通水重10%,盐类在重水中的溶解度很小,溶液的导电性也非常低,具有吸水的本领,对生物体有麻痹作用。
图4-5 海水综合利用联合工业体系一例
课堂检测:
1、海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称
①③。
写出过程②中有关反应的离子方程式:。
(2)提取碘③过程中,可用的有机试剂是。
A.酒精
B.四氯化碳
C.苯
D.乙酸
(3)③过程后得到含碘的有机溶液,可用把碘和有机溶剂分离开来。
(分离方法)2、海水的综合利用可以制备金属镁,其流程如下图所示:
(1)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式__________________;用电解法制取金属镁时,需要无水氯化镁。
在干燥的氯化氢气流中加热MgCl2·6H2O时,能得到无水氯化镁。
(2)Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:________________________________________;
过滤时:________________________________________;
蒸发时:______________________________________。