人类遗传资源项目自查表
- 格式:docx
- 大小:10.57 KB
- 文档页数:2
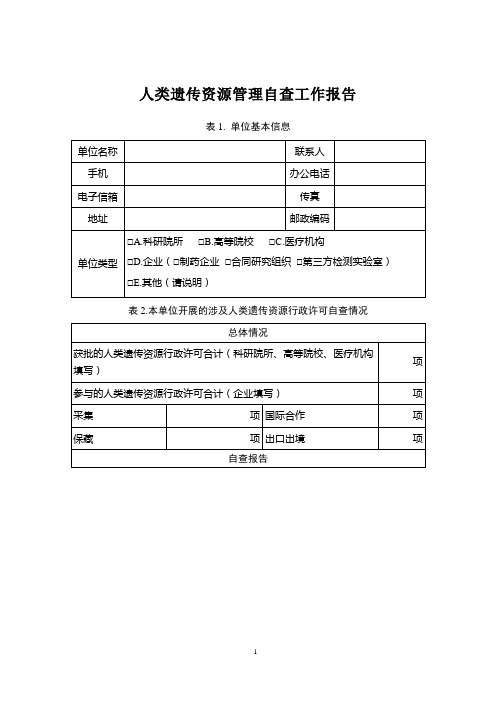


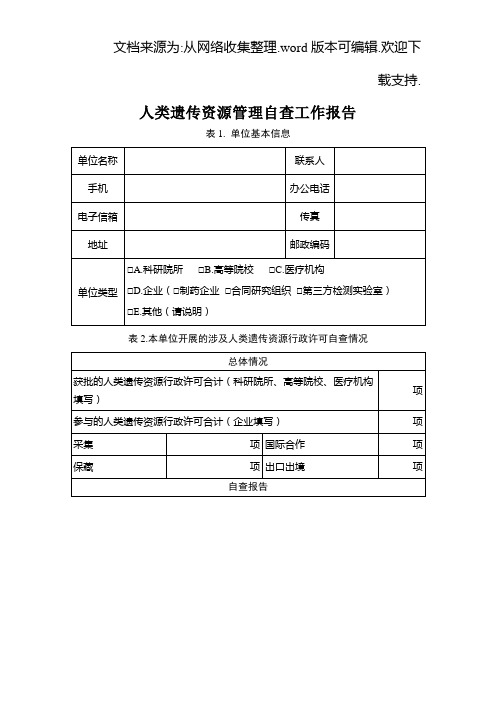

附件人类遗传资源管理自查工作报告(格式)表1.单位基本信息单位联系手机办公电子传真地址邮政单位类型□A.科研院所□B.高等院校□C.医疗机构□D.企业□E.其他(请说明)表2.1999年以来本单位开展的涉及人类遗传资源的国际合作项目自查情况项目数汇总1999年以来本单位开展的涉及人类遗传资源的国际合作项目合计项其中:涉及人类遗传资源出境的项目项向中国人类遗传资源管理办公室申报的项目项获中国人类遗传资源管理办公室批准的项目项项目基本信息(填写附表1)自查结果综述1.本单位在开展人类遗传资源国际合作项目的过程中,贯彻落实《人类遗传资源管理暂行办法》(国办发[1998]36号)以及《科技部关于进一步加强人类遗传资源管理工作的通知》(国科发社〔2013〕615号)的基本情况(是否严格按规定办理报批手续、是否存在人类遗传资源违法违规出境行为、已经获批的项目是否严格按照批准的内容和范围开展活动)2.存在问题及分析(人类遗传资源国际合作项目自查过程中发现的主要问题,分析造成问题的主要原因)3.开展人类遗传资源国际合作项目取得的成果(说明开展人类遗传资源国际合作项目取得的成果及经验,对本单位能力建设、人才培养、学科发展等方面产生的影响)4.下一步整改措施(针对自查过程中发现的问题,提出切实有效的具体整改措施)—1—表3.本单位人类遗传资源管理制度自查情况管理机构及制度本单位是否设立专门的人类遗传资源管理机构/部门□A.是□B.否(选否则跳过下三项)该机构/部门成立的时间年月该机构/部门的名称该机构/部门工作人员人数(含兼职)人,其中博士人,硕士人,学士人,大专人,其它人本单位是否具备人类遗传资源材料采集、收集、保藏、使用等方面的相关管理规章或制度□A.是□B.否(选否则跳过下一项)本单位制定的人类遗传资源采集、收集、保藏、使用管理规章或制度列表请填写附表2本单位采集、收集或保藏的人类遗传资源是否可供其他内资单位(国内高校、科研院所、内资医院机构和企业等)使用□A.是□B.否(选否则跳过下两项)其他内资单位使用本单位采集、收集或保藏的人类遗传资源是否需要经过单位内部审批□A.是□B.否(选否则跳过下一项)对内资单位使用本单位人类遗传资源进行内部审批的人员及机构/部门(可多选)□A.本单位专门的人类遗传资源管理机构/部门□B.本单位负责人类遗传资源收集或保藏的技术部门□C.持有相关人类遗传资源的课题组/科室及其负责人□D.单位具体主管领导□E.其他(请说明)本单位采集、收集或保藏的人类遗传资源是否可供境外单位□A.是□B.否(选否则跳过下两项)—2—或境内外资单位使用境外单位或境内外资单位使用本单位采集、收集或保藏的人类遗传资源是否需要经过单位内部审批□A.是□B.否(选否则跳过下一项)对境外单位或境内外资单位使用本单位人类遗传资源进行内部审批的人员及机构/部门(可多选)□A.本单位专门的人类遗传资源管理机构/部门□B.本单位负责人类遗传资源收集或保藏的技术部门□C.持有相关人类遗传资源的课题组/科室及其负责人□D.单位具体主管领导□E.其他(请说明)伦理审查及知情同意本单位是否针对涉及人的生物医学研究成立专门的伦理委员会□A.是□B.否(选否跳过下三项)该伦理委员会的成立时间年月日该伦理委员会的名称该伦理委员会的委员组成总人数人其中本单位委员人其中外单位委员人本单位人员开展人类遗传资源的采集、收集、保藏和研究开发活动是否需要经该伦理委员会审查□A.是□B.否(选否跳过下一项)该伦理委员会对人类遗传资源采集、收集、保藏和研究开发活动进行审查的主要依据是(可多选)□A.相关的国际伦理准则□B.本单位自行制定的伦理审查办法/规范□C.国内有关部门制定的伦理审查办法/规范□D.其他(请说明)本单位开展人类遗传资源材料采集、收集、保藏和研究开发□A.是□B.否(选否跳过下一项)—3—活动时,是否提前获得材料提供者的同意本单位收集、保藏或使用的每一份人类遗传资源材料是否都□A.是□B.否配有材料提供者签署的知情同意书填表单位(公章):单位负责人(签章):年月日—4—附表1 1999年以来本单位获得中国人类遗传资源管理办公室批准的项目清单序号项目名称批准时间(年月)执行期限(年月)出境人类遗传材料情况批准出境遗传材料实际已出境遗传材料材料名称数量及单位材料名称数量及单位1 XXXXX XX年X月XX年X月-XX年X月XXXXXXXXX管,X ml/管XX份,X mg/份XXXXXXXXX管,X ml/管XX份,X mg/份注:1.本单位1999年以来获批的人类遗传资源国际合作项目均需填写,本页不够可续页;表中所填文字为示例,具体填写以实际情况为准。
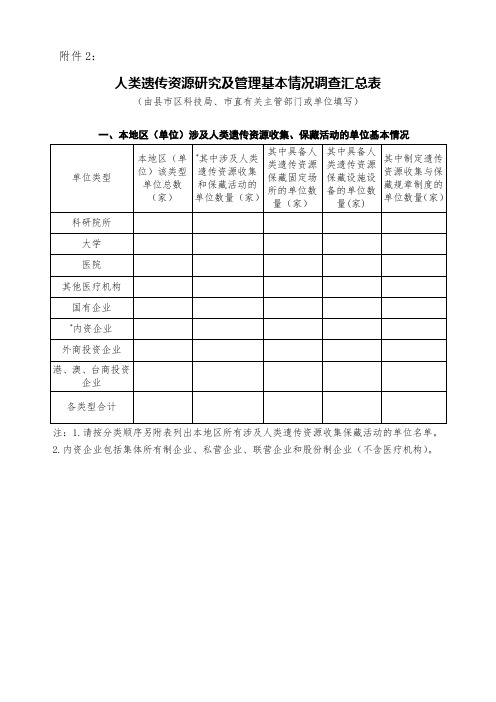
附件2:人类遗传资源研究及管理基本情况调查汇总表(由县市区科技局、市直有关主管部门或单位填写)一、本地区(单位)涉及人类遗传资源收集、保藏活动的单位基本情况单位类型本地区(单位)该类型单位总数(家)*其中涉及人类遗传资源收集和保藏活动的单位数量(家)其中具备人类遗传资源保藏固定场所的单位数量(家)其中具备人类遗传资源保藏设施设备的单位数量(家)其中制定遗传资源收集与保藏规章制度的单位数量(家)科研院所大学医院其他医疗机构国有企业*内资企业外商投资企业港、澳、台商投资企业各类型合计注:1.请按分类顺序另附表列出本地区所有涉及人类遗传资源收集保藏活动的单位名单。
2.内资企业包括集体所有制企业、私营企业、联营企业和股份制企业(不含医疗机构)。
二、本地区(单位)保藏的人类遗传资源材料的基本情况本地区(单位)保藏有健康人群遗传资源材料的单位总计家本地区(单位)保藏有重要遗传家系遗传资源材料的单位总计家本地区(单位)保藏的健康人群遗传资源材料情况序号遗传材料名称数量(人份)备注本地区(单位)保藏的疾病人群遗传资源材料情况序号遗传材料名称数量(人份)备注本地区(单位)保藏的重要遗传家系遗传资源材料情况序号遗传材料名称数量(人份)家系名称家系所在地遗传特征遗传度本地区(单位)保藏的特定地区人群遗传资源材料情况序号遗传材料名称数量(人份)人群类别人群所在地所属民族注:1.请根据本地区(单位)保藏的人类遗传资源材料的实际情况进行填写,空格不够请加行。
2.遗传材料名称中请填写具体样本类型,包括但不限于体液样本如血液、唾液、关节腔液,胸水;组织样本如手术切除物;细胞样本如血细胞、脱落细胞、头发、指甲、体液离心沉渣、拭子采集物;排泄物如尿、粪便、痰液;核酸样本如DNA、RNA等。
3.重要遗传家系遗传资源是指重大遗传性疾病或特定体质特征发生在家族式的(2代及以上)、有血缘关系的群体的遗传资源,如长寿人群家系、脊柱发育不全家系等。
附件2:人类遗传资源研究及管理基本情况调查表(由科研院所、大专院校、医疗机构和企业等填报)一、单位基本信息二、本单位人类遗传资源材料收集、保藏的基本条件生地,居住地,吸烟饮酒等生活习惯),既往史,疾病史等。
三、本单位保藏的人类遗传资源材料的基本情况注:1.请根据本单位保藏的人类遗传资源材料的实际情况进行填写,空格不够请加行。
2.遗传材料名称中请填写具体样本类型,包括但不限于体液样本如血液、唾液、关节腔液,胸水;组织样本如手术切除物;细胞样本如血细胞、脱落细胞、头发、指甲、体液离心沉渣、拭子采集物;排泄物如尿、粪便、痰液;核酸样本如DNA、RNA等。
3.重要遗传家系遗传资源是指重大遗传性疾病或特定体质特征发生在家族式的(2代及以上)、有血缘关系的群体的遗传资源,如长寿人群家系、脊柱发育不全家系等。
4.特定地区人群遗传资源是指特殊环境下长期生活,并且在体质特征或生理特征方面有适应性性状发生的人群遗传资源,如隔离人群(海岛人群、陆岛人群)、少数民族聚居群体等。
四、2011年以来本单位承担的涉及人类遗传资源的科研项目列表注:1.项目来源(可多选):A.国家科技计划 B.国家自然科学基金 C.临床试验D.国外科研机构2.是否涉及国际合作: A.是 B.否3.2011年以来本单位承担的所有涉及人类遗传资源的项目均需填写,空格不够可加行。
五、2011年以来本单位在涉及人类遗传资源的科研项目中取得的成果汇总表六、2011年以来本单位在涉及人类遗传资源的科研项目中获得的奖励列表注:仅填写2011年以来本单位在涉及人类遗传资源的科研项目中获得的国家级奖励、省部级奖励以及国外相关科技奖励,空格不够可加行。
七、2011年以来本单位在涉及人类遗传资源的科研项目专利列表需填写,空格不够可加行。
九、2011年以来外单位使用本单位人类遗传资源材料获得的成果汇总十、本单位伦理委员会组建情况十一、成绩及经验总结十二、存在问题及改进措施十三、意见和建议填表单位(公章):单位负责人(签章):年月日。
人类遗传资源申报资料审核表
研究名称:
申办方:
立项号/备案号:
本研究组长单位为,计划在中国约家中心。
目前计划在中国医科大学附属盛京专业开展,主要研究者。
一、研究在本单位的进展信息:
二、遗传资源审批申请书信息:
三、申请所需的与本单位相关的文件:
四、主要研究者承诺:
关于人类遗传资源采集、保藏、国际合作、出境审批
申办方承诺书
本公司郑重承诺:
一、申办方委托中国医科大学附属盛京医院开展
临床研究。
二、严格按照国务院《中华人民共和国人类遗传资源管理条例》、中国人类遗传资源国际合作科学研究的行政许可决定开展相关工作。
包括但不限于人类遗传资源材料的种类、数量、检测分析的内容、转运方式、剩余样本和数据信息处理方式等。
三、在该临床研究中,送往中心实验室的样本用途是方案要求的检测项目,仅供本研究使用,不得用于其他。
检测方法按中心实验室的标准操作规程进行。
四、涉及出境情况
□是□否
如选“是”,请勾选下列选项
□本研究仅涉及样本的出境
□本研究仅涉及信息数据的出境
□本研究涉及样本与信息数据的出境
五、申报材料全部内容真实、完整、数据信息准确,不存在虚报、瞒报行为。
本单位知晓并充分理解上述承诺内容,若承诺不实或违背承诺,愿意承担相应法律责任。
申办方/授权代表签字:
单位公章:
日期:
临床研究中心办公室审核:
审核人:
日期:。