第六单元碳和碳的氧化物思维导图
- 格式:doc
- 大小:41.50 KB
- 文档页数:1

第六单元 碳和碳的氧化物 知识结构图 金刚石:硬度大,自然界最硬的物质(切割玻璃、作钻头)硬度小、 有滑腻感、 能导电 物理性质差异大的原因:碳原子排列方式不同C 60: (作铅笔芯) (作润滑剂) (作电极)(1)充分燃烧(氧气充足):C + O 2 == CO 2 (2)不充分燃烧(氧气不足):2C + O 2 == 2COC + 2CuO == 2Cu + CO 2↑(黑色粉末变成红色,澄清石灰水变浑浊) C + Fe 2O 3 == Fe + CO 2↑CO 2 密度比空气密度大CO 2 能溶于水CO 2 不能燃烧,也不支持燃烧CO 2 能与水反应:CO 2 + H 2O == H 2CO 3(H 2CO 3使紫色石蕊溶液变红) H 2CO 3 == CO 2↑+ H 2OCO 2 能与碱溶液反应:CO 2 + C a (O H )2 == CaCO 3↓+ H 2O (澄清石灰水变浑浊)——检验CO 2气体CO 2 + 2NaOH == Na 2CO 3 + H 2O (无现象) ——吸收CO 2气体CO 2 能与碳反应:CO 2 + C == 2CO (吸热) CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O实验装置 发生装置:固液不加热型收集装置:向上排空气法CO 2已收集满CO 2气体2、灭火3、植物光合作用(气体肥料)CO 2 不是空气污染物,CO 2过多会引起“温室效应”2CO + O2 == 2CO 2 (火焰呈蓝色,澄清石灰水变浑浊) 用途:作燃料CO + CuO == Cu + CO 2 (黑色粉末变成红色,澄清石灰水变浑浊) 3CO + Fe 2O 3 == 2Fe + 3CO 2 (红色粉末变成黑色,澄清石灰水变浑浊)CO 极易与血红蛋白结合,使人体缺氧而中毒(煤气中毒的原因)用途:作燃料 用途:冶炼金属 用途:冶炼金属碳和碳的化合物专题复习【复习目标】知识和能力目标:1、二氧化碳和碳酸钠的化学性质及应用。
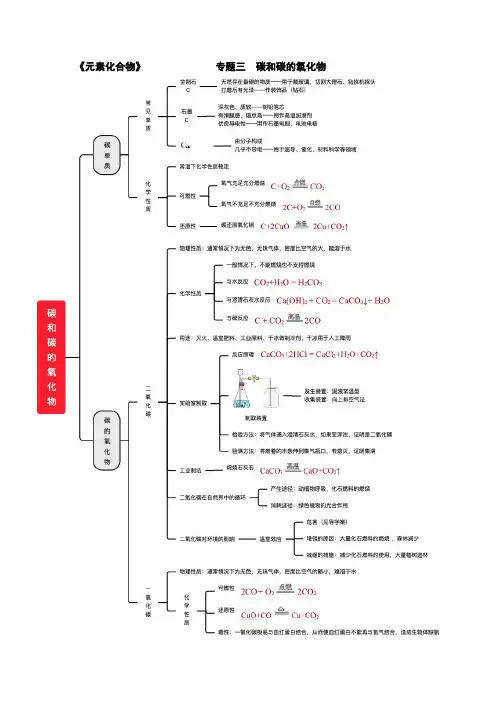
《元素化合物》专题三碳和碳的氧化物一、碳的单质1.碳单质的物理性质比较碳原子构成碳原子构成2.无定形碳①木炭:有疏松多孔结构,具有吸附性,用于除去食品和工业产品里的色素,作冰箱去味剂等。
①活性炭:活性炭的吸附性比木炭强。
用于防毒面具滤毒罐中过滤毒气,制糖工业中白糖脱色,用于净水器、冰箱除味剂,环保活性炭包等。
①焦炭:用于冶炼金属。
①炭黑:制造黑色染料,油墨,油漆等,添加到橡胶里做补强剂,增强耐磨性。
二、碳单质的化学性质1.常温下化学性质不活泼2.可燃性(作燃料)3.还原性实验 注意 事项①火焰加金属网罩的目的:集中火焰,提高温度。
①实验结束后,先撤出导气管,再停止加热的目的:防止石灰水倒流炸裂热的试管。
①待试管冷却后再把试管中的粉末倒出的原因:防止热的铜接触空气又被氧化。
实验装置及现象结论①黑色粉末逐渐变成光亮的红色; ①澄清石灰水变浑浊。
结论:生成了红色的铜和二氧化碳 化学方程式C + 2CuO 2Cu+CO 2↑三、氧化还原反应1.分析2.碳与二氧化碳反应:C + CO 22CO (吸热反应)四、二氧化碳制取的研究 1.工业制二氧化碳煅烧石灰石: CaCO 3高温CaO+CO 2↑ 2.实验室制二氧化碳:(1)药品:块状石灰石(或大理石)和稀盐酸(均为混合物) (2)反应原理:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ (3)检验方法:将制得的气体通入澄清石灰水,若澄清石灰水变浑浊,则证明是二氧化碳。
(4)验满方法:CuO 失去氧元素,有氧化性,是氧化剂,被还原,发生还原反应 C 夺取氧元素,有还原性,是还原剂,被氧化,发生氧化反应用燃着的木条,放在集气瓶口,木条熄灭,证明二氧化碳气体已经收集满。
五、气体制取的一般思路1.发生装置长颈漏斗可随分液漏斗可控注射器可控制控制反应的开始和停止。
开始:打开弹簧夹,液体开始:开始:打开开始:将开始:将2.收集装置选择依据:气体的溶解性;气体的密度注意事项:导管口出现连续气体收集满注意事项:导管伸入集气。
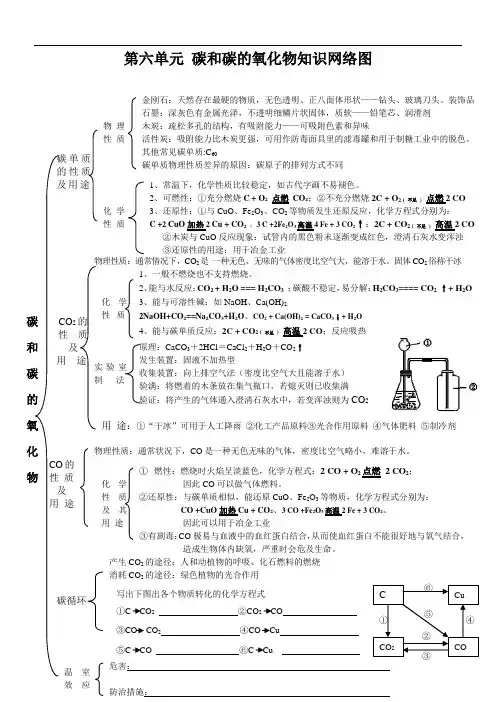
第六单元碳和碳的氧化物知识网络图碳和碳的氧化物碳单质的性质及用途物理性质金刚石:天然存在最硬的物质,无色透明、正八面体形状——钻头、玻璃刀头、装饰品石墨:深灰色有金属光泽,不透明细鳞片状固体,质软——铅笔芯、润滑剂木炭:疏松多孔的结构,有吸附能力——可吸附色素和异味活性炭:吸附能力比木炭更强,可用作防毒面具里的滤毒罐和用于制糖工业中的脱色。
其他常见碳单质:C60碳单质物理性质差异的原因:碳原子的排列方式不同化学性质1、常温下,化学性质比较稳定,如古代字画不易褪色。
2、可燃性:①充分燃烧C + O2点燃CO2;②不充分燃烧2C + O2 ( 不足)点燃2 CO3、还原性:①与CuO、Fe2O3、CO2等物质发生还原反应,化学方程式分别为:C +2 CuO加热2 Cu + CO2;3 C +2Fe2O3高温4 Fe + 3 CO2↑;2C + CO2 ( 不足)高温2 CO②木炭与CuO反应现象:试管内的黑色粉末逐渐变成红色,澄清石灰水变浑浊③还原性的用途:用于冶金工业CO2的性质及用途物理性质:通常情况下,CO2是一种无色、无味的气体密度比空气大,能溶于水。
固体CO2俗称干冰化学性质1、一般不燃烧也不支持燃烧。
2、能与水反应:CO2 + H2O === H2CO3;碳酸不稳定,易分解:H2CO3==== CO2 ↑+ H2O3、能与可溶性碱:如NaOH、Ca(OH)2:2NaOH+CO2==Na2CO3+H2O、CO2 + Ca(OH)2 = CaCO3↓+ H2O4、能与碳单质反应:2C + CO2 ( 不足)高温2 CO;反应吸热实验室制法原理:CaCO3+2HCl=CaCl2+H2O+CO2↑发生装置:固液不加热型收集装置:向上排空气法(密度比空气大且能溶于水)验满:将燃着的木条放在集气瓶口,若熄灭则已收集满验证:将产生的气体通入澄清石灰水中,若变浑浊则为CO2用途:①“干冰”可用于人工降雨②化工产品原料③光合作用原料④气体肥料⑤制冷剂CO的性质及用途物理性质:通常状况下,CO是一种无色无味的气体,密度比空气略小,难溶于水。

碳和碳的氧化物知识网络图-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN碳和碳的氧化物知识网络图碳和碳的氧化物碳单质的性质及用途物理性质金刚石:天然存在的物质,无色透明、正八面体形状——钻头、、装饰品石墨:色有金属光泽,不透明细鳞片状固体,质软——、、润滑剂木炭:的结构,有能力——可吸附色素和异味活性炭:吸附能力比木炭更强,可用作防毒面具里的和用于工业脱色。
化学性质1、常温下,化学性质,如古代字画不易褪色。
2、可燃性:①充分燃烧;②不充分燃烧3、还原性:①与CuO、Fe2O3、CO2等物质发生还原反应,化学方程式分别为:、、②木炭与CuO反应现象:试管内的黑色粉末逐渐变成色,澄清石灰水③还原性的用途:用于工业CO2的性质及用途物理性质:通常情况下,CO2是一种色、味的气体密度比空气,溶于水。
固体CO2俗称化学性质1、一般不燃烧也不支持燃烧。
2、与水反应:;碳酸不稳定,易分解:3、与石灰水反应:4、与碳单质反应:;反应热实验室制法原料:和原理:发生装置:固液不加热型收集装置:法检验:验满:验证:用途:①“干冰”可用于②化工产品原料③光合作用原料④气体肥料⑤CO的性质及用途物理性质:通常状况下,CO是一种色味的气体,密度比空气,溶于水。
化学性质及其用途①可燃性:燃烧时火焰呈色,化学方程式:;因此CO可以做气体燃料。
②还原性:与碳单质相似,能还原CuO化学方程式分别为:实验现象:因此可以用于工业③有剧毒:CO极易与血液中的结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时会危及生命。
碳循环产生CO2的途径:、消耗CO2的途径:写出下图出各个物质转化的化学方程式①②③④⑤⑥C CuCOCO2①②③④⑤⑥。


