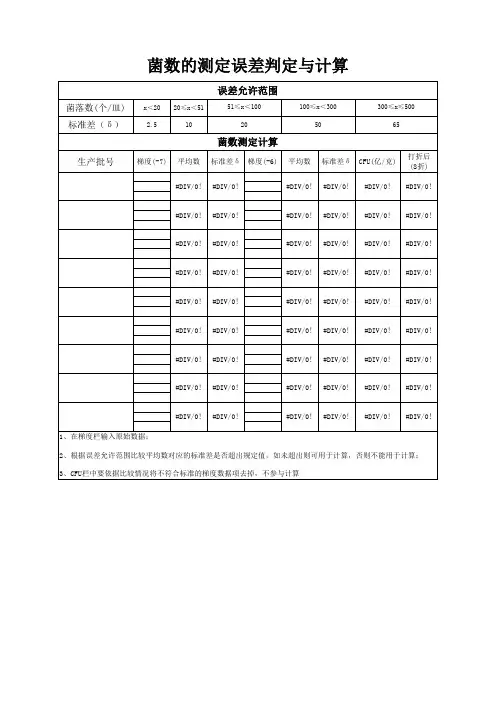
细菌生长曲线误差分析
- 格式:docx
- 大小:12.79 KB
- 文档页数:1

细菌总数监测常见误差分析细菌菌落总数就是水源地与地面废水样品检测必做得一项指标。
菌落总数检测同其她检验一样,也存在检测误差。
平板计数法就是细菌总数常用方法之一, 因此,该值准确与否直接关系水质好坏。
微生物平板计数得通常方法为每个样品用3个稀释度,每个稀释度常做3个重复。
但如何对平板菌落进行正确计数、3个稀释度以哪一个稀释度进行计数及微生物检测允许误差等问题,在饲料标准中并未有所规定,而这些问题与统计值得准确性密切相关。
我们就实际检测芽孢杆菌工作中遇到一些菌落计数得问题,与大家进行探讨。
1材料与方法1.1试验材料1。
1。
1样品:随机抽取微生态饲料添加剂合生素样品3份。
1。
1.2培养基:营养琼脂。
1.1.3仪器设备:磁力搅拌器,无菌培养皿,培养箱,振荡器。
1.2 试验方法1。
2。
1样品得振荡时间对菌数检测得影响选择1个样品,称取10 g,放人无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为l0、20、30、40与60 rain、用1 mL移液枪从中吸取1 mL样品悬浊液加入到盛有9mL去离子水得试管中,用振荡器使样品充分均匀,以此类推,制成10一~1O一’不同稀释度得样品溶液。
平板涂布法检测菌含量:用移液枪从样品稀释液中各吸取200L,每个样品稀释液3个重复;将平板倒置于35—37 cC培养箱中培养24 h。
1.2。
2 检测方法对菌数检测得影响各个样品称取l0 g,放入无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为40 rain。
并稀释成10~~l0 不同稀释度得样品溶液。
倾注平板法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取1 mL,每个样品稀释液3个重复,待培养基表面干燥后,将平板倒置于35 37~(2培养箱中培养24 h、平板涂布法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取200 L涂布平板,每个样品稀释液3个重复;将平板倒置于35~37℃培养箱中培养24h、2结果2.1样品得振荡时间对菌数检测结果得影响采用细菌平板计数得方法,不同振荡时间对合生素中芽孢杆菌检出量得结果见表1。

细菌⽣长曲线的测定的实验步骤细菌⽣长曲线的测定的实验步骤⼀、实验⽬的1. 了解细菌⽣长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种⽅法;3. 反复练习⽆菌操作技术;4. 了解不同细菌,不同接种⽅法在同⼀培养基上⽣长速度的不同;5. 掌握利⽤细菌悬液混浊度间接测定细菌⽣长的⽅法⼆、实验原理将⼀定量的细菌接种在液体培养基内,在⼀定条件下培养,可观察到细菌的⽣长繁殖有⼀定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成⼀条曲线,成为⽣长曲线(如图⼀)。
图⼀微⽣物⽣长曲线⽰意图单细胞微⽣物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(⽣长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
⽣长曲线可表⽰细菌从开始⽣长到死亡的全过程的动态。
不同的微⽣物有不同的⽣长曲线,同⼀种微⽣物在不同的培养条件下,其⽣长曲线也不⼀样。
因此,测定微⽣物的⽣长曲线对于了解和掌握微⽣物的⽣长规律是很有帮助的。
测定微⽣物⽣长曲线的⽅法很多,有⾎球计数板法、平板菌落计数法、称重法和⽐浊法等。
本实验采⽤⽐浊法测定,由于细菌悬液的浓度与混浊度成正⽐,因此,可利⽤分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在⼀定条件下的⽣长曲线。
注意,由于光密度表⽰的是培养液中的总菌数,包括活菌与死菌,因此所测定的⽣长曲线的衰亡期不明显。
从⽣长曲线我们可以算出细胞每分裂⼀次所需要的时间,即代时,以G 表⽰。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、实验仪器、材料和⽤具1.实验材料:⼤肠杆菌,枯草杆菌菌液及平板;2.培养基:⽜⾁膏蛋⽩胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各⼀⽀);培养箱, 摇床,722s分光光度计;4.实验⽤具:⽆菌1000ul吸头80个;⽆菌5000ul吸头2个;⽐⾊⽫9个+共⽤参⽐杯⼀个.四、实验步骤1.准备菌种:将细菌接种到⽜⾁膏蛋⽩胨葡萄糖三⾓瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个⼩组:第(1)⼩组取1.0ml⼤肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml⼤肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml⼤肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)⼩组取⼀个⼤肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml⼤肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml⼤肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)⼩组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养⼀⼩时取样⼀次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶⼦测量发酵9h结束测pH.3.测量:选⽤600nm波长,以蒸馏⽔作为参⽐,开始培养前测定每组培养液的OD值作为起始点。


药品微生物限度检查误差分析及应对措施摘要:为了保障药品质量及安全,相关部门提出了微生物限度检查的方法,只有降低检查误差才能提高检查结果的准确性。
为此,本文重点从培养基导致的误差及应对措施、检品导致的误差及应对措施、菌落计数导致的误差及应对措施、无菌室导致的误差及应对措施等四个不同角度分析药品微生物限度检查工作中的误差并提出相应的解决对策。
关键词:药品;微生物限度检查;误差;应对措施药品主要用于疾病的预防与治疗,关系到人们的生命安全。
因此,还必须加强检查微生物的限度,提高药品质量,保障人们的用药安全。
然而结合实际工作可知,受到检查要求严格、周期长的特点,无法避免检查误差,还需要结合实际情况提出相应的解决对策。
1培养基导致的误差及应对措施微生物限度检查工作中培养基对其产生的检查而言是相当重要的一个环节,其直接对该工作的结果产生影响[1]。
若工作人员没有按照要求做好培养基的存放工作或没有在相应的条件下配置,导致培养基质量稳定性不强,一定程度上也会对微生物限度检查结果产生影响。
为了提高微生物限度检查结果的准确性,还必须加强检测培养基的质量,提高培养基的灵敏度和有效性。
因此,可从以下几个方面解决上述问题:首先,测试酸碱度。
细菌类型不同,其对培养基pH值的要求存在很大的差异,为了对培养基进行测试,了解其是否可以用于药品的微生物检查,还需要加大力度检测培养基的pH值。
若发现pH值达不到标准,可以用氢氧化钠进行调节,提高培养基使用效果。
工作人员在调节工作中应坚持少量多次,避免出现一次添加过量氢氧化钠的问题。
其次,开展已知菌试验。
检验初次购买的培养基时可以用已知菌对照试验的方法做好相关试验,可用酸度计测试其灵敏度,并借助不同类型的阳性菌针对各种培养基作对照试验,立足反应结果对培养基是否可以用于检查药品微生物限度进行确定,从根本上降低检查工作的误差[2]。
最后,制备后及时灭菌。
部分技术人员为了提高灭菌效果通常都是低温灭菌处理全部试验对象。
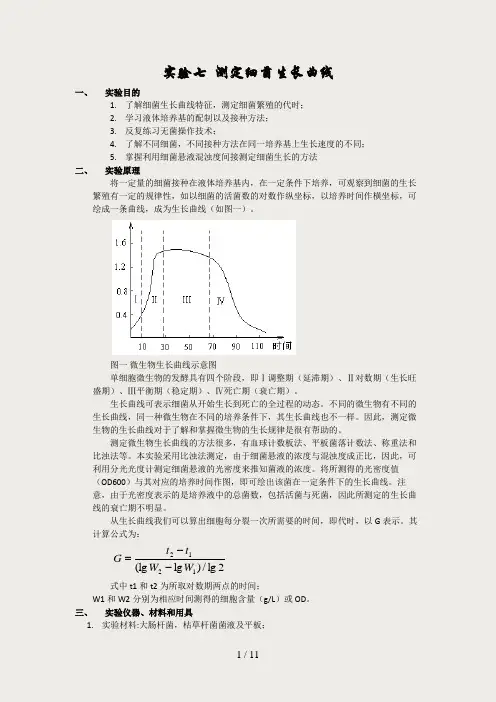
实验七 测定细菌生长曲线一、 实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。

大肠杆菌细胞生长曲线的测定实验难点
大肠杆菌细胞生长曲线的测定实验涉及到多个步骤,其中有几个难点:
1. 培养基的选择:大肠杆菌在不同的培养基条件下生长的情况会有所不同,因此在进行生长曲线实验前需要选择一个合适的培养基。
同时,培养基的质量对实验结果也会有影响,需要注意使用新鲜的培养基。
2. 细胞密度的准确测定:测定生长曲线需要准确地确定细胞数量,但直接计数难度较大。
在实验中常用的方法是通过测量细胞培养液的浓度或浊度来间接估算细胞数。
但这些方法也有一定的局限性,需要严格按照方法操作并进行多次检测。
3. 实验条件的控制:细胞生长曲线的测定需要严格控制温度、湿度、氧气含量等多个生长条件。
如果实验条件不稳定,会导致数据的误差增大。
4. 数据处理的准确性:测量出的生长曲线数据需要经过统计学处理和分析,并进行可靠性检验。
在处理数据的过程中,需要避免人为因素的影响,以保证实验结果的准确性。

细菌生长曲线测定实验方法的研究一、本文概述细菌生长曲线测定实验方法的研究对于深入了解细菌的生长规律、生长环境、生长条件以及生长过程中的代谢变化等方面具有重要意义。
本文旨在探讨细菌生长曲线测定的实验方法,包括实验原理、实验步骤、实验条件的选择与优化等方面,以期为提高细菌生长曲线测定的准确性和可靠性提供理论支持和实践指导。
本文将介绍细菌生长曲线测定的基本原理,包括细菌生长曲线的定义、特点以及影响因素等。
在此基础上,本文将详细阐述细菌生长曲线测定的实验步骤,包括实验材料的准备、实验条件的设置、实验过程的操作以及实验结果的记录与分析等。
本文将重点讨论实验条件的选择与优化。
实验条件是影响细菌生长曲线测定结果的关键因素,包括培养基的成分、温度、pH值、接种量等。
本文将通过对比实验和数据分析,探讨不同实验条件对细菌生长曲线的影响,从而确定最佳的实验条件组合。
本文将总结细菌生长曲线测定实验方法的优缺点,并提出改进意见和建议。
通过本文的研究,将为细菌生长曲线测定的实验方法提供更为准确、可靠的理论支持和实践指导,有助于推动细菌学研究的深入发展。
二、细菌生长曲线的理论基础细菌生长曲线测定实验方法的理论基础主要源自微生物生长动力学。
微生物生长动力学描述了微生物在特定环境下的生长规律,其中包括细菌生长曲线的形成机制。
细菌生长曲线是反映细菌群体生长状态的重要指标,通过对细菌生长曲线的分析,可以了解细菌生长的不同阶段,以及影响细菌生长的各种因素。
细菌生长曲线通常可分为四个主要阶段:延迟期、对数生长期、稳定期和衰亡期。
在延迟期,细菌适应新的生长环境,进行必要的代谢准备,此阶段细菌数量增长缓慢。
进入对数生长期后,细菌以指数方式迅速增长,这是细菌生长最为旺盛的阶段。
稳定期时,由于营养物质的消耗和代谢产物的积累,细菌增长速率逐渐减缓,细菌数量趋于稳定。
进入衰亡期,细菌由于营养物质的耗尽和代谢产物的毒性作用,生长速率急剧下降,细菌大量死亡。

细菌生长曲线的测定细菌生长曲线的测定是研究细菌生长过程中数量的变化规律的重要实验方法。
通过测定不同时间点上细菌的数量,我们可以了解细菌的繁殖速度、生命周期以及适宜生长环境等信息。
本文将介绍细菌生长曲线的测定步骤,并探讨其在科学研究和实际应用中的指导意义。
首先,测定细菌生长曲线的实验需要准备培养基、平板、试管等实验器材,以及待测的细菌样品。
将培养基倒入平板中,使其均匀地附着在平板表面上。
取一定量的细菌样品,接种在试管中的培养基中,然后将试管放入恒温培养箱中。
在不同时间点上,分别取出试管,通过将样品进行稀释后在平板上接种细菌来测定其数量。
通过计数细菌在平板上形成的菌落数,我们可以得到细菌数量随时间的变化规律。
细菌生长曲线通常可以分为四个阶段:潜伏期、指数期、平稳期和衰亡期。
在潜伏期,细菌数量较低,适生环境适宜时,细菌开始繁殖。
进入指数期后,细菌数量呈指数增长,繁殖速度较快。
在平稳期,细菌数量达到平衡,新生细菌数量与死亡细菌数量相等。
最后,在衰亡期中,细菌数量逐渐减少。
细菌生长曲线的测定对于科学研究和实际应用中有着重要意义。
在科学研究中,通过测定细菌生长曲线可以获得细菌的生命周期信息,了解其生长特性和繁殖机制。
这对于研究细菌的生物学特性、药物敏感性以及探索新的治疗方法具有指导意义。
此外,测定细菌生长曲线还可用于评估食品、水源等环境中的细菌污染情况,为公共卫生和食品安全提供重要依据。
在实际应用中,细菌生长曲线的测定可用于制定细菌培养条件和控制措施。
通过了解细菌的繁殖速度和繁殖条件,我们可以优化培养条件以提高细菌产量,或者通过调节环境因素来控制细菌的滋生。
此外,在药物研发和微生物工程中,测定细菌生长曲线可以评估抗生素对细菌的杀菌效果、药物毒性及其机制,为药物设计和微生物工程提供重要参考。
综上所述,细菌生长曲线的测定是一项生动、全面且具有指导意义的实验方法。
通过测定细菌数量随时间的变化规律,我们可以了解细菌的生长特性、繁殖机制和生命周期等信息。

实验七 测定细菌生长曲线一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2. 培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基,37 ℃200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃110rpm取1.0ml大肠杆菌接种到100ml培养基,30 ℃200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基,37 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,30 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,37 ℃110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。

实验八细菌生长曲线的测定及血球计数板测定微生物生长一、细菌生长曲线的测定及★细菌的生长曲线就是把一定量的菌体细胞接种到恒容积的液体培养基中,在适宜的条件下进行培养,在此过程中,其细胞数目将随培养时间的延续而发生规律性的变化,如以细胞数目的对数值(或O.D.值)为纵坐标,以培养时间为横坐标作一条曲线,即为细菌的生长曲线,它反映了细菌的群体生长规律。
★大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次。
★依据其生长速率的不同,可把细菌的生长曲线划分为延滞期,对数期,稳定期和衰亡期等四个时期。
★微生物OD值是反映菌体生长状态的一个指标,OD是optical delnsity(光密度)的缩写,表示被检测物吸收掉的光密度。
通常400~700nm 都是微生物测定的范围,505nm测菌丝菌体、560nm测酵母、600nm测细菌。
★本实验测定细菌生长曲线的方法是,将待测菌种接入一只大试管的培养液中,在适宜的培养温度和良好的通气状态下,定时取出此试管,在600纳米波长处测定菌液浓度(O.D.值),在一定的范围内,菌液浓度与光密度值成线性关系。
因此,根据菌液的O.D.值可以推知细菌生长繁殖的进程。
将所测得的一组O.D.值与其相应的培养时间作图,即可绘制出该菌的生长曲线。
☆实验操作1、菌种培养:取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液(LB)中,静止培养12--14h,备用。
2、制备LB培养基100ml置于200ml三角瓶内,备用。
3、标记:取11支无菌大试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16和20h。
4、接种:分别用5ml无菌吸管吸取5ml大肠杆菌培养液(培养12~14h)转入盛有100ml LB液的三角瓶内,混合均匀后分别取5ml混合液放入上述标记的11支无菌大试管中。
5、培养:将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定其光密度值。
细菌生长曲线的测定实验报告竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s 分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
实验九测定细菌生长曲线实验九测定细菌生长曲线[实验目的] 1(了解细菌生长曲线特征:2(学习液体培养基的配制以及注意事项。
3(学习液体种子和固体种子的不同接种方法和注意事项。
4(利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1(实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml,250ml 三角瓶X 4瓶,大组),配方:牛肉膏5g,蛋白胨10g,NaCl 5g,葡萄糖10g,加水至1000ml,pH7(5。
2(实验仪器取液器(5000μl,1000μl,200tμl 各一支); 培养箱(摇床,722s分光光度汁; 1000μl 无菌吸头100个;5000μl 无菌吸头2个;1ml或4ml玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内(在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图9 1)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的(测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测OD550或 OD620或OD600或OD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示。
细菌两次生长曲线不一致的原
因
温馨提示:文档内容仅供参考
细菌的生长曲线通常由四个主要阶段组成:潜伏期、指数增长期、稳定期和衰退期。
如果细菌在两次生长过程中表现出不一致的生长曲线,可能有以下原因:
环境条件不同:细菌对环境条件非常敏感,包括温度、pH值、营养物质和氧气水平等。
如果两次实验中的环境条件不同,例如温度或培养基成分不同,细菌的生长曲线可能会受到影响。
初始细菌数量不同:即使环境条件相同,如果两次实验中的初始细菌数量不同,也会导致生长曲线的不一致。
较多的初始细菌数量可能导致更快的指数增长期和更早的稳定期。
细菌菌株变异:细菌菌株之间可能存在遗传变异。
如果两次实验使用的是不同的细菌菌株,它们的生长特性可能会有所不同,导致生长曲线不一致。
技术操作差异:实验操作的技术差异也可能导致生长曲线的不一致。
例如,在培养细菌的过程中,培养基的制备、接种的方法、培养条件的控制等因素都可能对细菌的生长产生影响。
随机性:细菌的生长是一个随机过程,在相同条件下,两次实验的生长曲线可能会有一定的差异。
这是由于微小的随机事件和细菌个体之间的差异所致。
综上所述,细菌两次生长曲线不一致的原因可能是由于环境条件、初始细菌数量、细菌菌株的变异、技术操作差异和生长过程的随机性等多种因素的综合影响。
细菌总数监测常见误差分析细菌菌落总数是水源地和地面废水样品检测必做的一项指标。
菌落总数检测同其他检验一样,也存在检测误差。
平板计数法是细菌总数常用方法之一,因此,该值准确与否直接关系水质好坏。
微生物平板计数的通常方法为每个样品用3个稀释度,每个稀释度常做3个重复。
但如何对平板菌落进行正确计数、3个稀释度以哪一个稀释度进行计数及微生物检测允许误差等问题,在饲料标准中并未有所规定,而这些问题与统计值的准确性密切相关。
我们就实际检测芽孢杆菌工作中遇到一些菌落计数的问题,与大家进行探讨。
1材料与方法1.1试验材料1.1.1样品:随机抽取微生态饲料添加剂合生素样品3份。
1.1.2 培养基:营养琼脂。
1.1.3仪器设备:磁力搅拌器,无菌培养皿,培养箱,振荡器。
1.2 试验方法1.2.1样品的振荡时间对菌数检测的影响选择1个样品,称取10 g,放人无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为l0、20、30、40和60 rain。
用1 mL移液枪从中吸取1 mL 样品悬浊液加入到盛有9 mL去离子水的试管中,用振荡器使样品充分均匀,以此类推,制成10一~1O一’不同稀释度的样品溶液。
平板涂布法检测菌含量:用移液枪从样品稀释液中各吸取200 L,每个样品稀释液3个重复;将平板倒置于35—37 cC培养箱中培养24 h。
1.2.2 检测方法对菌数检测的影响各个样品称取l0 g,放入无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为40 rain。
并稀释成10~~l0 不同稀释度的样品溶液。
倾注平板法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取1 mL,每个样品稀释液3个重复,待培养基表面干燥后,将平板倒置于35 37~(2培养箱中培养24 h。
平板涂布法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取200 L涂布平板,每个样品稀释液3个重复;将平板倒置于35~37℃培养箱中培养24 h。
2结果2.1样品的振荡时间对菌数检测结果的影响采用细菌平板计数的方法,不同振荡时间对合生素中芽孢杆菌检出量的结果见表1。
细菌总数监测常见误差分析细菌菌落总数是水源地和地面废水样品检测必做的一项指标。
菌落总数检测同其他检验一样,也存在检测误差。
平板计数法是细菌总数常用方法之一,因此,该值准确与否直接关系水质好坏。
微生物平板计数的通常方法为每个样品用3个稀释度,每个稀释度常做3个重复。
但如何对平板菌落进行正确计数、3个稀释度以哪一个稀释度进行计数及微生物检测允许误差等问题,在饲料标准中并未有所规定,而这些问题与统计值的准确性密切相关。
我们就实际检测芽孢杆菌工作中遇到一些菌落计数的问题,与大家进行探讨。
1材料与方法1.1试验材料1.1.1样品:随机抽取微生态饲料添加剂合生素样品3份。
1.1.2 培养基:营养琼脂。
1.1.3仪器设备:磁力搅拌器,无菌培养皿,培养箱,振荡器。
1.2 试验方法1.2.1样品的振荡时间对菌数检测的影响选择1个样品,称取10 g,放人无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为l0、20、30、40和60 rain。
用1 mL移液枪从中吸取1 mL样品悬浊液加入到盛有9 mL去离子水的试管中,用振荡器使样品充分均匀,以此类推,制成10一~1O一’不同稀释度的样品溶液。
平板涂布法检测菌含量:用移液枪从样品稀释液中各吸取200 L,每个样品稀释液3个重复;将平板倒置于35—37 cC培养箱中培养24 h。
1.2.2 检测方法对菌数检测的影响各个样品称取l0 g,放入无菌锥形瓶内,加入90 mL无离子水,磁力搅拌分别为40 rain。
并稀释成10~~l0 不同稀释度的样品溶液。
倾注平板法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取1 mL,每个样品稀释液3个重复,待培养基表面干燥后,将平板倒置于35 37~(2培养箱中培养24 h。
平板涂布法检测菌含量:用移液枪从各个平行样品相应稀释液中各吸取200 L涂布平板,每个样品稀释液3个重复;将平板倒置于35~37℃培养箱中培养24 h。
2结果2.1样品的振荡时间对菌数检测结果的影响采用细菌平板计数的方法,不同振荡时间对合生素中芽孢杆菌检出量的结果见表1。
测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。
细菌生长曲线误差分析
细菌生长曲线误差分析主要涉及对实验测量数据与理论模型之间的差异进行评估和解释。
下面是一个详细的细菌生长曲线误差分析的步骤:
数据收集:首先,收集关于细菌生长曲线实验的测量数据。
这些数据可能包括时间点和相应的细菌数量。
理论模型:选择适当的理论模型来描述细菌生长曲线。
常用的模型包括指数增长模型、对数增长模型等。
确保你在分析中使用的模型与你的实验条件和细菌类型相符。
模型拟合:将收集到的数据应用于选定的理论模型,并通过曲线拟合方法来获得最佳拟合曲线。
这可以通过最小二乘法或其他拟合算法来实现。
误差计算:计算实验数据与拟合曲线之间的误差。
最常见的误差度量是残差,即实际观测值与模型预测值之间的差异。
统计分析:使用适当的统计方法对误差进行分析。
可以计算平均误差、标准偏差和置信区间等指标,以评估拟合的质量和准确性。
误差解释:解释误差的来源。
可能的误差来源包括实验操作不精确、测量设备误差、细菌生长环境变化等。
分析这些误差来源可以帮助你了解实验过程中的潜在问题。
结果讨论:根据误差分析的结果,讨论实验数据和拟合模型之间的一致性或差异。
指出误差的大小、来源以及对实验结果的影响。
结论:总结你对细菌生长曲线误差分析的发现。