实验十二 大肠杆菌生长曲线的制作
- 格式:ppt
- 大小:56.00 KB
- 文档页数:19



大肠杆菌生长曲线实验报告抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。
但某些细菌对抗生素表现出抗性,原因是其基因发生了改变,产生能抵抗抗生素的性状。
在自然情况下,细菌的基因突变率很低,而且突变是不定向的,因此在自然条件下,想要获得有抗性的细菌是很困难的。
当给与适当的物理条件时,其突变率会大大增加。
如当用α射线、β射线、γ射线、Χ射线、中子和其他粒子、紫外线、微波等物理因素辐射时,能够促进遗传物质突变。
DNA对紫外线(UV)有强烈的吸收作用,尤其是碱基中的嘧啶,它比嘌呤更为敏感。
紫外线引起DNA 结构变化的形式有DNA链断裂、碱基破坏、胸腺嘧啶二聚体等。
因此,紫外线通常作为诱变剂,用于微生物菌种选育。
一般细胞分裂越旺盛,诱变剂量越大,突变率高,诱变最有效的波长253~265 nm。
选择合适的诱变剂量对于获得较高突变率十分关键,过高或过低的辐射剂量会导致菌株死亡或诱变不充分而降低诱变效果。
在紫外线诱变下,菌株发生不定向的突变,想要得到需要的特向变异必须对诱变后的菌株做筛选。
本实验想要得到的是能够抵抗抗生素的菌株,因此可以用抗生素培养基作为筛选培养基对菌种进行筛选。
若菌株没有发生定向突变,则该菌株不能在抗性培养基上正常生长,只有发生了定向突变才可能在筛选培养基上正常生长。
紫外线对于菌株有诱变作用外,对菌株还有较强的致死作用,因为紫外线改变了菌株的基因结构导致菌株无法正常生长繁殖。
因此,通过本实验的操作,在合适的照射剂量的设置下,比较不同不同照射剂量下的致死效果和突变率,并初步分析两者的相关性。
在分析死亡曲线和诱变率曲线的基础上,能了解诱变育种的机理和方法,为做进一步的诱变实验做准备。
2.材料和方法2.1实验材料、仪器和试剂菌种:大肠杆菌仪器:超净台、离心机、高压灭菌锅、培养箱、磁力搅拌器、培养皿、涂布器、移液管、移液器试剂:牛肉膏蛋白胨培养基相关试剂、硫酸卡那霉素水溶液(50mg/ml)、生理盐水2.2实验方法2.2.1制备培养基普通培养基——牛肉膏蛋白胨培养基(400ml):牛肉膏5g蛋白胨10g Nacl 5g琼脂20g蒸馏水1000ml Ph7.0 按配方配制好培养基后置于灭菌锅中115℃15min,倒平板,4皿*15ml*5组+2皿*15ml=22皿*15ml=330ml筛选培养基(200ml):含抗生素50mg/L。
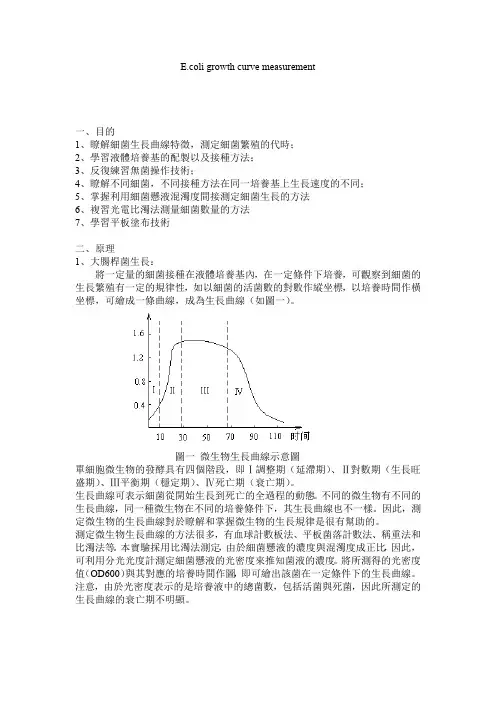
E.coli growth curve measurement一、目的1、瞭解細菌生長曲線特徵,測定細菌繁殖的代時;2、學習液體培養基的配製以及接種方法;3、反復練習無菌操作技術;4、瞭解不同細菌,不同接種方法在同一培養基上生長速度的不同;5、掌握利用細菌懸液混濁度間接測定細菌生長的方法6、複習光電比濁法測量細菌數量的方法7、學習平板塗布技術二、原理1、大腸桿菌生長:將一定量的細菌接種在液體培養基內,在一定條件下培養,可觀察到細菌的生長繁殖有一定的規律性,如以細菌的活菌數的對數作縱坐標,以培養時間作橫坐標,可繪成一條曲線,成為生長曲線(如圖一)。
圖一微生物生長曲線示意圖單細胞微生物的發酵具有四個階段,即Ⅰ調整期(延滯期)、Ⅱ對數期(生長旺盛期)、Ⅲ平衡期(穩定期)、Ⅳ死亡期(衰亡期)。
生長曲線可表示細菌從開始生長到死亡的全過程的動態。
不同的微生物有不同的生長曲線,同一種微生物在不同的培養條件下,其生長曲線也不一樣。
因此,測定微生物的生長曲線對於瞭解和掌握微生物的生長規律是很有幫助的。
測定微生物生長曲線的方法很多,有血球計數板法、平板菌落計數法、稱重法和比濁法等。
本實驗採用比濁法測定,由於細菌懸液的濃度與混濁度成正比,因此,可利用分光光度計測定細菌懸液的光密度來推知菌液的濃度。
將所測得的光密度值(OD600)與其對應的培養時間作圖,即可繪出該菌在一定條件下的生長曲線。
注意,由於光密度表示的是培養液中的總菌數,包括活菌與死菌,因此所測定的生長曲線的衰亡期不明顯。
2、平板塗布技術:塗布法接種是一種常用的接種方法,不僅可以用於計算活菌數,還可以利用其在平板表面生長形成菌苔的特點用於檢測化學因素對微生物的抑殺效應。
原理:將一定濃度,一定量的待分離菌懸液加到已凝固的培養基平板上,再用塗布棒快速地將其均勻塗布,使長出單菌落或菌苔而達到分離或計數的目的。
其目的:用於目的微生物的分離;用於藥物的抑菌試驗;觀察菌苔的形狀和特點。
![[精品]细菌生长曲线的测定](https://uimg.taocdn.com/26b67aef5122aaea998fcc22bcd126fff7055d68.webp)
[精品]细菌生长曲线的测定细菌生长曲线的测定是细菌学中的一项重要实验。
它可以帮助我们了解细菌的生长繁殖规律及其影响因素,为控制细菌繁殖提供理论依据。
本次实验将介绍如何通过外观观察、菌落计数及测定细菌生物量的方法,获得细菌在液体培养基中的生长曲线。
实验步骤:一、准备实验材料和试剂1、选取一种细菌菌株,本次实验选择了大肠杆菌(Escherichia coli);2、配置好液体培养基,一般为普通营养琼脂培养基、肉汤培养基等;3、消毒好实验室的工作台面及实验仪器;4、准备好移液管、试管、比色管和加热消毒的线圈镊子等实验用具。
二、制备不同浓度的菌液1、挑选一根菌棒,从培养基上接入一些带有细菌的菌落,将菌落均匀涂抹于培养基表面;2、将含有细菌的培养基放置在恒温摇床中,在适宜的温度下进行培养;3、当细菌生长至一定程度(一般在对数生长期)时,用无菌的移液管,在培养基中取出一定量的菌液;4、分别将不同体积的菌液加入到含有培养基的试管中,制备成不同浓度的菌液。
三、测定不同浓度菌液对应的OD600值1、将制备好的不同浓度菌液放入洗涤过的比色管中;2、由于细菌太小,肉眼观察不能得出其数量的增多或减少,因此需要使用分光光度计在600nm处测量各个浓度的菌液的吸光度(OD)值;3、重复测量3次,取平均值计算OD600;4、根据OD600值和菌液中细胞数量的线性关系,可通过OD600值推算出细胞数。
2、每隔2-3个小时,取出一定量的菌液,测量其OD600值,记录下菌液对应时间的值;3、采用计数培养法,每隔一定时间取出一定体积的菌液,进行菌落数的计数;4、利用OD600值曲线和菌落数曲线绘制出细菌生长曲线。
实验注意事项:1、实验期间需在无菌条件下操作,防止细菌的外界感染对实验结果的影响;2、实验者需佩戴适当的防护手套及实验服,以免对人体造成伤害;3、制备好菌液后需要及时放置在摇床中,防止菌落外的细菌感染进去;4、测量OD600值时比色管必须清洗干净,用甲醇或无菌去离子水。

大肠杆菌生长曲线的测定一、基本原理生长曲线是微生物在液体培养基中所表现出来的生长、繁殖的规律,不同的微生物表现为不同的生长曲线,而即使是同一种微生物在不同培养条件下,其生长曲线也不同。
因此测定微生物的生长曲线对于了解,掌握微生物的生长规律是有帮助的。
由于细菌悬液的浓度与混浊度成正比,因此可利用光电比色计测定菌悬液的光密度来推知菌液的浓度。
本实验是以活菌计数法与光电比浊法相对应来测定大肠杆菌在不同培养条件下的生长曲线,从而观察分析大肠杆菌在这些培养条件下的生长情况。
二、器材培养了20小时的大肠杆菌悬液;肉汤蛋白胨培养基(液体、固体);浓缩的肉汤蛋白胨液体培养基(浓缩5倍);无菌酸溶液(甲酸:乙酸:乳酸=3:1:1)。
1毫升及5毫升无菌吸管;无菌试管;无菌生理盐水;无菌平皿;血球计数器;显微镜;光电比色计;无菌离心管;离心机等。
三、操作步骤1.将经20小时培养的大肠杆菌培养物,倒入无菌离心管内离心(3000r.p.m×10),以无菌生理盐水洗涤三次后,制成约9亿毫升的菌悬液(用显微镜直接计数法),作为种子。
上述过程都必须注意严格无菌操作。
2.取盛有200毫升培养基经灭菌的三角瓶三瓶,分别标明A、B、C,按5%接种量,将上述种子接入,置37℃振荡培养。
在B瓶培养了4小时后取出,加入10毫升无菌酸溶液,然后继续振荡培养。
在C瓶培养了6小时后取出,加入10毫升无菌浓缩肉汤蛋白胨液,再继续振荡培养。
3.间隔一定时间,即0、2、4、6、8、10、12、14、16、18、20小时后,从A、B、C三角瓶中各取5毫升菌液放于无菌试管中,置冰浴。
并作适当稀释,使菌悬液的光密度控制在0.0-0.4范围内,再置光电比色计中进行比浊测定(400-440毫微米波长),用未接种的肉汤蛋白胨液为空白对照。
记下光密度值。
另外,A管在比浊测定以前,以无菌操作吸取0.1毫升菌液于肉汤蛋白胨琼脂平板上,用玻璃刮棒涂抹均匀后,置37℃培养30小时后计数。

大肠杆菌生长曲线的制备一、实验目的1 了解细菌生长曲线特点及测定原理;2 学习用比浊法测定细菌的生长曲线。
二、基本原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
三、器材1菌种:大肠杆菌2培养基:LB培养基(蛋白胨10g 酵母膏5g Nacl 10g pH7.0~7.2)3仪器和器具:721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
四、方法与步骤1种子液制备取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入LB培养基中,静止培养18h作种子培养液。
2标记编号取11支无菌试管,分别编号为0、1.5、3、4、6、8、10、12、14、16、20h。
3接种培养吸取2.5ml种子液加入装有60mlLB培养基的锥形瓶中,混匀。
分别取5ml加入到11根试管,于37℃下振荡培养。
然后分别按对应时间将试管取出,立即放冰箱中贮存,待培养结束时一同测定OD值。
4生长量测定将未接种的LB培养基倾倒入比色杯中,选用600nm 波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在0.10.~0.65以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。

四川大学化学实验报告课程名称生物工艺学实验课程号 309119060学院轻纺与食品学院专业轻工生物技术学生姓名赵凤佼学号 0843095035指导教师周荣清成绩评定实验日期 2011-06-20~2011-06-22一、实验名称:大肠杆菌生长曲线的制作二、实验目的:1.通过细菌数量的测量了解大肠杆菌的生长特征与规律,绘制生长曲线。
2.掌握光电比浊法测量细菌数量的方法。
三、实验仪器及药品:1.菌种:大肠杆菌。
2.培养基:LB培养基100ml,分装两支大试管(5ml/支),剩余90ml装入250ml三角瓶。
3.仪器和其他药品:722型分光光度计,水浴振荡摇床,无菌试管和无菌吸管等。
四、基本原理:在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次,将一定量的细菌转入新鲜培养液中,在适宜的培养条件下细胞要经历延迟期、对数期、稳定器和衰亡期4个阶段。
以培养时间为横坐标,细菌数目的对数或生长速率为纵坐标所绘制的曲线成为该细菌的生长曲线。
不同的细菌在在相同的培养条件下其生长曲线不同,同种细菌在不同的培养条件下所绘制的生长曲线也不同。
当光线微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低。
在一定范围内,微生物细胞浓度与透光度成反比,与光密度成正比;而光密度或透光度可以通过光电池精确测出。
因此,可利用一系列菌悬液测定的光密度及其含菌量,做出光密度—菌数的标准曲线,然后根据样品液所测得的光密度,从标准曲线中查处对应的菌数。
本实验用分光光度计进行光电比浊,测定不同时间细菌悬浮液的OD值,绘制生长曲线。
五、关键步骤及注意事项:1.测定OD值时,要求从低浓度到高浓度测定2.严格控制培养时间六、操作步骤:1.标记取11支无菌试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16、20h。
2.接种分别用5ml无菌吸管吸取2.5ml大肠杆菌过夜培养液(培养10~12h)转入盛有90mlLB培养液的三角瓶,混合均与后分别取5ml混合液放入上述标记的11支无菌试管中。

四川大学化学实验报告课程名称生物工艺学实验课程号 309119060学院轻纺与食品学院专业轻工生物技术学生姓名赵凤佼学号 0843095035指导教师周荣清成绩评定实验日期 2011-06-20~2011-06-22一、实验名称:大肠杆菌生长曲线的制作二、实验目的:1.通过细菌数量的测量了解大肠杆菌的生长特征与规律,绘制生长曲线。
2.掌握光电比浊法测量细菌数量的方法。
三、实验仪器及药品:1.菌种:大肠杆菌。
2.培养基:LB培养基100ml,分装两支大试管(5ml/支),剩余90ml装入250ml三角瓶。
3.仪器和其他药品:722型分光光度计,水浴振荡摇床,无菌试管和无菌吸管等。
四、基本原理:在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次,将一定量的细菌转入新鲜培养液中,在适宜的培养条件下细胞要经历延迟期、对数期、稳定器和衰亡期4个阶段。
以培养时间为横坐标,细菌数目的对数或生长速率为纵坐标所绘制的曲线成为该细菌的生长曲线。
不同的细菌在在相同的培养条件下其生长曲线不同,同种细菌在不同的培养条件下所绘制的生长曲线也不同。
当光线微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低。
在一定范围内,微生物细胞浓度与透光度成反比,与光密度成正比;而光密度或透光度可以通过光电池精确测出。
因此,可利用一系列菌悬液测定的光密度及其含菌量,做出光密度—菌数的标准曲线,然后根据样品液所测得的光密度,从标准曲线中查处对应的菌数。
本实验用分光光度计进行光电比浊,测定不同时间细菌悬浮液的OD值,绘制生长曲线。
五、关键步骤及注意事项:1.测定OD值时,要求从低浓度到高浓度测定2.严格控制培养时间六、操作步骤:1.标记取11支无菌试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16、20h。
2.接种分别用5ml无菌吸管吸取2.5ml大肠杆菌过夜培养液(培养10~12h)转入盛有90mlLB培养液的三角瓶,混合均与后分别取5ml混合液放入上述标记的11支无菌试管中。
大肠杆菌生长曲线的测定蔡小鹏(南京工业大学生物与制药工程学院制药1104班)【摘要】通过比浊法对大肠杆菌生长曲线进行测定。
因为细菌悬液的浓度与光密度成正比,所以可利用分光光度计测定菌悬液的光密度来推知菌悬液的浓度。
将培养12h的大肠杆菌进行发酵罐培养,在不同时间段取样,用分光光度计对大肠杆菌的生长曲线进行测定,测定结果显示:大肠杆菌生长曲线基本符合迟缓期、对数生长期、稳定生长期和衰亡期4个时期。
【关键字】比浊法;发酵罐培养;生长曲线大肠杆菌是人和动物肠道中最著名的一种细菌,主要寄生于大肠内,约占肠道菌中的1%。
是一种两端钝圆、能运动、无芽孢的革兰氏阴性短杆菌。
除某些菌型能引起腹泻外,一般不致病,能合成维生素B和K,对人体有益。
大肠杆菌是肠杆菌科的一员,经常作为细菌的模式生物广泛用于科学研究。
1实验材料与方法1.1实验材料1.1.1菌种大肠杆菌1.1.2培养基1.1.2.1种子培养基蛋白胨1%,酵母粉0.5%,Nacl0.8%,硫酸卡那霉素800µL/L(灭菌后同冻存管一起加入摇瓶)在烧杯中加入1.5g/150mL蛋白胨、0.75g/150mL酵母粉、1.2g/mL Nacl,再加入适量(少于150ml)的蒸馏水,搅拌使之充分溶解,再补充水定容至150ml,保持自然PH。
平均分装3瓶后,121℃灭菌20min[1]1.1.2.2发酵培养基在烧杯中加入6g/L蛋白胨、3g/L酵母粉、1.5g/L无水硫酸镁、0.013g/L无水氯化钙、5g/L硫酸铵、1.5g/L柠檬酸三钠、3g/L磷酸二氢钾、0.075g/L七水合硫酸亚铁,再加入适量的(少于1L)蒸馏水,搅拌使之充分溶解,再补充水定容至1L。
121℃灭菌20min。
1.2器材超净工作台,高压灭菌锅,分光光度计,发酵罐及相应装置,摇床,移液枪,枪头,酒精灯,接种环,三角瓶,玻璃棒,烧杯1.3接种1.3.1种子培养基接种选取单菌落生长明显的平板,用接种环挑取适量的菌落转移到灭过菌的种子培养基三角瓶中。
大肠杆菌标准生长曲线大肠杆菌的生长曲线通常包括潜伏期、指数期、平稳期和衰老期四个阶段。
在潜伏期,细菌适应新环境,准备开始快速生长。
随后进入指数期,细菌开始以指数级增长,细胞数急剧增加。
当细菌数量达到最大值后,进入平稳期,此时细菌的生长速率和死亡速率达到动态平衡,细菌数量基本保持不变。
最终,细菌进入衰老期,生长速率下降,死亡速率加快,细菌数量开始减少。
大肠杆菌的生长曲线受到多种因素的影响,包括温度、pH值、营养物质和氧气含量等。
一般来说,大肠杆菌在适宜的温度(37摄氏度)、中性或微酸性的环境、富含营养物质和氧气充足的条件下,生长速率最快,而在极端的温度、酸碱度和氧气条件下,生长速率会受到限制甚至停止。
为了绘制大肠杆菌的标准生长曲线,通常需要进行一系列实验。
首先,将大肠杆菌接种到含有适当营养物质的培养基中,然后在不同时间点取样,通过测定细菌数量或生物量的变化,可以得到细菌在不同生长阶段的生长曲线。
通过这些数据,可以绘制出大肠杆菌的标准生长曲线,进而分析其生长规律和生长特点。
大肠杆菌标准生长曲线的绘制对于微生物学研究具有重要意义。
首先,它可以帮助我们更好地理解大肠杆菌的生长规律,包括潜伏期、指数期、平稳期和衰老期四个阶段的特点和转变规律。
其次,通过对大肠杆菌在不同环境条件下的生长曲线进行比较分析,可以揭示其对环境因素的响应和适应能力,为微生物的应用和利用提供重要参考。
此外,大肠杆菌标准生长曲线还可以为微生物的培养和应用提供理论指导,帮助我们更好地利用这一微生物资源。
总之,大肠杆菌标准生长曲线是研究其生长特性和生理代谢的重要手段,通过对其生长曲线的绘制和分析,可以更好地了解其生长规律和生长特点。
同时,它也为微生物的应用和利用提供重要参考,具有重要的理论和实践意义。
希望本文的介绍能够帮助读者更好地理解和应用大肠杆菌标准生长曲线,促进微生物学研究的发展和应用。
大肠杆菌生长曲线的测定蔡小鹏(南京工业大学生物与制药工程学院制药1104班)【摘要】通过比浊法对大肠杆菌生长曲线进行测定。
因为细菌悬液的浓度与光密度成正比,所以可利用分光光度计测定菌悬液的光密度来推知菌悬液的浓度。
将培养12h的大肠杆菌进行发酵罐培养,在不同时间段取样,用分光光度计对大肠杆菌的生长曲线进行测定,测定结果显示:大肠杆菌生长曲线基本符合迟缓期、对数生长期、稳定生长期和衰亡期4个时期。
【关键字】比浊法;发酵罐培养;生长曲线大肠杆菌是人和动物肠道中最著名的一种细菌,主要寄生于大肠内,约占肠道菌中的1%。
是一种两端钝圆、能运动、无芽孢的革兰氏阴性短杆菌。
除某些菌型能引起腹泻外,一般不致病,能合成维生素B和K,对人体有益。
大肠杆菌是肠杆菌科的一员,经常作为细菌的模式生物广泛用于科学研究。
1实验材料与方法1.1实验材料1.1.1菌种大肠杆菌1.1.2培养基1.1.2.1种子培养基蛋白胨1%,酵母粉0.5%,Nacl0.8%,硫酸卡那霉素800µL/L(灭菌后同冻存管一起加入摇瓶)在烧杯中加入1.5g/150mL蛋白胨、0.75g/150mL酵母粉、1.2g/mL Nacl,再加入适量(少于150ml)的蒸馏水,搅拌使之充分溶解,再补充水定容至150ml,保持自然PH。
平均分装3瓶后,121℃灭菌20min[1]1.1.2.2发酵培养基在烧杯中加入6g/L蛋白胨、3g/L酵母粉、1.5g/L无水硫酸镁、0.013g/L无水氯化钙、5g/L硫酸铵、1.5g/L柠檬酸三钠、3g/L磷酸二氢钾、0.075g/L七水合硫酸亚铁,再加入适量的(少于1L)蒸馏水,搅拌使之充分溶解,再补充水定容至1L。
121℃灭菌20min。
1.2器材超净工作台,高压灭菌锅,分光光度计,发酵罐及相应装置,摇床,移液枪,枪头,酒精灯,接种环,三角瓶,玻璃棒,烧杯1.3接种1.3.1种子培养基接种选取单菌落生长明显的平板,用接种环挑取适量的菌落转移到灭过菌的种子培养基三角瓶中。
(一)目的要求1.通过细菌数量的测量了解大肠杆菌的生物特征和规律,绘制生长线。
2.复习光电比浊法测量细菌数量的方法。
(二)基本原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次。
将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期,对数期、稳定期和衰亡期四个阶段。
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线。
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同。
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义。
用于测定细菌细胞数量的方法已在上述实验作了介绍。
本实验用分光光度计(spectrophotometer)进行光电比浊测定不同培养时间细菌悬浮液的OD值,绘制生长曲线。
也可以直接用试管或带有测定管的三角瓶(图15-5)测定“klett units”值的光度计。
如图15—6所示,只要接种1支试管或1个带测定管的三角瓶,在不同的培养时间(横坐标)取样测定,以测得的klett units为纵坐标,便可很方便地绘制出细菌的生长曲线。
如果需要,可根据公式1 klett units=OD/0.002换算出所测菌悬液的OD值。
(三)器材1.菌种大肠杆菌2.培养基 LB液体培养基70ml,分装2支大试管(5ml/支),剩余60ml装入250ml的三角瓶。
3.仪器或其他用具 722型分光光度计,水浴振荡摇床,无菌试管,无菌吸管等。
(四)操作步骤1.标记取11支无菌大试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16和20h。
2.接种分别用5ml无菌吸管吸取2.5ml大肠杆菌过夜培养液(培养10~12h)转入盛有50ml LB液的三角瓶内,混合均匀后分别取5ml混合液放入上述标记的11支无菌大试管中。