实验4测定细菌生长曲线
- 格式:ppt
- 大小:90.50 KB
- 文档页数:9

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。

细菌生长曲线及特点细菌生长曲线及特点细菌是微生物界中数量繁多的一类生物,它们的生长规律是生物学研究的重要内容之一。
细菌的生长曲线是描述细菌在培养基中生长繁殖过程中细胞数量随时间的变化规律的图表。
通过研究细菌生长曲线及其特点,可以更好地了解细菌的生长机理、调控因素和生物学特性,对于生态学、医药学以及食品工业的微生物控制等领域有着重要的意义。
一、细菌生长曲线的基本形态细菌生长曲线通常呈现出经典的四个阶段:潜伏期、指数期、平稳期和死亡期。
1. 潜伏期(Lag phase):细菌刚转入新环境时,需要适应新的生长条件,此时细菌的生长速度较慢,细菌数量几乎不变。
细菌在此期通过合成必要的酶、蛋白质等物质来适应环境。
2. 指数期(Log phase):此阶段为快速增长期,细菌开始进入高度增殖状态。
细菌数量呈指数级增长,代表着细菌的快速繁殖。
这是因为细菌在此时处于最适合生长的温度、pH值、营养成分等条件下,利用培养基中的营养物质大量繁殖。
3. 平稳期(Stationary phase):该阶段细菌的繁殖速度逐渐减慢,细菌数量达到一个相对稳定状态。
此时细菌的分裂速度与死亡速度相互平衡,其中营养物质的消耗和废物的积累是导致生长停滞的主要原因。
4. 死亡期(Death phase):此阶段细菌数量开始逐渐减少,细菌中的死亡速度远远大于新细菌的产生速度。
营养物质的枯竭、有毒物质的积累以及母细胞的衰老等因素,都会导致细菌的死亡和生长的终止。
二、细菌生长曲线的特点1. 不同种类细菌具有不同的生长周期和生长速度。
一般而言,细菌的生长周期可从几小时到几天不等。
某些嗜热菌能在高温下迅速繁殖,而一些室温菌对温度的要求较低。
2. 细菌生长曲线呈现出的四个阶段可以反映细菌生长的动态变化。
通过观察曲线的形态,可以判断细菌在特定环境下的适应能力以及生长特性。
3. 细菌生长曲线的特点与培养基、环境条件、温度、氧气含量等因素密切相关。
不同的培养基和环境条件对细菌的生长有直接影响,而温度和氧气含量对细菌的生长速度和类型也有重要的影响。

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。

大肠杆菌生长曲线测定一、目的要求了解大肠杆菌生长曲线的基本特征,从而认识微生物在一定条件下生长、繁殖的规律。
二、基本原理一定量的微生物,接种在适合的新鲜液体培养基中,在适宜的温度下培养,以菌数的对数作纵坐标,生长时间作横坐标,做出的曲线叫生长曲线。
一般可分为延迟期、对数期、稳定期和衰亡期四个时期。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数法、平板菌落计数法、称重法、比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用光电比色计测定菌悬液的光密度来推知菌液的浓度,并将所测得的光密度值(OD值)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
现已有直接用试管就可以测定OD值的光电比色计(图Ⅶ-10),只要接种一支试管,定期用它测定,便可做出该菌的生长曲线。
三、器材培养18—20小时的大肠杆菌培养液,盛有5ml肉膏蛋白胨液体培养基的大试管12支;72型或72.1型分光光度计,自控水浴振荡器或摇床,无菌吸管等。
四、操作步骤1.编号取11支盛有肉膏蛋白胨液体培养基的大试管,用记号笔标明培养时间,即0、1.5、3、4、6、8、10、12、14、16、20小时。
2.接种用1ml无菌吸管,每次准确地吸取0.2ml大肠杆菌培养液,分别接种到已编号的11支肉膏蛋白胨液体培养基大试管中,接种后振荡,使菌体混匀。
3.培养中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。
将接种后的11支试管置于自控水浴振荡器或摇床上,37℃振荡培养。
分别在0、1.5、3、4、6、8、10、12、14、16、20小时将编号为对应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定光密度值。

竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml 玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
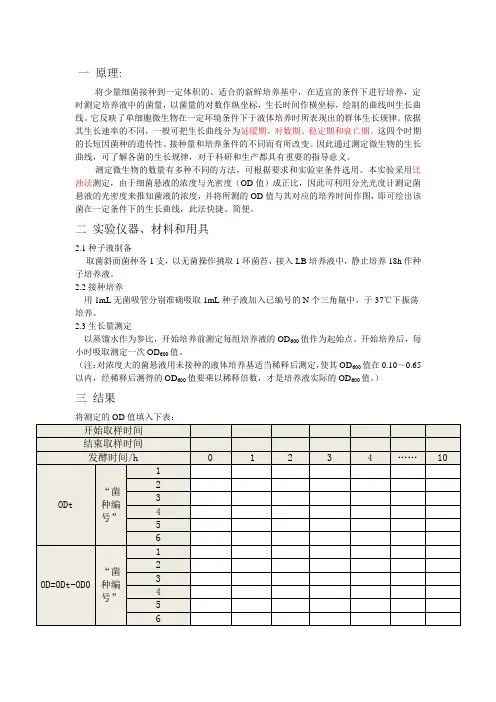
一原理:
将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
二实验仪器、材料和用具
2.1种子液制备
取菌斜面菌种各1支,以无菌操作挑取1环菌苔,接入LB培养液中,静止培养18h作种子培养液。
2.2接种培养
用1mL无菌吸管分别准确吸取1mL种子液加入已编号的N个三角瓶中,于37℃下振荡培养。
2.3 生长量测定
以蒸馏水作为参比,开始培养前测定每组培养液的OD600值作为起始点。
开始培养后,每小时吸取测定一次OD600值。
(注:对浓度大的菌悬液用未接种的液体培养基适当稀释后测定,使其OD600值在0.10~0.65以内,经稀释后测得的OD600值要乘以稀释倍数,才是培养液实际的OD600值。
)
三结果
将测定的OD值填入下表:。
![[精品]细菌生长曲线的测定](https://uimg.taocdn.com/26b67aef5122aaea998fcc22bcd126fff7055d68.webp)
[精品]细菌生长曲线的测定细菌生长曲线的测定是细菌学中的一项重要实验。
它可以帮助我们了解细菌的生长繁殖规律及其影响因素,为控制细菌繁殖提供理论依据。
本次实验将介绍如何通过外观观察、菌落计数及测定细菌生物量的方法,获得细菌在液体培养基中的生长曲线。
实验步骤:一、准备实验材料和试剂1、选取一种细菌菌株,本次实验选择了大肠杆菌(Escherichia coli);2、配置好液体培养基,一般为普通营养琼脂培养基、肉汤培养基等;3、消毒好实验室的工作台面及实验仪器;4、准备好移液管、试管、比色管和加热消毒的线圈镊子等实验用具。
二、制备不同浓度的菌液1、挑选一根菌棒,从培养基上接入一些带有细菌的菌落,将菌落均匀涂抹于培养基表面;2、将含有细菌的培养基放置在恒温摇床中,在适宜的温度下进行培养;3、当细菌生长至一定程度(一般在对数生长期)时,用无菌的移液管,在培养基中取出一定量的菌液;4、分别将不同体积的菌液加入到含有培养基的试管中,制备成不同浓度的菌液。
三、测定不同浓度菌液对应的OD600值1、将制备好的不同浓度菌液放入洗涤过的比色管中;2、由于细菌太小,肉眼观察不能得出其数量的增多或减少,因此需要使用分光光度计在600nm处测量各个浓度的菌液的吸光度(OD)值;3、重复测量3次,取平均值计算OD600;4、根据OD600值和菌液中细胞数量的线性关系,可通过OD600值推算出细胞数。
2、每隔2-3个小时,取出一定量的菌液,测量其OD600值,记录下菌液对应时间的值;3、采用计数培养法,每隔一定时间取出一定体积的菌液,进行菌落数的计数;4、利用OD600值曲线和菌落数曲线绘制出细菌生长曲线。
实验注意事项:1、实验期间需在无菌条件下操作,防止细菌的外界感染对实验结果的影响;2、实验者需佩戴适当的防护手套及实验服,以免对人体造成伤害;3、制备好菌液后需要及时放置在摇床中,防止菌落外的细菌感染进去;4、测量OD600值时比色管必须清洗干净,用甲醇或无菌去离子水。




细菌的生化实验报告细菌的生化实验报告细菌是微生物界中最为常见的一类生物,它们以其微小的身躯和巨大的生物活动而闻名。
在本次实验中,我们旨在探索细菌的生化特性和其在环境中的作用。
通过实验,我们对细菌的生长、代谢和适应能力有了更深入的了解。
实验一:细菌的生长曲线在这个实验中,我们选择了大肠杆菌作为研究对象。
我们将大肠杆菌接种在培养基上,并在一定时间间隔内记录细菌的生长情况。
通过测量培养液中的细菌数量,我们绘制了细菌的生长曲线。
结果显示,细菌的生长曲线呈现出典型的“S”形曲线。
在实验初期,细菌数量增长较为缓慢,这是由于适应期的存在。
随着时间的推移,细菌进入了指数增长期,细菌数量迅速增加。
然而,随着培养基中营养物质的消耗和代谢产物的积累,细菌的生长速率逐渐减缓,进入了平台期。
这是由于细菌的生长受到了环境条件的限制。
实验二:细菌的代谢特性在这个实验中,我们研究了细菌的代谢特性,特别是其对碳源的利用能力。
我们选择了葡萄糖、乳糖和蔗糖作为碳源,通过测量细菌在不同碳源下的生长情况,评估了细菌对不同碳源的利用能力。
结果显示,大肠杆菌对葡萄糖的利用能力最强,其次是乳糖,而对蔗糖的利用能力较弱。
这表明细菌对碳源的利用能力存在差异,可能与其代谢途径和酶的分布有关。
此外,我们还观察到在不同碳源条件下,细菌的生长速率和产生的代谢产物也有所不同。
这提示我们,在实际应用中,选择合适的碳源可以促进细菌的生长和代谢活性。
实验三:细菌的适应能力在这个实验中,我们研究了细菌的适应能力,特别是其对环境压力的响应。
我们将大肠杆菌分别接种在不同的培养基中,其中一组培养基中添加了抗生素,另一组培养基中添加了高温。
结果显示,添加抗生素的培养基中,细菌的生长受到了明显的抑制。
抗生素通过抑制细菌的代谢活性和细胞分裂,从而阻碍了细菌的生长。
而在高温条件下,细菌的生长速率明显减慢,部分细菌甚至无法生存。
这表明细菌对环境压力的适应能力有限,过高的温度和抗生素的存在可能对细菌产生不可逆的影响。
细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线的测定细菌生长曲线的测定是研究细菌生长过程中数量的变化规律的重要实验方法。
通过测定不同时间点上细菌的数量,我们可以了解细菌的繁殖速度、生命周期以及适宜生长环境等信息。
本文将介绍细菌生长曲线的测定步骤,并探讨其在科学研究和实际应用中的指导意义。
首先,测定细菌生长曲线的实验需要准备培养基、平板、试管等实验器材,以及待测的细菌样品。
将培养基倒入平板中,使其均匀地附着在平板表面上。
取一定量的细菌样品,接种在试管中的培养基中,然后将试管放入恒温培养箱中。
在不同时间点上,分别取出试管,通过将样品进行稀释后在平板上接种细菌来测定其数量。
通过计数细菌在平板上形成的菌落数,我们可以得到细菌数量随时间的变化规律。
细菌生长曲线通常可以分为四个阶段:潜伏期、指数期、平稳期和衰亡期。
在潜伏期,细菌数量较低,适生环境适宜时,细菌开始繁殖。
进入指数期后,细菌数量呈指数增长,繁殖速度较快。
在平稳期,细菌数量达到平衡,新生细菌数量与死亡细菌数量相等。
最后,在衰亡期中,细菌数量逐渐减少。
细菌生长曲线的测定对于科学研究和实际应用中有着重要意义。
在科学研究中,通过测定细菌生长曲线可以获得细菌的生命周期信息,了解其生长特性和繁殖机制。
这对于研究细菌的生物学特性、药物敏感性以及探索新的治疗方法具有指导意义。
此外,测定细菌生长曲线还可用于评估食品、水源等环境中的细菌污染情况,为公共卫生和食品安全提供重要依据。
在实际应用中,细菌生长曲线的测定可用于制定细菌培养条件和控制措施。
通过了解细菌的繁殖速度和繁殖条件,我们可以优化培养条件以提高细菌产量,或者通过调节环境因素来控制细菌的滋生。
此外,在药物研发和微生物工程中,测定细菌生长曲线可以评估抗生素对细菌的杀菌效果、药物毒性及其机制,为药物设计和微生物工程提供重要参考。
综上所述,细菌生长曲线的测定是一项生动、全面且具有指导意义的实验方法。
通过测定细菌数量随时间的变化规律,我们可以了解细菌的生长特性、繁殖机制和生命周期等信息。