第十一章-地球化学系统相图与相图热力学
- 格式:doc
- 大小:3.16 MB
- 文档页数:59



《化学热力学基础》PPT课件目录CONTENCT •引言•热力学基本概念与定律•热化学与化学反应的热效应•熵与熵增原理•自由能与化学平衡•相平衡与相图•结论与展望01引言化学热力学的定义与重要性定义化学热力学是研究化学变化过程中热量和功的相互转化以及有关热力学函数的科学。
重要性化学热力学是化学、化工、材料、能源等领域的重要基础,对于理解化学反应的本质、优化化学反应条件、开发新能源等具有重要意义。
化学热力学的发展历史早期发展19世纪初,随着工业革命的发展,热力学理论开始形成,并逐步应用于化学领域。
经典热力学建立19世纪中叶,经典热力学理论建立,包括热力学第一定律、热力学第二定律等基本定律被提出。
现代热力学发展20世纪以来,随着量子力学、统计力学等理论的发展,化学热力学在微观层面上的研究取得了重要进展。
课程目标与学习内容课程目标掌握化学热力学的基本概念、基本原理和基本方法,能够运用热力学知识分析和解决实际问题。
学习内容包括热力学基本概念、热力学第一定律、热力学第二定律、化学平衡、相平衡、化学反应热力学等。
通过学习,学生将了解热力学在化学领域的应用,培养分析和解决化学问题的能力。
02热力学基本概念与定律80%80%100%系统与环境系统是指我们研究对象的那一部分物质或空间,具有明确的边界。
环境是指与系统发生相互作用的其他部分,是系统存在和发展的外部条件。
系统与环境之间通过物质和能量的交换而相互影响。
系统的定义环境的定义系统与环境的相互作用状态是系统中所有宏观物理性质的集合,用于描述系统的状况。
状态的概念状态函数的定义常见状态函数状态函数是描述系统状态的物理量,其值只取决于系统的始态和终态,与路径无关。
温度、压力、体积、内能等。
030201状态与状态函数热力学第一定律热力学第一定律的表述热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
热力学第一定律的数学表达式ΔU=Q+W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示外界对系统所做的功。

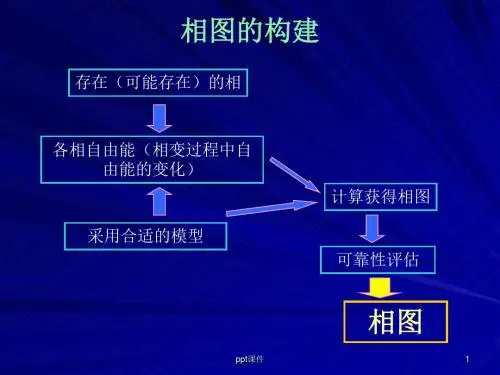






第十一章地球化学系统相图与相图热力学相图及其分类、单组分系统相图、二组分系统相图、固溶体二元系、低共熔系统相图及其热力学、出溶作用相图及其热力学原理、三组分系统相图、四组分系统相图的一般特征11.1 相图及其分类相平衡主要研究多相系统中相的平衡问题,即多相系统的状态(相的个数、每个相的组成、各相的相对含量等),随着温度、压力、组分浓度等的变化而发生变化的规律。
例如在岩浆结晶过程中,系统中有液相(熔体),还有各种矿物(固相),是一个多相系统。
随着温度的降低,这个相系统中有哪些相能继续存在?哪些相会消失?有没有新相生成?各种相的组成如何?各种相的相对含量又是多少?这些问题都是相平衡所要研究的问题。
根据多相平衡的实验结果,可以绘制成几何图形,用来描述系统在平衡状态下的变化关系。
这种图形就是相图(phase diagram),或者叫做状态图(贺可音,1995)。
相图是物质系统的相平衡信息与该系统的性质即热力学变量之间的相互关系的一种几何表达形式,有人形象地将相图称为热力学的语言。
根据不同的相图,可以看断出各种物质存在的温度、压力、逸度、活度、浓度、化学势、组成、电势、pH值、Eh值等变量的范围,也可判别相转变前后平衡共存相的组合和相成分等等。
因此,相图具有十分重要而独特的理论和实用价值。
相图不仅是物理化学、材料科学、冶金学、岩石学、矿物学、地球化学等学科领域的重要理论基础,也是化工、冶金、材料等工业部门制定生产工艺的理论依据。
根据稳定平衡相图,可以判断物质稳定存在的温度、压力、逸度、活度、浓度、化学势、组成、电位、pH值等变量的范围,也可判别相转变前后平衡共存相的组合和相成分(殷辉安等,2002)。
相图不仅对地质学理论研究有用,对于指导人们的生产也是很有帮助的。
例如在硅酸盐工业中,水泥、玻璃、陶瓷、耐火材料等传统硅酸盐制品的形成过程,都是在多相系统中实现的,是将一定配比的原料经过煅烧而形成的,一般要经历多次相变过程。
通过相平衡的研究就能了解在不同条件下,系统所处的状态,并能通过一定的工艺处理控制这些变化过程,生产出预期的产品。
对于新产品的开发,一般都是根据所要求的性能确定其矿物组成。
若根据所需要的矿物组成由相图来确定其配料范围,可以大大缩小实验范围、节约人力物力,取得事半功倍的效果(贺可音,1995)。
相图种类繁多,可根据许多不同的标准进行分类。
按照相图的维数划分,可分为二维(平面)相图、三维(立体)相图;按照物质系统划分可分为合金相图、水盐相图、矿物岩石相图等;按照相图坐标变量划分,可分为P–T、P–X、T–X、X i–X j、W i–W j、P–lg a、T–log a i、lg a i–lg a j、P–lgf、T–lgf、lg f i–lg f j、P–μi、T–μi、μi–μj、Eh–pH等二维相图,及P–T–X、X i–X j–X k、T–X i–X j、T–W i–W j、P–T–lg a i、P–T–lg f i、P–T–μi等三维相图(殷辉安等,2002)。
在地球科研研究中,相图主要用于确定元素的迁移和富集规律、地壳和地幔内矿物岩石稳定存在及转变的温度、压力、成分范围、成矿物理化学条件、变质作用物理化学条件等等(殷辉安等,2002)。
自由度是指要彻底描述平衡系统所需要的变量数的最小值。
对于含有C个组分、P个相的平衡系统,存在着无变度(自由度F=0)、单变度(自由度F=1)、双变度(自由度F=2)、多变度(自由度F>2)的情况。
无变度系统:该系统中存在P=C+2–F=C+2种相;单变度系统:存在P=C+2–F=C+1种相;双变度系统:存在P=C+2–F=C种相。
穆克敏、李树勋(1988)对相和组分做了深入论述:相(phase):指系统中物理性质、化学性质、成分均匀的部分,相与相之间可机械地分割开,或至少能在测试技术上区分开,即相与相之间有物理界面。
一种相可以含有多种物质,如不同成分的气体均匀混合物为一种混合气相;溶液为液相;而不相混合的液体为不同的相,例如水和油为二相。
一种物质在不同的不同条件下可呈现为不同的相,例如水–水蒸气–冰、石墨–金刚石、石英的多种变体等。
固溶体系列中不同的成员(如斜长石)为不同的相。
由此可知,环带构造斜长石的各环带为不同的相。
条纹构造的主晶和客晶为不同的相。
同一系统内同种相可以呈现若干单体,不一定连接成片。
例如液相可为若干液滴。
同一矿物相可为若干晶粒。
组分(component):是系统中独立的物质组成部分。
一般是指构成系统中所有各相而采用的最少数目的个体物质种类。
例如在SiO2–H2O系统中,可以认为SiO2和H2O是两种组分,系统的组分数C=2。
如果所研究的系统中包括有CaCO3、CO2、CaO三种形式的化合物,即可出现三种相。
根据反应关系式CO2 + CaO = CaCO3,可以选用其中两种作为独立的组成部分(例如CO2、CaO),即“组分”,而第三种(CaCO3)不是独立的,可通过选定组分的化学反应而得到。
这个系统的组分数目为C=2。
11.2 单组分系统相图组分和组分数目是人为确定的,主要取决于我们希望研究的反应作用的范畴和类型。
例如,在含H2O的系统中,希望研究的气相、液相、固相的关系,或研究冰的各种变体时,则可以确定组分为H2O,组分数目C=1。
然而,如果研究H2O分子的分解或离子分解时,按照O2+2H2=2H2O或O2=2H2O–2H2,或选定H2和O2为组分,或选定H2O和H2为组分。
该系统的组分数目C=2。
系统按照其独立的组分数目划分为不同类型。
含一种组分者为单组分系统(one–component system),称为一元系(unary),二组分系统称为二元系(binary),三组分系统称为三元系(ternary),四组分系统称为四元系(quaternary)…。
按照相图适用对象,既有适用于岩浆系统的,也有适用于变质作用矿物共生分析的,还有适用于溶液和挥发份的。
我们集中论述岩浆作用相图和少部分固溶体相图。
实际上,岩浆系统往往是含挥发份的“湿润”系统,为简明起见,这里我们仅讨论凝聚系统的相图及其热力学特征。
所谓凝聚系统,指不含挥发份的系统,主要包括岩浆系统和变质作用的矿物组合系统。
11.3 二组分系统相图对于二组分(C=2)系统,F = 2 – P + 2 = 4 – P。
常采用P–T–X相图。
为了方便,常固定一个变量,做另外两个变量的平面图,例如恒压下的T–X图(等压切面图,isobaric section)、恒温下的P–X图(isothermal section),或取特定组分浓度的P–T图(等浓度切面, isoplethal section)。
对于二元系,下面主要介绍岩浆作用的一致及不一致熔融(结晶)、二元系低共熔现象及其热力学原理、固溶体二元系、出溶作用热力学原理。
11.3.1一致及不一致熔融(结晶)现象对于岩浆作用中的结晶(或熔融)过程,都存在两种情况。
(1)一致熔融(congruently melting)或一致结晶(congruently crystallizing),即岩石熔融(或岩浆结晶)过程中,熔出的熔体(或结晶出的矿物)一直没有脱离系统,熔融过程中系统化学成分不发生变化;(2)不一致熔融(incongruently melting)或不一致结晶(incongruently crystallizing),即岩石熔融(或岩浆结晶)过程中,熔出的熔体(或结晶出的矿物)在某些时刻脱离系统,系统化学成分会发生变化。
橄榄石的平衡熔融(Equilibrium melting)首先给岩石加热,升温至T b,此时橄榄石出现熔融,熔出成分为以b’点所代表的少量熔体。
该熔体比橄榄石固溶体更加富铁。
继续升高温度,熔体的比例增加。
随着熔融的加剧,残留橄榄石固溶体、熔体的成分都向左迁移,即残留橄榄石、熔体成分都变得更加富镁。
因为橄榄石和熔体总是呈平衡状态,所以每一阶段它们总是位杠杆规则(Lever Rule )为计算某一温度下橄榄石和熔体的成分,需要利用杠杆规则。
以温度Tc 为例,图中S 点代表橄榄石晶体的成分,L 点指示熔体的成分,A 点代表系统的总成分,x 代表橄榄石晶体质量的相对比例,则可以写出质量平衡方程:xS + (1–x)L = A ,该式也可写作:x (A – S) = (1– x)(L – A)。
平衡结晶(Equilibrium橄榄石的分离熔融 (Fractional Melting )在平衡熔融相图中,系统总成分没有变化,因为系统内的矿物、熔体都没有与系统分离。
在分离熔融过程中,当熔体产生后,就脱离系统(这对于地幔熔融来说非常重要)。
这种情况下,橄榄石和熔体的成分都向富Mg 的方向演化,最分离结晶分离结晶(FractionalCrystallization)过程中,晶体一经形成便脱离系统。
最后结晶的是纯的铁橄榄石。
(University of Washington网络资料)11.3.2 二元系统低共熔现象及其热力学原理(White, 1999)向纯物质中加入另一种物质,混合物的熔点低于纯物质,即物质熔点会降低,这是个普遍现象。
例如,熔雪剂即是一例。
北方冬季时为了减少公路的打滑,向雪、冰上撒适量的盐,冰雪就会在低于0ºC时仍然保持消融状态,从而增加公路的安全系数。
金属也有低共熔现象。
将金属A 和B 按各种不同的比例混合,当达到某一比例时,其熔融点无论是比A 的熔点,还是金属B 的熔点都低,这就是所谓低共熔结晶现象。
这一合成物又称谓共晶合成物(来自希腊语EUTEKTOS,意思是容易熔化的)。
它的熔化温度又称低共熔(共晶)温度。
日常生活中所使用的焊锡便是利用铅和锡的低共熔现象。
铅和锡的熔点分别为327ºC 和232ºC ,然而铅和锡混合后却生成了熔点低至183ºC 的合金(即焊锡)。
11.3.2.1 溶雪剂熔冰的热力学原理我们首先阐明盐融化冰这一过程的热力学原理。
假定冰消融时,含有NaCl 的水溶液与纯冰处于热力学平衡。
那么水溶液中H 2O 的化学势与纯冰中H 2O 的化学势相等,即aqeous H 2O ice H 2O μμ=。
已知在任意温度T 下,水溶液中H 2O 的化学势为aqeous H 2O aqeous 0,H 2O aqeous H 2O a ln RT μμ+=(其中aqeous 0,H 2O μ表示纯水的标准态化学势),所以aqeous H 2O aqeous 0,H 2O ice H 2O a ln RT μμ+=。
冰-盐系统中含盐很少,即0,ice H 2O ice H 2O μμ≈。
所以,aqeous H 2O aqeous 0,H 2O ice 0,H 2O a ln RT μμ+=。