青大附院临床试验申请表
- 格式:doc
- 大小:42.50 KB
- 文档页数:3
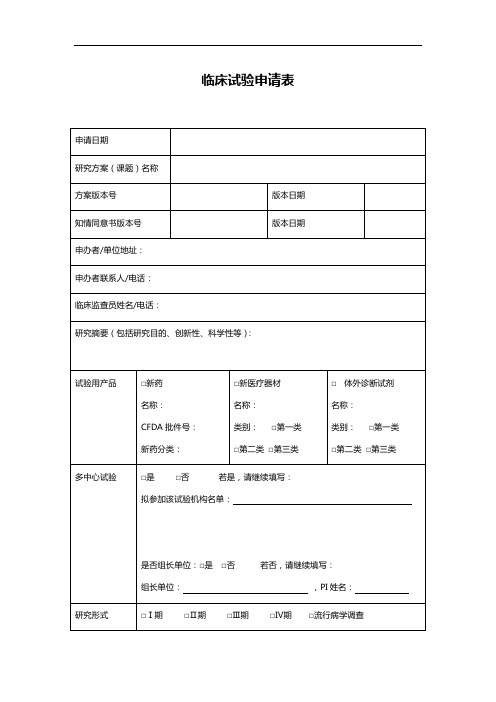



临床实验方案申请表申请人姓名:_____________________申请日期:_____________________一、研究方案概述研究题目:研究目的:研究设计类型:研究受试者人数估计:研究地点:研究周期:研究经费预算:二、研究背景与目的请简要描述研究的背景,并明确研究的目的。
三、研究设计与方法1. 研究类型请标明该实验属于哪种类型的研究(例如前瞻性队列研究、随机对照试验等),并说明为什么选择此种研究设计。
2. 研究受试者请描述研究计划中受试者的招募标准,并说明研究受试者的数量及受试者的来源。
3. 干预措施请详细描述研究计划中的干预措施,包括药物、手术、治疗等。
4. 观测指标请列出研究计划中的主要观测指标,并解释为什么选择这些指标。
5. 数据收集和处理请描述数据的收集方式和数据处理的方法,并解释为什么选择这些方法。
6. 伦理准备是否已获得相关伦理委员会的批准?若已获得,请提供伦理委员会的批准文件的编号和日期。
7. 预期结果请简要描述你预期的研究结果,以及对该领域的贡献。
四、研究计划及预算请详细描述研究计划的时间表和研究经费的预算。
请列出每个时间节点的主要工作内容与预计完成时间,以及各项经费的具体用途。
五、团队成员及分工请列出参与研究计划的研究人员姓名和职称,并说明每位成员的具体分工。
六、科研保密及知识产权保护声明请就科研保密和知识产权保护方面做出明确的声明,确保研究成果的合法性和权益保护。
七、参考文献请列出参考文献,确保研究计划的科学性和可靠性。
以上为临床实验方案申请表的内容,申请人请按照表格要求填写相关信息,并提交至相关部门审核。
祝您申请成功,研究顺利!。

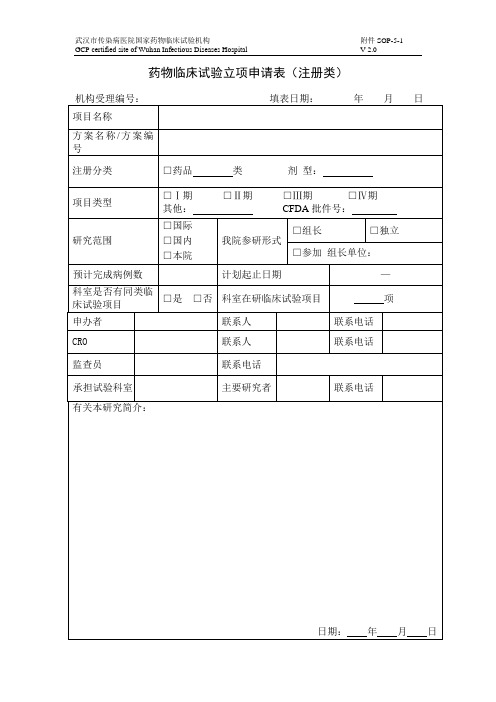
临床试验申请表(申办者)申请日期:年月日机构受理号(由GCP办公室填写):项目名称类别(请在□内划×)□药物临床试验(□中药□化学药□生物制品□其他)注册分类:临床试验分期:□Ⅱ期□Ⅲ期□Ⅳ期□其他□医疗器械临床试验,注册分类:□诊断试剂临床试验试剂种类:□二类□三类□其他试验分类:□新研制体外诊断试剂□已有同品种批准上市产品□变更申请□进口注册产品□研究者发起的临床试验,资助情况:□其他申办单位批件号临床研究预期起止时间参加试验的中心数组长单位组长单位主要研究者本机构研究科室本机构主要研究者本研究的总病例数本机构拟承担病例数备案资料目录(请在口内划×):1.资料目录2.临床试验申请表(申办者)3.国家食品药品监督管理局临床试验批件或注册批件4.申办单位委托本机构开展临床试验的委托书5.若药物临床试验批件的申请人与委托本机构的申办单位不一致时,提供转让合同等相关证明文件6.申办者资质证明(企业法人营业执照、组织机构代码证等)7.药品生产许可证8.药品生产GMP证书9.申办者对CRO的委托函10.CRO资质证明11.监查员的介绍信(附身份证复印件和GCP培训证书复印件)12.试验药物及对照药检验合格报告13.研究者手册(版本号/日期)14.临床研究方案(版本号/日期)15.知情同意书(版本号/日期)16.研究病历(版本号/日期)17.病例报告表(版本号/日期)18.保险声明19.组长单位伦理委员会批件(若本中心为参加单位)20.各参加研究单位及主要研究者名单21. 自我提交资料的真实性保证申明及承担法律责任的承诺22.药品超温说明23.中心实验室资质(如需要)24.其他资料(注明)□□□□□□□□□□□□□□□□□□□□□□□□第1页共2页主要研究内容监查员:联系电话:传真:填表人签名(签字盖章有效):日期:以下由GCP办公室填写GCP办公室秘书审核资料签署意见签名日期GCP办公室主任签署意见签名日期机构副主任签署意见签名日期机构主任签署意见签名日期备注:表格填写不得空项,共2页,双面打印,填表人签名签日期,加盖申办者公章后,交至GCP 办公室。