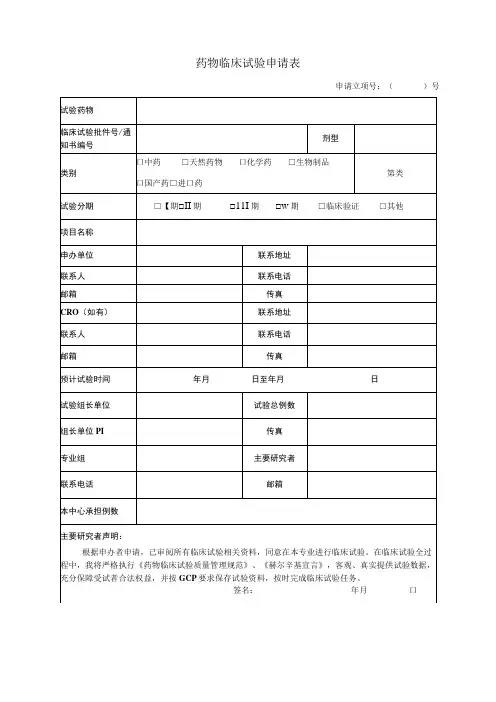
药物临床试验申请表 (2)
- 格式:doc
- 大小:26.50 KB
- 文档页数:1

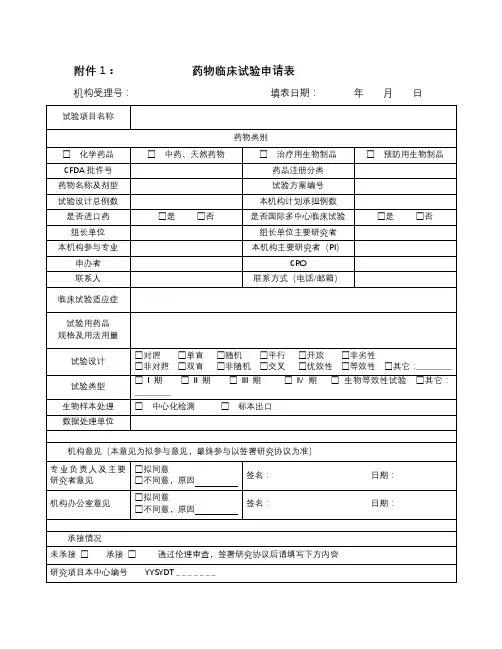

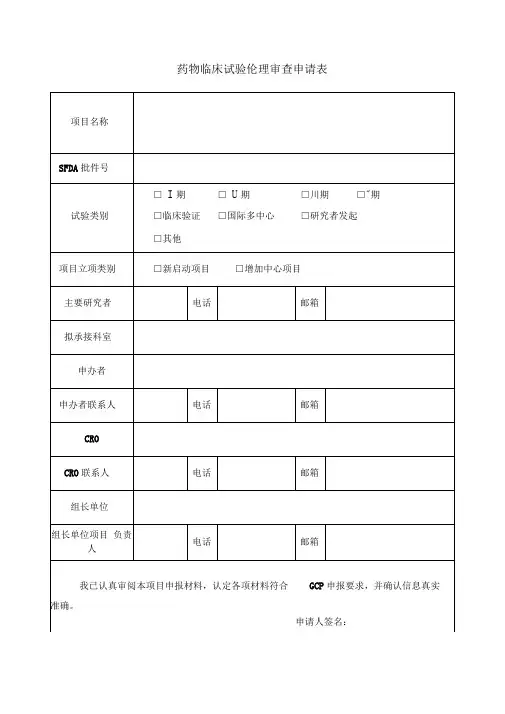
临床试验申请表(申办者)申请日期:年月日机构受理号(由GCP办公室填写):项目名称类别(请在□内划×)□药物临床试验(□中药□化学药□生物制品□其他)注册分类:临床试验分期:□Ⅱ期□Ⅲ期□Ⅳ期□其他□医疗器械临床试验,注册分类:□诊断试剂临床试验试剂种类:□二类□三类□其他试验分类:□新研制体外诊断试剂□已有同品种批准上市产品□变更申请□进口注册产品□研究者发起的临床试验,资助情况:□其他申办单位批件号临床研究预期起止时间参加试验的中心数组长单位组长单位主要研究者本机构研究科室本机构主要研究者本研究的总病例数本机构拟承担病例数备案资料目录(请在口内划×):1.资料目录2.临床试验申请表(申办者)3.国家食品药品监督管理局临床试验批件或注册批件4.申办单位委托本机构开展临床试验的委托书5.若药物临床试验批件的申请人与委托本机构的申办单位不一致时,提供转让合同等相关证明文件6.申办者资质证明(企业法人营业执照、组织机构代码证等)7.药品生产许可证8.药品生产GMP证书9.申办者对CRO的委托函10.CRO资质证明11.监查员的介绍信(附身份证复印件和GCP培训证书复印件)12.试验药物及对照药检验合格报告13.研究者手册(版本号/日期)14.临床研究方案(版本号/日期)15.知情同意书(版本号/日期)16.研究病历(版本号/日期)17.病例报告表(版本号/日期)18.保险声明19.组长单位伦理委员会批件(若本中心为参加单位)20.各参加研究单位及主要研究者名单21. 自我提交资料的真实性保证申明及承担法律责任的承诺22.药品超温说明23.中心实验室资质(如需要)24.其他资料(注明)□□□□□□□□□□□□□□□□□□□□□□□□第1页共2页主要研究内容监查员:联系电话:传真:填表人签名(签字盖章有效):日期:以下由GCP办公室填写GCP办公室秘书审核资料签署意见签名日期GCP办公室主任签署意见签名日期机构副主任签署意见签名日期机构主任签署意见签名日期备注:表格填写不得空项,共2页,双面打印,填表人签名签日期,加盖申办者公章后,交至GCP 办公室。
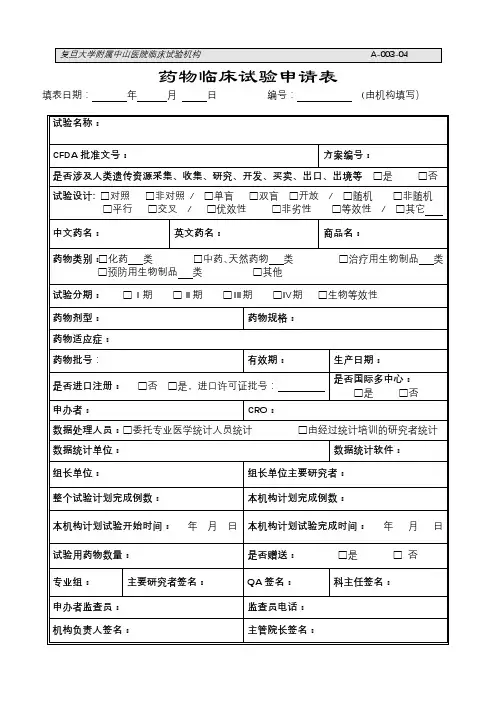
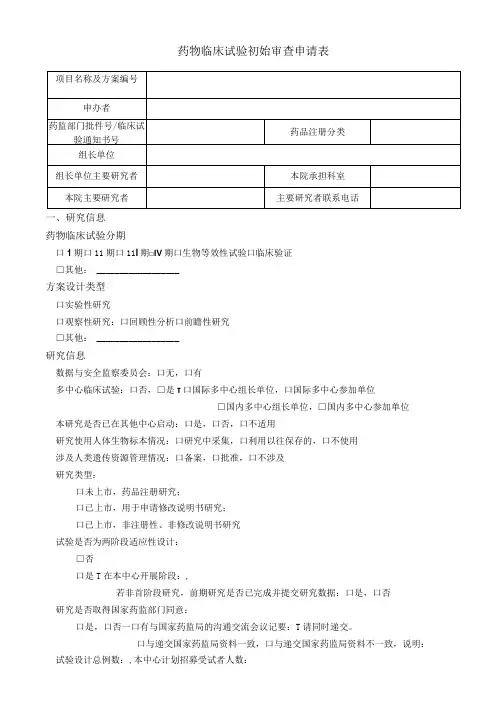
药物临床试验初始审查申请表一、研究信息药物临床试验分期口1期口11期口11I期□IV期口生物等效性试验口临床验证□其他: __________________方案设计类型口实验性研究口观察性研究:口回顾性分析口前瞻性研究□其他: __________________研究信息数据与安全监察委员会:口无,口有多中心临床试验:口否,□是τ口国际多中心组长单位,口国际多中心参加单位□国内多中心组长单位,□国内多中心参加单位本研究是否已在其他中心启动:口是,口否,口不适用研究使用人体生物标本情况:口研究中采集,口利用以往保存的,口不使用涉及人类遗传资源管理情况:口备案,口批准,口不涉及研究类型:口未上市,药品注册研究;口已上市,用于申请修改说明书研究;口已上市,非注册性、非修改说明书研究试验是否为两阶段适应性设计:□否口是T在本中心开展阶段:,若非首阶段研究,前期研究是否已完成并提交研究数据:口是,口否研究是否取得国家药监部门同意:口是,口否一口有与国家药监局的沟通交流会议记要:T请同时递交。
口与递交国家药监局资料一致,口与递交国家药监局资料不一致,说明:试验设计总例数:,本中心计划招募受试者人数:预期研究时间:年月至年月(伦理收费及批准研究时间以此为准)招募方式及人群招募者:口医生,口研究人员,口中介公司,口其他:招募方式:口发布招募广告,口临床诊疗过程,口数据库,□其他:研究是否涉及弱势人群或个体:□否口是T弱势的具体特征:________________________________________________________ 针对性的附加保护措施:__________________________________________________ 受试者补偿和支付计划口无补偿口有补偿:口货币补偿,补偿理由及数额:_____________________________________________ 口非货币补偿,说明:____________________________________________________ 支付计划(请详细描述发放周期及流程):受试者参与研究的费用谁支付研究干预和研究程序的费用:研究药物费用支付者:□申办者,口受试者,口其他:研究理化检查费用支付者:□申办者,口受试者,口其他:其他,说明:____________________________________________________________知情同意谁获取知情同意:口主要研究者,口研究者,口其他:获取知情同意地点:口私密房间/受试者接待室,口诊室,口病房,口其他:知情同意签字:口受试者签字,口监护人签字知情同意的例外口否,口是τ口申请变更知情同意,口申请豁免知情同意理由: _______________________________________________________________ 研究者其他研究工作本人在研的研究项目数:—项,其中与本项目目标疾病相同的项目数:一项。


尊敬的药品审评中心:您好!我代表我国某家药品研发企业,向您提交关于新药临床试验申请的文件。
请您在百忙之中抽空审阅,并给予我们宝贵的意见。
一、药物基本信息1. 药物名称:XXX2. 药物类型:XXX3. 药物剂型:XXX4. 药物规格:XXX5. 适应症:XXX6. 研发阶段:已完成前期基础研究和临床试验Ⅰ期、Ⅱ期,现申请临床试验Ⅲ期。
二、药物研发背景及意义1. 药物研发背景:针对当前临床上XXX疾病的治疗需求,我们企业历经多年研发,成功制备出该药物。
通过前期临床试验,证实了该药物在治疗XXX疾病方面具有显著疗效。
2. 药物研发意义:该药物的上市将填补我国XXX领域治疗的空白,为患者提供一种全新的治疗手段,提高患者的生活质量。
同时,有助于推动我国药品产业的创新与发展。
三、临床试验方案1. 临床试验目的:验证该药物在治疗XXX疾病方面的疗效和安全性。
2. 临床试验设计:随机、双盲、安慰剂对照、多中心临床试验。
3. 临床试验规模:预计纳入XXX例患者。
4. 临床试验分期:临床试验Ⅲ期。
5. 临床试验主要终点:XXX6. 临床试验次要终点:XXX7. 临床试验安全性评价:对药物不良反应进行监测和评估。
四、临床试验基地及研究者1. 临床试验基地:选取具有丰富临床试验经验的医疗机构作为临床试验基地。
2. 研究者:具有相关专业背景和临床试验经验的医生担任研究者。
五、药物生产及质量保证1. 药物生产:在符合我国药品生产质量管理规范(GMP)的工厂进行生产。
2. 质量保证:对药物的生产过程、质量控制和临床试验过程中涉及的各个环节进行严格监控,确保药物的质量和安全性。
六、资金保障1. 临床试验费用:预计临床试验费用为XXX万元,已充分准备资金保障。
2. 保险:为临床试验参与者购买人身意外伤害保险。
七、临床试验时间表1. 临床试验启动时间:XXX2. 临床试验完成时间:XXX3. 药品上市申请时间:XXX八、申请结论综上所述,我们企业郑重申请开展该药物的临床试验Ⅲ期,以验证其疗效和安全性。
药物临床试验申请表
一、项目名称:
试验类别:Ⅰ期 Ⅱ期 Ⅲ期 Ⅳ期 生物利用度□再评价□其他临床试验批文号:
是否是国际多中心试验: 是 否
是否获重大项目资助:
二、试验用药物
1.试验药物
中文名:
英文名:
商品名:
剂型及规格:
2.对照药物
中文名:
英文名:
商品名:
剂型及规格:
三、申办方/CRO
申办单位/CRO名称:
联系人姓名:职务/职称:
联系电话/传真/手机
Email:
四、项目团队
项目负责人:N/A 职务/职称:N/A
专业:N/A
参加项目主要人员:
CRC:联系方式:
是否为项目组长单位:是 否 (如选择否请注明组长单位名称及负责人) N/A 五、试验方案要点
试验方案编号:
随机分配方法:
随机号分配方法:
试验配置:盲法:
项目总例数:本中心例数:
预期开始/完成日期:
适应症:
禁忌症:
六、给药方案
七、受试者知情同意关键信息是否完整
是 否
八、可能出现的不良反应
九、对不良事件的相应防治措施
十、项目负责人承诺
项目负责人(签名):
日期:十一、专业负责人(签名):
日期:十二、机构意见
日期:。