论原子核外电子的运动轨道
- 格式:doc
- 大小:59.00 KB
- 文档页数:11

结构理论(一)核外电子的运动状态和排布规律围绕在原子核外作高速运动的电子,有它特殊的运动状态。
早在本世纪初,科学实验已证明了电子是一种质量为9.11×10-28g的微小粒子,证明了电子的运动具有粒子性。
但是,以后科学实验又证明了电子的运动和光、X射线一样具有波动性。
这就是说,电子的运动具有波粒二象性。
电子运动的这种波粒二象性,使它难以用经典物理学的一些基本定律来描述。
现代研究核外电子运动状态的理论叫做原子波动力学。
它是在上世纪20年代末由奥地利物理学家薛定谔等人发展起来的。
它的基本方面是一些复杂的数学波动方程,叫做薛定谔方程。
核外电子的运动正是通过计算薛定谔方程的解来加以描述的。
这里,我们只能按照原子波动力学的基本观点,初步形象地去认识核外电子的运动状态,从而再寻找出原子核外电子的排布有着怎样的规律。
一、电子云在描绘核外电子运动时,只能指出它在原子核外空间各处出现机会的多少。
电子在核外空间一定范围内出现,好像是带负电荷的云雾笼罩在原子核的周围。
可以形象地称它为“电子云”。
核外电子出现机会愈多的区域,电子云的密度愈大。
下图描绘了氢原子处于基态时的电子云。
氢原子核外只有1个电子,图中的“雾状”,说明氢原子核外电子在一个球形的空间里作高速运动。
图中表示,黑点密集处是电子出现机会多的地方,黑点稀疏处是电子出现机会少的地方。
二、描述核外电子运动状态的四个方面对于原子核外的每一个电子的运动状态,都可以从以下四个方面来描述。
1.电子层原子核外的电子可以看作是分层排布的。
处于不同层次中的电子,离核的远近也不同。
离核愈近的电子层能量愈低,离核愈远的电子层能量愈高。
通常用n=1、2、3…等数值来表示电子层离核的远近。
n=1,即表示离核最近的电子层,其中的电子能量最小。
n=2,即表示为第二电子层。
有时也用K、L、M、N、O等分别表示1、2、3、4、5等电子层。
我们怎么知道含有多个电子的原子里核外电子的能量并不相同呢?根据对元素电离能数据的分析,可以初步得到这个结论。

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K 层为最外层时不能超过2个)次外层最多只能容纳18个电子(K 层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH 、N 、NH 、NH 、NH 、O、OH 、H O 、H O 、F 、HF 、Ne 、Na 、Mg 、Al 等。
4-3-23+4-2-23+-++2+3 ②18电子粒子:SiH 、P 、PH 、S 、HS 、H S 、Cl 、HCl 、Ar 、K 、Ca 、PH 等。
4-33-2-2-++2+4 特殊情况:F 、H O 、C H 、CH OH222263 ③核外电子总数及质子总数均相同的阳离子有:Na 、NH 、H O 等;阴离子有:++43+F 、OH 、NH ; HS 、Cl 等。
---2--前18号元素原子结构的特殊性:(1)原子核中无中子的原子:H11(2)最外层有1个电子的元素:H 、 Li 、Na ;最外层有2个电子的元素:Be 、Mg 、He(3)最外层电子总数等于次外层电子数的元素:Be 、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li 、P(6)电子层数与最外层电子数相等的元素:H 、Be 、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li 、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He 例外)(2)在元素周期表中,同周期的ⅡA、ⅢA 族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。


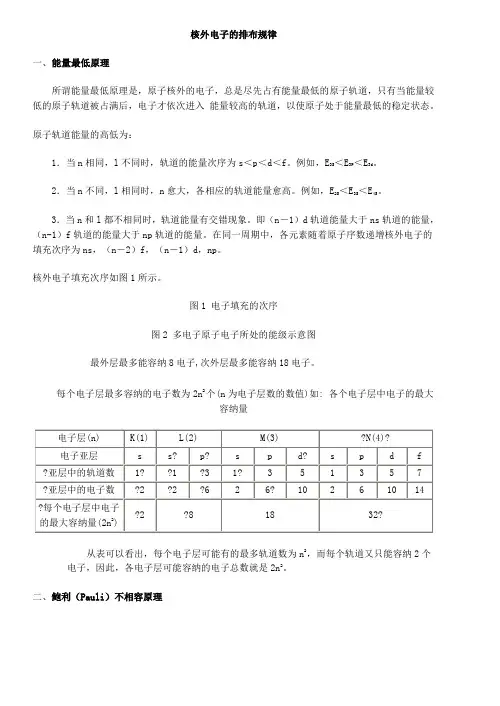
核外电子的排布规律一、能量最低原理所谓能量最低原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:1.当n相同,l不同时,轨道的能量次序为s<p<d<f。
例如,E3S<E3P<E3d。
2.当n不同,l相同时,n愈大,各相应的轨道能量愈高。
例如,E2S<E3S<E4S。
3.当n和l都不相同时,轨道能量有交错现象。
即(n-1)d轨道能量大于ns轨道的能量,(n-1)f轨道的能量大于np轨道的能量。
在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n-2)f,(n-1)d,np。
核外电子填充次序如图1所示。
图1 电子填充的次序图2 多电子原子电子所处的能级示意图最外层最多能容纳8电子,次外层最多能容纳18电子。
每个电子层最多容纳的电子数为2n2个(n为电子层数的数值)如: 各个电子层中电子的最大容纳量从表可以看出,每个电子层可能有的最多轨道数为n2,而每个轨道又只能容纳2个电子,因此,各电子层可能容纳的电子总数就是2n2。
二、鲍利(Pauli)不相容原理鲍利不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。
根据鲍利不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。
于是,不难推算出各电子层最多容纳的电子数为2n2个。
例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子,见下表。
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。

原子核外电子的空间运动状态原子核外电子的空间运动状态:(一)电子轨道1、电子轨道是电子沿着原子核外围运动的一条椭圆形轨迹。
这条椭圆形轨迹完全由电子和核间的电磁场相互作用决定。
2、电子轨道的轨道角动量是指电子在原子核外围空间运动的时候的角动量,它可以通过电磁场的膜位能准确的确定出来。
3、电子轨道的运动状态就是指电子在轨道中的运动状态,包括了单重态的电子轨道运动状态,以及双重态的电子轨道运动状态和三重态的电子轨道运动状态等。
(二)电子自旋1、电子自旋是电子在空间中自身运动的一个特征,通俗来说就是电子在原子核外围空间中以固定的角速度运动。
2、电子自旋具有两个独立的特性,即电子的线性自旋,也就是说电子的运动方向不断变化;另一个就是电子的角速度自旋,也就是说电子的具体自旋方向会一直保持不变。
3、自旋的结构包括两个自旋态,一个是有磁态,即自由自旋,它没有内部能量变化;对应的还有无磁态,即锁定自旋,它有内部能量变化。
(三)电子跃迁1、电子跃迁是指电子在原子核外围空间中运动时从一个轨道状态跃到另一个空间状态的过程,电子跃迁中包括了单重态电子跃迁,双重态电子跃迁和三重态电子跃迁等等。
2、电子跃迁的机理一般是由电磁场的膜位能决定的,这也是电子跃迁过程发生的根本原因。
电子跃迁过程中,电子原先处在的低能量状态会被电磁场膜位能引导,由低能量跃到其他的高能量状态之中。
3、电子跃迁过程还会受到外界的干扰,包括光辐射,热辐射等,外界的干扰可以使原子中电子从一个轨道跃到另一个轨道或空间状态,从而使原子转变为激发态,从而发生一系列使原子性质发生变化的现象。





核外电子原子结构在物质世界中,原子是构成一切物质的基本单位。
然而,原子并非是简单的质点,而是由不同的粒子组成的复杂结构。
其中,核外电子原子结构是原子的重要组成部分,它决定了原子的化学性质和行为。
电子的运动轨道在原子结构中,核外电子围绕着原子核运动,形成电子的运动轨道。
根据量子力学的原理,电子不能沿任意轨道运动,而是存在着一定的能量级别和轨道结构。
在原子的基本态中,电子能占据的轨道是有限的,称为主能级。
每个主能级可以进一步分为不同的子能级,代表着电子在不同的空间区域运动。
原子的壳层结构核外电子原子结构还表现为原子的壳层结构。
根据电子在主能级和子能级的分布情况,原子的壳层可以分为K、L、M、N等不同的壳层,每个壳层有不同数量的子能级。
其中,第一壳层K包含最内层的电子,依次向外排列。
每个壳层或子能级最多可以容纳一定数量的电子,根据泡利不相容原理,同一子能级中的电子自旋量子数必须相反。
电子的轨道角动量电子在原子内的运动并不仅仅是沿轨道转动,还具有轨道角动量。
轨道角动量与电子运动轨道的几何形状和运动速度有关,可以通过角动量量子数进行描述。
轨道角动量的量子化表现为电子只能存在于特定的轨道能级,并且具有不同的角动量量子数对应不同的轨道形状。
电子的自旋除了轨道角动量外,电子还具有自旋角动量。
自旋角动量是电子固有的性质,类似于电子围绕自身旋转。
每个电子都有自旋量子数,通常用1/2表示,自旋量子数可以为±1/2。
自旋角动量对电子的磁性质和能级结构也有一定影响。
原子中的电子排布规则在填充电子时,原子中的电子遵循一定的排布规则,如洪特规则、帕利规则和毛维尔规则等。
这些规则指导着电子在壳层和子能级中的分布方式,确保原子的稳定和化学性质。
通过了解这些规则,可以预测和解释原子的反应性和结构特性。
综上所述,核外电子原子结构是描述原子内部电子分布和运动状态的重要概念,它不仅影响着原子的化学性质,还对物质的性质和行为产生深远影响。
原子核外电子运动规律
原子核外电子是构成物质的基本粒子,它们的运动规律已经成为学前教育中不
可或缺的课程内容。
原子核外电子的运动可以用谐振模型来描述,其运动轨迹为圆形椭圆或者柱面角的轨道。
传统的表示方法是用箭头的形式。
比如,在原子中,最外层的电子由n核外椭圆轨道组成,它们之间交错组合,每个椭圆轨道就是一个箭头,表示着电子运动的轨道。
有人也学习新概念,把原子外电子轨道称为电子场和电子云,即一组电子,以
不同的频率运动,构成一个电子球。
这些电子沿着原子外部运动,它们绕着原子核旋转,互相引力和斥力,在这样的活动中,它们以频率和振幅特定的谐振节奏表达出自己的图景。
电子的运动是按照确定的规律进行的,它是定性的,而不是定量的。
在学前教育中,结合实验教学,让学生通过动态实物模型来感受这种运动规律,将有助于提高学生对物质本质的理解。
另外,为了更深入地理解电子外部运动的规律,学前学生可以学习相关的电磁
学和量子力学内容,了解电子的行为与基本力学定律的关系,量子力学解释了电子以不断变化的方式运动的规律,因此,学习量子力学中的知识,能够更好地理解原子核外电子的运动。
综上所述,原子核外电子运动的规律在学前教育中是不可或缺的课程内容,而
实物实验结合理论知识,可以帮助学生更好地理解原子核外电子的运动规律。
希望学前教师在课堂中及时引导学生思考,培养学生深入探究物质世界的热情。
原子结构核外电子排布原子是构成物质的基本粒子,由原子核和核外电子组成。
原子的核心包含质子和中子,而电子则以轨道的方式绕核心运动。
核外电子的排布对原子的化学性质和化合能力产生重要影响。
以下是关于原子结构核外电子排布的详细介绍。
在经典的玻尔理论中,电子的排布被描述为沿不同轨道(也称为能级)绕核心旋转。
每个能级最多能容纳一定数量的电子,根据波尔理论,每个能级上的电子数量可以用以下公式计算:2n²(n为能级的编号)根据这个公式,第一能级(最靠近原子核的能级)最多可以容纳2个电子,第二能级最多可以容纳8个电子,第三能级最多可以容纳18个电子,以此类推。
这个公式说明了为什么特定能级上的电子数量不同。
然而,随着量子力学的发展,人们意识到玻尔理论只能部分解释原子结构。
量子力学描述了电子运动的波动性质,并引入了概率密度的概念,用来描述电子在不同位置出现的可能性。
根据量子力学,电子不能准确地被定位在轨道上的一些点上,而是存在于一个电子云中。
电子云是描述电子出现概率分布的三维区域,具有不同概率密度的区域对应着不同的轨道形状。
根据不同的轨道形状,电子的能量也不同。
主要能级被标记为1,2,3...,并由字母s,p,d,f等来表示不同的子能级。
每个主要能级的子能级又分别由s,p,d,f等轨道来区分。
s轨道是最基本的,是球形对称的,最多能容纳2个电子。
每个能级的第一个子能级都是s轨道,即1s,2s,3s等。
p轨道是具有 dumbbell(哑铃形)形状的轨道,并且在空间中有不同的方向。
每个能级的第二个子能级都是p轨道,即2p,3p,4p等。
每个p轨道最多能容纳6个电子。
d轨道是复杂的轨道形状,涉及到更多的区域和方向。
每个能级的第三个子能级都是d轨道,即3d,4d,5d等。
每个d轨道最多能容纳10个电子。
f轨道是更复杂的轨道形状,涉及到更多的区域和方向。
每个能级的第四个子能级都是f轨道,即4f,5f等。
每个f轨道最多能容纳14个电子。
核外电子运动状态标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]ZK 高一化学K1 第四讲一、【知识梳理】 电子在原子核外很小的空间内作高速运动,其运动规律跟一般物体不同,它们没有确定的轨道。
因此,我们不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描画出它的运动轨迹。
那么,如何描述原子核外电子的运动状态呢?一、电子云科学上应用统计的原理,以每一个电子在原子核外空间某处出现机会的多少,来描述原子核外电子运动状态。
电子在核外空间一定范围内出现,好象带负电荷的云雾笼罩在原子核的周围,所以我们形象地称它为“电子云”。
见下图。
在电子云示意图中,小黑点表示电子出现的次数,小黑疏密(电子云密度)表示电子出现的几率。
氢原子电子云:①球形;②离核近,电子云密度大,表示电子出现几率大;③离核远,电子云密度小,表示电子出现几率小。
为了便于理解,我们假想有一架特殊的照相机给氢原子照相。
先给某个氢原子拍五张照片,得到下图所示的不同的图象。
图中⊕表示原子核,一个小黑点表示电子在这里出现一次。
给氢原子拍上成千上万张照片,研究每一张照片会使我们获得这现。
如果我们将这些照片叠印,就会看到如图所示的图象。
图象说明,对氢原子的照片叠印张数越多,就越能使人形成一团电子云雾笼罩原子核的印象,这团原子核外电子的运动状态可以从四个方面进行描述:1.电子层在含有多个电子的原子里,电子的能量并不相同,电子运动的区域也不相同,能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。
根据电子的能量差异和通常运动区域离核的远近不同,可以将核外电子分成不同电子层。
离核最近的为第一层,离核稍远的为第二层,依次类推,由近及远为三、四、五、六、七层,用符号K、L、M、N、O、P、Q表示。
2.电子亚层和电子云的形状科学研究发现,在同一电子层中,电子的能量还稍有差别,电子云的形状也不相同。
根据这个差别,又可以把一个电子层分成一个或几个亚层,分别用s、p、d、f等符号表示。
原子轨道就是原子核外电子运动的轨道下列关于原子轨道的叙述中,正确的是()A.原子轨道就是原子核外电子运动的轨道,这与宏观物体运动轨道的含义相同B.第n电子层上共有n2+1个原子轨道C.任意电子层上的p能级都有3个伸展方向相互垂直的原子轨道D.处于同一原子轨道上的电子,运动状态完全相同答案:C原子轨道,又称轨函,物理学术语,是以数学函数描述原子中电子似波行为。
此波函数可用来计算在原子核外的特定空间中,找到原子中电子的几率,并指出电子在三维空间中的可能位置。
“轨道”便是指在波函数界定下,电子在原子核外空间出现机率较大的区域。
具体而言,原子轨道是在环绕着一个原子的许多电子(电子云)中,个别电子可能的量子态,并以轨道波函数描述。
原子轨道是单电子薛定谔方程的合理解ψ(x,y,z)。
若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。
现今普遍公认的原子结构是玻尔原子模型:电子像行星,绕着原子核(太阳)运行。
然而,电子不能被视为形状固定的固体粒子,原子轨道也不像行星的椭圆形轨道。
更精确的比喻应是,大范围且形状特殊的“大气”(电子),分布于极小的星球(原子核)四周。
只有原子中存在唯一电子时,原子轨道才能精准符合“大气”的形状。
当原子中有越来越多电子时,电子越倾向均匀分布在原子核四周的空间体积中,因此“电子云”越倾向分布在特定球形区域内(区域内电子出现机率较高)。
[1][2]早在1904年,日本物理学家长冈半太郎首度发表电子以类似环绕轨道的方式在原子内运转的想法。
1913年,丹麦物理学家尼尔斯·玻尔提出理论,主张电子以固定的角动量环绕着体积极小的原子核运行。
然而,一直到1926年、量子力学发展后,薛定谔方程才解释了原子中的电子波动,定下关于新概念“轨道”的函数。
核外电子运动状态的描述2-2 核外电子运动状态的描述一、波函数和原子轨道1.波动方程描述宏观物体运动状态的状态方程F=ma,即牛顿第二定律。
那么对微观粒子的运动,能不能也有个状态方程呢?1926年,奥地利物理学家薛定谔根据德布罗依预言,提出了描述微观粒子运动状态的波动方程,称为薛定谔方程其基本形式是:这是个高等数学中的二阶偏微分方程,式中x、y、z为粒子在空间的直角坐标,m可近似看作是电子质量,E为总能量即电子的动能和势能之和,V是势能即核与电子的吸引能,ψ为方程的解(ψ是希腊字母,读做普赛[Psi])。
薛定谔方程是用来描述质量为m的微观粒子,在势能为V的势场中运动,其运动状态和能量关系的定态方程。
因为薛定谔方程的每一合理的解ψ,都表示该粒子运动的某一稳定状态,与这个解相应的常数E,就是粒子处于这个稳定状态的能量。
由于有很多解,说明具有多种运动状态。
对于一定体系,能量最低的状态称为基态,能量较高的状态称为激发态。
粒子由一个状态跃迁到另一状态,能量的改变量是一定的,不能取任意的数值,即能量是量子化的由于薛定谔方程是高等数学中一个微分方程,与初等数学中方程不同,它的解ψ不是一些数而是些函数。
它是波的振幅与坐标的函数,因此称作波函数。
2.波函数(ψ)如上所述,波函数ψ就是薛定谔方程的解,是描述核外电子空间运动状态的数学函数式。
如同一般函数式有常量和变量一样,它包含三个常量和三个变量,它的一般形式为式中n、l、m为三个常量,x、y、z为三个变量。
电子在核外运动,有一系列空间运动状态。
每一特定状态就有一个相应的波函数ψ和相应的能量E。
如有1s、2s、2p、3d、4f……等等核外空间状态,就有ψ1s、ψ2s、ψ2p、ψ3d、ψ4f……和E1s、E2s、E2p、E3d、E4f……与其相对应。
或者说一个确定的波函数ψ就代表着核外电子的一个空间运动状态,电子处于这个空间状态运动时就具有确定的能量和其它一些相应的物理量。
论原子核外电子的运动轨道2010-02-19 11:30论原子核外电子的运动轨道广东博罗高级中学(516100)林海兵摘要:原子核外电子的运动轨道是一个个圆,任何一层电子的轨道都是如此,它并不像化学所说那样具有球的s形轨道,还有纺锤形的p形轨道,更有说不清形状的d、f形轨道。
电子并没有什么自旋。
关键词:原子核,核外电子,运动轨道自从卢瑟福用粒子散射实验证明了原子的核式模型之后,人们对于原子核与核外电子的情况又提出了许多理论,如玻尔关于原子核外电子运动的原子模型,泡利关于电子运动轨道的泡利不相容原理,门捷列夫的元素周期率……这一系列理论的提出,为现代的化学理论奠定了坚实的基础。
1 原子结构与核外电子的运动轨道泡利认为,每一个电子都有一定的自旋。
在同一条电子轨道上最多只允许容纳两个不同自旋的电子。
这就是泡利不相容原理。
经典化学认为,原子核外电子的运动轨道是分层的,比如一个氪原子的核外电子就分为四层,第一层(即最内层)有2个电子,第二层有8个,第三层有18个,第四层有8个。
而在每一层中,还分成各个亚层,氪原子的第一层只有一个S亚层,第二层则有两个亚层,即S亚层与P亚层,而第三层有三个亚层,即S、P、d亚层,最外层有两个亚层,即S、P亚层。
经典化学认为,在每一个亚层都具有一定的电子轨道数量,如S亚层只有1条圆的轨道,而P亚层有3条纺锤形的轨道,d亚层则有5条,f亚层有7条。
经典化学还认为,其实这些所谓的轨道并不真正的确定的轨道,而是电子在运动过程中出现机会最大的地方,电子在运动过程中,总是出现在轨道附近的一定的空间范围内,这个空间范围就是人们所说的电子云。
经典化学还认为,由于各亚层的电子云形成并不相同,大小也不相同,这可能造成各亚层甚至是不同电子层的电子云相互交叠的情况。
……2 疑惑笔者并不怎么理解“电子自旋”的含义——是不是好象地球的自转运动一样,它是一种电子的自转运动,电子象自地球一样在绕中心公转时可以发生逆时针的自转也可以发生顺时针的自转;又是否表示电子的自身结构,因为笔者在某些书籍上见到过关于电子的结构的论述,这些论述就把电子描述成具有类似于螺杆的螺旋一样的结构,所以,电子也有左旋电子也有右旋电子。
在两种理解之中,第一种描述的是电子的运动,第二种描述的是电子的结构。
笔者还是不理解各种形状的电子亚层,如果有这样的一些电子亚层,就势必使各个亚层的电子云交叠,电子在运动过程中就一定会发生碰撞(必须注意的是,经典物理学与化学认为碰撞在粒子之间是一定存在的),就有可能形成许多不可预料的情况发生,就可能改变电子云原来的形状。
3 暗物质物理理论体系的观点需要说明的是,绝对平衡的环境是不存在的,但是,为了方便研究,笔者假设物体原子存在的环境就是一个绝对平衡的环境。
也就是说,电子在原子核外的运动环境只有原子核形成的阳性子密度梯度场,如果电子的运动速度一定,则它将运动于确定的相应半径的轨道上,并不会形成所谓的电子云。
3.1 电荷的形成我们可以从原子的形成过程来讨论这个问题。
事实上,原子核与电子的荷核都有相同的成份构成,它们都形成于整体天体中心。
笔者认为,在整体天体(如太阳、地球)的中心内部,暗物质中性子都处束缚状态的,这里的自由态中性子密度几乎为零,于是在空间形成了以整体天体内核为中心的自由态中性子的密度梯度场,这就是我们所说的重力场或者万有引力场,密度的不平衡导致了在此空间的中性子以及所有的宏观物体都具有向着整体天体中心的属性加速度。
暗物质中性子不断地向着整体天体中心发生运动,这使整体天体的质量随着时间的推移而增长。
到达天体中心的自由态中性子却发生了本质性的变化,从此变成为束缚态,笔者把整体天体内部的束缚态的中性子物质称为物体原态质,这些物体原态质并没有温度效应,随着时间的推移,自由态中性子在这里不断地变成了物体原态质,物体原态质的密度增大,产生了密度不平衡,于是某些物体原态质向着天体外部发生属性运动,笔者把这种运动称为喷射运动。
在喷射运动过程中,物体原态质分裂成大小不一的颗粒,大颗粒在喷射更容易改变环境,使环境物质产生与其运动方向相反的密度梯度不平衡,也使它自己受到了较大的“阻力”,在它还没有喷至天体表面时就已经静止下来,而颗粒子非常小的物体原态质则不同,它们则可以喷离天体表面,直到射到天体之外的高空。
另一方面,整体天体的内核也同时把其中一部分中性子分解成电性子,其中的阳性子则紧附在天体的整个物体原态球周围,并在这周围空间形成由里向外密度梯度,也就是说,整体天体的内核实际上相当于一个非常庞大的原子核;分解得到的阴性子则不断被排出天体之外。
那些向着天体外作喷射运动的物体原态质球在运动过程中,颗粒大的减速快,在天体内核附近已有大量的阳性子把它包围起来,并在它的周围形成了密度梯度。
于是它们变成了我们所说的原子核。
而那些颗粒小的减速慢,它们直射到高空才会静止下来,在整体天体之外的高空,阳性子密度很小,相对而言则有较大密度的阴性子,于是,这些粒子周围被阴性子包围起来,也形成了密度梯度,这些小颗粒便形成了电子。
3.2 电子绕核运动原子核与电子都形成于整体天体的喷射运动,而且由此过程可知,原子核与电子的形成位置并不相同,原子核形成于整体天体表面以内的空间,电子则形成于整体天体的高空,于是,在整体天体表面以外的空间区域,就有一个与球形电容器内部一般的电性子密度梯度场,当高空的电子积累到一定的数量,或者当空间的原子密度达到一定数值(比如水分子在空间达到饱和状态),电子便向着天体表面发生属性运动,电子穿越空间时,激发电性子、中性子以及空气分子从而产生了电磁波、光波与声波。
这就是打雷。
随着打雷,高空的电子落入天体表面,并进入一些表面上没有电子绕行的原子核的阳性子密度梯度场空间。
电子在原子核的阳性子密度场中作加速运动,当其速度达到某一数值,它在阳性子密度梯度场中的属性力恰好满足,电子便绕着原子核作匀速圆周运动。
如果原子核外空间只有一个电子,同时,除了阳性子密度梯度场之外再没有其他的不平衡因素,也不考虑电子的运动对环境影响,那么,电子应该在一个某固定的轨道上运动。
可是,即使满足不存在其他的不平衡因素,电子的运动对环境影响却是不可能不考虑的,电子的运动势必使本来平衡的环境不再平衡,环境最终发生变化,而变化之后的环境也影响电子的运动,使电子的运动速度减小。
这实际上就是电子在运动过程中激发电性子、中性子产生电磁波与光波。
随着电子速度的减小,其运动轨道半径也不断减小,最终落入原子核。
这是自然环境中只有原子核外的阳性子密度梯度场一种不平衡因素的情况,可自然界不可能如此,实际上除了这种不平衡因素之外,还同时存在着其他更多种类的不平衡因素,比如电磁波、光波等,这些因素的存在,使电子在运动时除了激发电磁波与光波之外,还总是在电磁波与光波的策动下运动,使之因策动得到的“能量”与激发失去的“能量”恰好相等,电子就处于一种动态平衡之中,它的运动轨道半径不再减小。
当原子核外电子从一个变为两个时,情况将发生本质的变化。
同样地,假设电子也只有原子核外的阳性子密度梯度一种不平衡,同时假设两个电子一先一后进入原子核的阳性子密度梯度场空间,先来到这个空间区域的电子,在其运动过程中会激发电性子、中性子的反抗振源运动,在其空间形成了速度旋度场,另一个电子进入时,便不再只有阳性子密度梯度不平衡,即第二个电子的运动环境已经是多种不平衡的合成环境。
如图1所示,一个电子正在绕原子核以速度v顺时针运动,图中的点与叉表示它激发电性子与中性子产生的速度旋度矢量的方向。
另一个电子从原子核外界空间开始进入原子核的阳性子密度梯度空间,它的初速度为u,由于它进入过程中,还受到速度旋度场不平衡的影响,故它在阳性子密度梯度场中加速时,还有一个速度旋度属性力f,这个属性力造成了电子的运动路径发生变化,向着与第一个电子运动方向相反的方向偏转,而且越来越接近第一个电子的运动轨道半径。
如图2所示。
由于两电子周围的都是阴性子密度梯度场,当它们靠得太近时,就产生了互斥作用,使两电子拉开一定的距离,如图3所示。
最终两个电子在半径相同的轨道上作方向相反的圆周运动,但是,这时的圆心已经不再是原子核中心,两个圆心分布在以原子核为中心的两个对称点上。
如果没有其他的外界不平衡因素的影响,这两个电子的运动环境是相同的,除了原子的阳性子密度梯度场环境之外,它们还运动于对方产生的速度旋度环境之中,我们分析它的运动情况。
如图4所示,我们右边的电子为研究对象,图中的曲线是左边电子运动产生的速度旋度环境,电子在运动时的属性力有原子核阳性子密度梯度环境的属性力F,与速度旋度环境的属性力f,它们合成的宏观属性力指向圆心。
由分析可知,F与f夹角是一个锐角,故它们合成的属性力一定大于F。
如果第一个电子在这个过程中的速度没有发生变化,那么,因为它的向心属性力增大,根据可知,所以电子的运动半径减小,向着电性子密度趋于平衡的方向运动。
原子温度下降,表现为吸热。
同时,我们可以看到,两个电子绕原子核的运动方向相反,它们产生的电性子与中性子的速度旋度方向相反,当两个电子的运动速度相等,轨道半径相同的时候,它们激发的速度旋度大小与相等,于是,两个旋度将完全抵消。
在原子外部并不表现出速度旋度或者磁场。
所以,两个电子绕原子核的运动过程相当于磁材料的去磁过程。
由上面的分析可知,原子核外只有一个电子与有两个电子的运动情形是完全不同的——①从电子的运动轨道半径来看,有两个电子时的轨道半径较小,电子可以朝着阳性子密度梯度的方向继续深入一段距离,更加趋于阴阳电性子的平衡状态;②从电子运动产生的不平衡来看,只有一个电子时,它的运动一定可以产生媒质粒子(如中性子、电性子)的速度旋度不平衡,甚至可以产生光波与电磁波,而有两个电子时,它们运动分别产生的速度旋度矢量方向相反,叠加后可以使外界环境的速度旋度减小甚至可以减小到零,它们运动激发产生光波与电磁波也恰好频率相同,相位相反,在外界空间叠加后,等于不曾激发光波与电磁波。
于是,我们清楚可见,两个自由电子在原子核外的运动是符合笔者在《论顺磁材料的磁化与去磁》一文中总结出来的物理学总定律——不平衡是宇宙物质分布的特点。
物体(粒子)总是向着环境趋于平衡的方向发生属性运动,在运动过程中不平衡的程度与种类将发生转化,在不同的局部区域空间,结果将可能出现:①相同程度的不平衡状态,②平衡状态,③比原来程度较小不平衡的状态,④比原来程度更大的不平衡状态。
当环境存在不同种类的不平衡时,物体将首先选择显能场方向的属性运动。
3.3 电子运动的轨道这样的一对电子运动轨道就是经典化学所说一条轨道,实际上更准确地应该称之为一对轨道,电子轨道成对的出现增加了其运动的稳定性,减小了它们运动对外界空间的影响。