第三章-化学反应速率理论
- 格式:ppt
- 大小:916.50 KB
- 文档页数:50

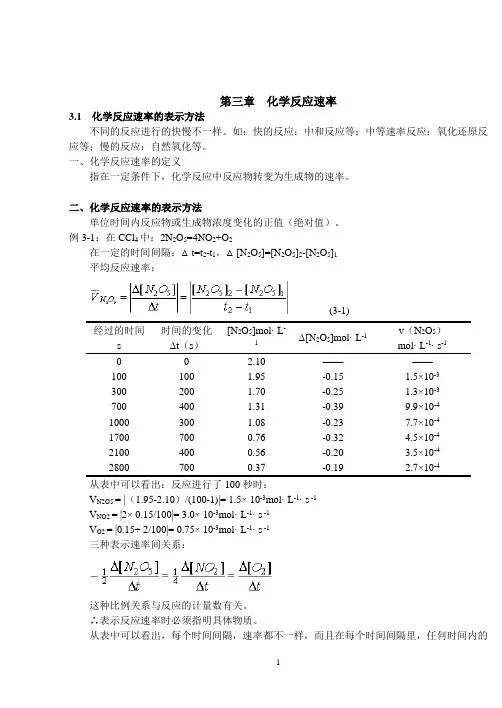
第三章化学反应速率3.1化学反应速率的表示方法不同的反应进行的快慢不一样。
如:快的反应:中和反应等;中等速率反应:氧化还原反应等;慢的反应:自然氧化等。
一、化学反应速率的定义指在一定条件下,化学反应中反应物转变为生成物的速率。
二、化学反应速率的表示方法单位时间内反应物或生成物浓度变化的正值(绝对值)。
例3-1:在CCl4中:2N2O5=4NO2+O2在一定的时间间隔:△t=t2-t1,△[N2O5]=[N2O5]2-[N2O5]1平均反应速率:(3-1)经过的时间s 时间的变化Δt(s)[N2O5]mol· L-1Δ[N2O5]mol· L-1v(N2O5)mol· L-1· s-10 0 2.10 ————100 100 1.95 -0.15 1.5×10-3300 200 1.70 -0.25 1.3×10-3700 400 1.31 -0.39 9.9×10-41000 300 1.08 -0.23 7.7×10-41700 700 0.76 -0.32 4.5×10-42100 400 0.56 -0.20 3.5×10-42800 700 0.37 -0.19 2.7×10-4从表中可以看出:反应进行了100秒时:V N2O5 = |(1.95-2.10)/(100-1)|= 1.5× 10-3mol· L-1· s -1V NO2 = |2× 0.15/100|= 3.0× 10-3mol· L-1· s -1V O2 = |0.15÷ 2/100|= 0.75× 10-3mol· L-1· s -1三种表示速率间关系:这种比例关系与反应的计量数有关。
∴表示反应速率时必须指明具体物质。









化学反应速率化学反应速率是指反应物质在单位时间内消耗或形成的量。
反应速率的大小与化学反应进行的快慢有关,可以通过实验来确定。
本文将介绍化学反应速率的概念、影响因素以及如何测量和调控反应速率。
一、化学反应速率的定义化学反应速率是指在单位时间内反应物质的消耗或生成速度。
一般用反应物浓度的变化量来表示,可以通过下式计算:反应速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间间隔。
反应速率越大,反应进行得越快,反之亦然。
二、影响化学反应速率的因素1. 浓度:反应物浓度越高,反应速率越快。
这是因为高浓度意味着反应物分子碰撞的几率增加,从而增加了反应速度。
2. 温度:温度升高会导致分子动能增加,分子碰撞频率增加,反应速率增加。
根据阿伦尼乌斯方程,温度每升高10摄氏度,反应速率会增加2倍至3倍。
3. 催化剂:催化剂是能够改变反应机理、降低活化能的物质。
添加催化剂可以提高反应速率,但催化剂本身在反应中不参与化学变化。
4. 表面积:反应物分子在固体表面上的反应速率比在液体中要快。
这是因为固体表面积大,反应物分子易于吸附在固体表面上进行反应。
三、测量和调控1. 实验测量:可以通过实验来确定反应速率。
例如,在固定温度下,测量反应物浓度随时间的变化,根据测得的数据计算反应速率。
2. 温度控制:调控反应温度可以改变反应速率。
通过改变温度,可以调节反应的快慢,实现对反应速率的控制。
3. 催化剂的使用:添加催化剂可以提高反应速率。
选择适当的催化剂,可以加快反应速度,提高反应效率。
4. 反应物浓度调节:调节反应物浓度也可以改变反应速率。
增加反应物浓度可以加快反应速率,减少浓度则相反。
结语化学反应速率是化学反应进行的快慢的量化指标,受多种因素影响。
了解化学反应速率的概念和影响因素,对于实际应用具有重要意义。
实验测量和调控反应速率是化学研究和工业生产中常用的手段,可以根据实际需要选择合适的方法来控制反应速率。