化学人教版高中选修4 化学反应原理《第三章 第二节 水的电离和溶液的酸碱性》章节知识点归纳
- 格式:doc
- 大小:118.00 KB
- 文档页数:2









《水的电离和溶液的酸碱性》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《水的电离和溶液的酸碱性》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析(一)教材的地位和作用“水的电离和溶液的酸碱性”是人教版高中化学选修 4《化学反应原理》第三章第二节的内容。
本节课是在学生已经学习了化学平衡和弱电解质的电离平衡等知识的基础上,进一步深入探讨水溶液中的离子平衡问题。
水的电离是弱电解质电离平衡的延伸和拓展,溶液的酸碱性则是水的电离平衡在实际中的应用。
通过本节课的学习,学生能够更加全面地理解水溶液中的离子行为,为后续学习盐类的水解等知识奠定基础。
(二)教学内容本节课主要包括水的电离、水的离子积常数、溶液的酸碱性与 pH 等内容。
其中,水的电离平衡是理解溶液酸碱性的关键,水的离子积常数则是定量描述水的电离程度的重要物理量,溶液的酸碱性与 pH 的关系则是将抽象的离子浓度转化为直观的数值,便于实际应用。
二、学情分析(一)知识基础学生在必修 1 中已经初步了解了溶液的酸碱性和 pH 的概念,在选修4 第一章和第二章中学习了化学平衡和弱电解质的电离平衡等知识,具备了一定的平衡思维和分析问题的能力。
(二)学习能力高二学生已经具备了较强的自主学习能力和一定的实验探究能力,但对于抽象的理论知识理解起来可能还存在一定的困难,需要通过具体的实例和实验来帮助他们理解。
(三)学习兴趣学生对于与生活实际密切相关的化学知识往往具有较高的学习兴趣,溶液的酸碱性在日常生活和工农业生产中有着广泛的应用,因此可以通过联系实际来激发学生的学习积极性。
三、教学目标(一)知识与技能目标1、理解水的电离平衡及其影响因素。
2、掌握水的离子积常数的表达式及意义。
3、了解溶液的酸碱性与 pH 的关系,能够进行 pH 的简单计算。
(二)过程与方法目标1、通过实验探究和数据分析,培养学生的观察能力、实验操作能力和数据分析能力。
第三章第二节水的电离和溶液的酸碱性
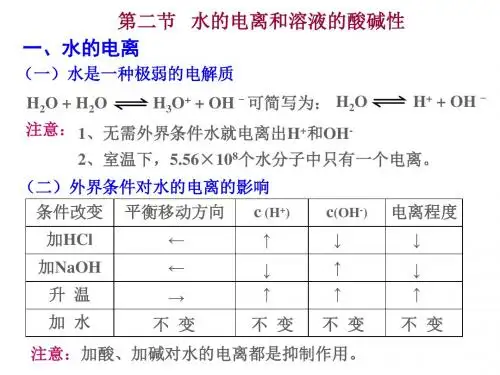
一、水的电离及水的离子积
1、水的电离
电离方程式:H2O+H2O H3O++OH-简写:H2O H++OH-
2、水的离子积常数
(1)表达式:K w=c(H+)·c(OH-)
常温下:K w=1.0×10-14,此时c(H+)=c(OH-)=1.0×10-7mol/L
(2)影响因素:K w随温度的变化而变化,温度升高,K w增大;温度降低,K w减小。
(3)适用范围:K w不仅适用于纯水,还适用于酸、碱、盐的稀溶液,且由水电离的c
水(H +)=c
水(OH
-)。
此时,水溶液中水的离子积常数不变。
(4)表达式的应用
K w表达式中,c(H+)、c(OH-)均表示整个溶液中相应离子总物质的量浓度。
但是一般情
况下有:
酸溶液中K w=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度)。
碱溶液中K w=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度)。
3、纯水电离的影响因素
(1)加入酸或碱,抑制水的电离,Kw不变;
(2)升高温度,电离过程是一个吸热过程,促进水的电离,水的离子积增大,在常温时,K W=1×10-14;在100℃时,K W=1×10-12。
注意:①任何水溶液中H+和OH-总是同时存在的,只是相对含量不同.
②K w大小只与温度有关,与是否为酸碱性溶液无关。
25℃时,K w =1×10-14
100℃时,K w =1×10-12
③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)
④根据Kw=C(H+)×C(OH-) 在温度一定时为定值,C(H+) 和C(OH-) 可以互求,酸性溶
液中水电离出来的c(H+)可以忽略、碱性溶液中水电离出来的OH-离子可以忽略;
二、溶液的酸碱性与pH
1、溶液的酸、碱性跟C(H+)、C(OH-)的关系
2、溶液的pH
(1)概念:用C(H+)的负对数表示溶液酸碱性的强弱。
(2)表达式:pH=-lgc(H+)
(3)溶液酸碱性与pH的关系:室温下,中性溶液:pH=7,酸性溶液pH<7,碱性溶液pH>7。
(4)意义:溶液的pH表示溶液酸碱性的强弱,pH越大则溶液的碱性越强,pH越小则溶液的酸性越强。
(5)pH测定方法:可用pH试纸测量,也可用pH计测量。
(引申:酸碱指示剂:酚酞、甲基橙、石蕊试液)
3、溶液pH的计算
(1)计算公式:pH=-lgc(H+)
(2)计算类型:
①酸性溶液由C(H+)直接求出pH
②强碱溶液由C(OH-)根据Kw求出C(H+) 再求pH
三、酸碱中和滴定
1、概念:酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或算)的实验方法。
2、原理:酸碱中和时,c(H+)·V酸==c(OH-)·V碱
3、实验仪器:酸式滴定管、碱式滴定管、铁架台、滴定管夹、锥形瓶。
4、实验步骤:
(1)准备工作:①检查仪器;②润洗仪器;③加反应液;④调节起始读数。
(2)滴定操作:(教材和导学案结合)
(3)数据处理:
(4)误差分析:哪些操作会引起误差,对结果造成什么影响。
(导学案名师点拨)。