最新人教版高中化学选修4 化学反应原理 第三章 第二节 水的电离和溶液的酸碱性(第3课时)
- 格式:ppt
- 大小:2.10 MB
- 文档页数:30



(人教版选修4)第三章《水溶液中的离子平衡》教学设计第二节水的电离和溶液的酸碱性(第二课时溶液pH的计算)【答案】 B【解析】 pH 计算方法为:酸按酸,碱按碱,酸碱混合看过量,无限稀释7为限。
稀释后A 项pH ≈7;B 项pH =9;C 项pH ≈9.7;D 项pH ≈7。
【板书】活动二、酸、碱溶液混合后pH 的计算方法【问题探究1】(1常温下,pH =2的盐酸与pH =4的盐酸,若按1∶10的体积比混合后,求混合溶液的c (H +)及pH 。
【交流】c (H +)=[1×10-2mol ·L -1+10×10-4mol ·L -1]/(1+10)L =1.0×10-3mol ·L -1,故溶液的pH =3。
【问题探究2】(2)常温下,将200 mL 5×10-3mol ·L -1NaOH 溶液与100 mL 2×10-2mol ·L-1NaOH 溶液混合后,求溶液的c (OH -)、c (H +)及pH 。
【交流】c (OH -)=1.0×10-2mol ·L -1,c (H +)=1.0×10-12mol ·L -1,pH =12。
【问题探究3】(3)常温下,pH =12的NaOH 溶液与pH =2的硫酸,若等体积混合后,求溶液的pH 为多少?若按9∶11的体积比混合后,溶液的pH 又为多少?【交流】先判断酸、碱谁过量,若酸过量,直接求c (H +)和pH ,若碱过量,则先求c (OH -),再求c (H +)和pH 。
可得前者酸碱恰好完全反应,则pH =7,后者酸过量pH =3。
【方法探究】强酸碱混合后溶液pH 的计算基本思路是什么?【交流1】(1)强酸与强酸混合:c (H +)混=c 1H +·V 1+c 2H +·V 2V 1+V 2,然后再求pH 。
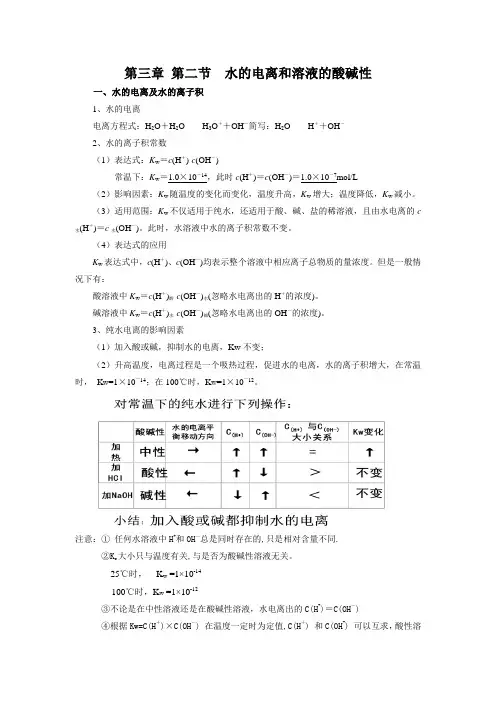
第三章第二节水的电离和溶液的酸碱性一、水的电离及水的离子积1、水的电离电离方程式:H2O+H2O H3O++OH-简写:H2O H++OH-2、水的离子积常数(1)表达式:K w=c(H+)·c(OH-)常温下:K w=1.0×10-14,此时c(H+)=c(OH-)=1.0×10-7mol/L(2)影响因素:K w随温度的变化而变化,温度升高,K w增大;温度降低,K w减小。
(3)适用范围:K w不仅适用于纯水,还适用于酸、碱、盐的稀溶液,且由水电离的c水(H +)=c水(OH-)。
此时,水溶液中水的离子积常数不变。
(4)表达式的应用K w表达式中,c(H+)、c(OH-)均表示整个溶液中相应离子总物质的量浓度。
但是一般情况下有:酸溶液中K w=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度)。
碱溶液中K w=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度)。
3、纯水电离的影响因素(1)加入酸或碱,抑制水的电离,Kw不变;(2)升高温度,电离过程是一个吸热过程,促进水的电离,水的离子积增大,在常温时,K W=1×10-14;在100℃时,K W=1×10-12。
注意:①任何水溶液中H+和OH-总是同时存在的,只是相对含量不同.②K w大小只与温度有关,与是否为酸碱性溶液无关。
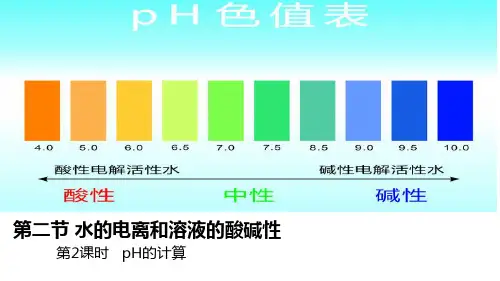
25℃时,K w =1×10-14100℃时,K w =1×10-12③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)④根据Kw=C(H+)×C(OH-) 在温度一定时为定值,C(H+) 和C(OH-) 可以互求,酸性溶液中水电离出来的c(H+)可以忽略、碱性溶液中水电离出来的OH-离子可以忽略;二、溶液的酸碱性与pH1、溶液的酸、碱性跟C(H+)、C(OH-)的关系2、溶液的pH(1)概念:用C(H+)的负对数表示溶液酸碱性的强弱。





《水的电离和溶液的 pH》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《水的电离和溶液的 pH》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教学方法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析本节课是人教版高中化学选修 4《化学反应原理》第三章第二节的内容。
在前面的学习中,学生已经掌握了化学平衡的相关知识,为本节课的学习奠定了基础。
水的电离和溶液的 pH 是化学平衡理论在水溶液中的具体应用,同时也是后续学习盐类水解的重要铺垫。
通过本节课的学习,学生能够更深入地理解弱电解质的电离平衡,掌握溶液酸碱性的本质以及 pH 的计算方法,提高分析和解决问题的能力。
二、学情分析学生在必修 1 中已经初步了解了溶液的酸碱性,但对于水的电离平衡以及 pH 的概念和计算还比较陌生。
经过前面化学平衡知识的学习,学生已经具备了一定的平衡思维能力,但对于抽象的概念和复杂的计算仍存在一定的困难。
因此,在教学过程中,要注重引导学生从已有的知识出发,通过实验探究、问题讨论等方式,帮助学生逐步理解和掌握新知识。
三、教学目标1、知识与技能目标(1)理解水的电离平衡,掌握水的离子积常数。
(2)了解溶液的酸碱性与 pH 的关系,掌握 pH 的计算方法。
(3)能够进行溶液 pH 的简单计算。
2、过程与方法目标(1)通过实验探究和数据分析,培养学生的观察能力、分析能力和归纳总结能力。
(2)通过问题讨论和小组合作,培养学生的思维能力和合作精神。
3、情感态度与价值观目标(1)让学生体会化学知识与生活实际的密切联系,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和创新精神。
四、教学重难点1、教学重点(1)水的电离平衡和水的离子积常数。
(2)溶液的 pH 与酸碱性的关系,pH 的计算方法。
2、教学难点(1)水的离子积常数的应用。
(2)溶液 pH 的计算。
五、教学方法1、讲授法:讲解水的电离平衡、水的离子积常数、溶液的 pH 等重要概念和知识。

第二节水的电离和溶液的酸碱性(教学设计)
【知识技能】
了解水的离子积的含义;掌握[H+]和[OH-]与溶液酸碱性的关系;初步学会有关水的离子积的简单计算。
【过程与方法】
通过学生自主设计实验方案,培养学生发现问题、思考问题的能力;观察动画和问题探究与讨论,培养学生分析问题的能力和归纳、总结、概括知识的能力。
【情感态度与价值观】
通过水的离子积和溶液酸碱性等内容的教学,对学生进行矛盾的对立统一、事物间的相互联系和相互制约、透过现象看本质等辩证唯物主义教育。
【重点、难点】
水的离子积常数的概念;溶液酸碱性与[H+]和[OH-]的关系。
【教学过程】
计
H
H
H H
H。
第2课时pH的计算选题表学问点基础过关实力提升有关pH的计算1,2 14酸碱溶液稀释9 11酸碱混合及其计算3,5,6,10 12综合4,7,8 13基础过关(20分钟)1.常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是( D )A.4B.7C.8D.11解析:由题意知,由水电离产生的c(H+)=1×10-11m o l·L-1,小于1×10-7mol·L-1,即水的电离被抑制,该溶液可能显酸性,也可能显碱性。
若溶液显酸性,则溶液中c(OH-)=1×10-11 mol·L-1,溶液中c(H+)==1×10-3 mol·L-1,pH=3;若溶液显碱性,则溶液中c(OH-)==1×10-3 mol·L-1,pH=11。
2.25 ℃下,将体积都为10 mL,pH都等于3的醋酸溶液和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积为( D )A.a=b=1 000B.a=b>1 000C.a<bD.a>b解析:在溶液中,HCl电离是不行逆的,而CH3COOH的电离是可逆的,存在电离平衡,若a=b,稀释后的CH3COOH溶液pH<5,若使CH3COOH溶液pH=5,就必需接着加水稀释,即a>b。
3.常温下,将0.1 mol/L的氢氧化钠溶液与0.06 mol/L硫酸溶液等体积混合,该混合溶液的pH等于( B )A.1.7B.2.0C.12.0D.12.4解析:常温下,将0.1 mol/L的氢氧化钠溶液与0.06 mol/L 硫酸溶液等体积混合,硫酸过量,则反应后溶液中c(H+)=m o l/L=0.01 mol/L,所以溶液的pH=2.0,故选项B正确。
4.(2024·陕西铜川模拟)室温下,关于pH=3的盐酸和醋酸溶液,下列说法正确的是( B )A.等体积的两溶液,盐酸导电实力强B.等体积的盐酸和醋酸溶液加水稀释10倍后,c(Cl-)<c(CH3COO-)C.将pH=3的醋酸溶液稀释后,溶液中全部离子的浓度均降低D.中和等体积等浓度的NaOH溶液,醋酸溶液消耗的体积多解析:pH=3的盐酸和醋酸溶液中离子浓度相同,导电性相同,A错误;相同pH的盐酸和醋酸溶液中,醋酸溶液的浓度大,稀释过程中,醋酸会进一步电离,所以c(Cl-)<c(CH3COO-),B正确;酸性溶液稀释,溶质离子浓度均减小,但OH-浓度会增大,C错误;相同pH的盐酸和醋酸溶液中,醋酸溶液的浓度大,中和相同量的NaOH溶液,消耗的醋酸溶液体积少一些,D错误。
《水的电离和溶液的酸碱性》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《水的电离和溶液的酸碱性》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析(一)教材的地位和作用“水的电离和溶液的酸碱性”是人教版高中化学选修 4《化学反应原理》第三章第二节的内容。
本节课是在学生已经学习了化学平衡和弱电解质的电离平衡等知识的基础上,进一步深入探讨水溶液中的离子平衡问题。
水的电离是弱电解质电离平衡的延伸和拓展,溶液的酸碱性则是水的电离平衡在实际中的应用。
通过本节课的学习,学生能够更加全面地理解水溶液中的离子行为,为后续学习盐类的水解等知识奠定基础。
(二)教学内容本节课主要包括水的电离、水的离子积常数、溶液的酸碱性与 pH 等内容。
其中,水的电离平衡是理解溶液酸碱性的关键,水的离子积常数则是定量描述水的电离程度的重要物理量,溶液的酸碱性与 pH 的关系则是将抽象的离子浓度转化为直观的数值,便于实际应用。
二、学情分析(一)知识基础学生在必修 1 中已经初步了解了溶液的酸碱性和 pH 的概念,在选修4 第一章和第二章中学习了化学平衡和弱电解质的电离平衡等知识,具备了一定的平衡思维和分析问题的能力。
(二)学习能力高二学生已经具备了较强的自主学习能力和一定的实验探究能力,但对于抽象的理论知识理解起来可能还存在一定的困难,需要通过具体的实例和实验来帮助他们理解。
(三)学习兴趣学生对于与生活实际密切相关的化学知识往往具有较高的学习兴趣,溶液的酸碱性在日常生活和工农业生产中有着广泛的应用,因此可以通过联系实际来激发学生的学习积极性。
三、教学目标(一)知识与技能目标1、理解水的电离平衡及其影响因素。
2、掌握水的离子积常数的表达式及意义。
3、了解溶液的酸碱性与 pH 的关系,能够进行 pH 的简单计算。
(二)过程与方法目标1、通过实验探究和数据分析,培养学生的观察能力、实验操作能力和数据分析能力。
第二节 水的电离和溶液的酸碱性(第1课时)【知识梳理】 一、水的电离1. 水的电离:水是一种极弱的电解质,存在电离平衡:H 2O +H 2O H 3O ++OH -简写为: 根据水的电离平衡,相应的平衡常数表达式:)O H (c )OH (c )H (c K 2-+⋅=电离室温时,1L 纯水中(即55.56mol )测得只有1×10-7molH 2O 发生电离,电离前后H 2O 的物质的量几乎不变,故c (H 2O )可视为常数,上式可表示为:c (H +)·c (OH –)=K 电离·c (H 2O )K 电离与常数c (H 2O )的积叫做水的离子积常数,用K W 表示室温时K W =c (H +)·c (OH –)=1×10-142. 影响水电离的因素:⑴温度:由于水的电离过程 ,故升温使水的电离平衡 移,即加热能 水的电离,c(H +)、c(OH ―)同时 ,K w ,pH 值变 ,但c(H +)与c(OH ―)仍相等,故体系仍显中性。
⑵酸、碱性:在纯水中加入酸或碱,酸电离出的 或碱电离出 均能使水的电离平衡 移,即酸、碱的加入 水的电离。
若此时温度不变,则K w 不变,c(H +)、c(OH ―)此 彼 。
即:加酸,c(H +) ,c(OH ―) ,pH 变 。
加碱,c(OH ―) ,c(H +) ,pH 。
⑶盐:在纯水中加入能水解的盐,由于水解的实质是盐电离出的弱酸根或弱碱阳离子结合水电离出的H +或OH ―,所以水解必破坏水的电离平衡,使水的电离平衡右移。
即盐类的水解促进水的电离。
⑷其它因素:向水中加入活泼金属,由于与水电离出的H +直接作用,因而同样能 水的电离。
3.影响水的离子积的因素水的离子积只与 有关,不但适用于水,还适用于以水为溶剂的稀溶液。
注意:1、水分子能够发生电离,水分子发生电离后产生的离子分别是H 3O +和OH -,发生电离的水分子所占比例很小;2、水的电离是个吸热过程,故温度升高,水的K W 增大,100℃时,K w =c (H +)·c (OH -)=1×10-123、水的离子积不仅适用于纯水,也适用于酸、碱和盐的稀溶液,任何溶液中由水电离的c (H +)与c (OH –)总是相等的;4、含有H+的溶液不一定是酸,同样含OH-的溶液也不一定是碱,在任何水溶液中都存在H+和OH-,溶液显酸性、中性、还是碱性,主要由c(H+)和c(OH-)的相对大小决定;5、在酸、碱和盐的稀溶液中,均存在水的电离平衡,也就是水溶液中都是H+、OH-共存的。
第三章水溶液中的离子平衡第二节水的电离和溶液的酸碱性【思维导图】【微试题】1.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )①K+、Cl-、NO3-、S2-②K+、Fe2+、I-、SO42-③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤K+、Ba2+、Cl-、NO3-A.①③B.③⑤C.③④D.②⑤【答案】B2.(2014·山东卷)已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中()A.水的电离程度始终增大B.c(NH4+)/ c(NH3•H2O)先增大再减小C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变D.当加入氨水的体积为10mL时,c (NH4+)= c (CH3COO‾)【答案】D3.(2012·海南高考·11)25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )A.a =b B.a >b C.c (A-)= c (Na+) D.c (A-)< c(Na+)【答案】C4.(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- ,据此判断以下叙述中错误的是() A.液氨中含有NH3、NH4+、NH2-等微粒B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)(2)完成下列反应方程式①在液氨中投入一小块金属钠,放出气体____________________________。
第二节 水的电离和溶液的酸碱性第一课时教学目的:1、使学生了解水的电离和水的离子积2、生了解溶液的酸碱性与pH 的关系教学难点:水的离子积板书:一、水的电离 1、水的电离H 2O + H 2O H 3O + + OH — 简写为:H 2O H + + OH—实验测定:25℃ [H +]=[OH -]=1710-⨯mol/L 100℃ [H +] = [OH -] = 1610-⨯mol/L水的电离与其它弱电解质的电离有何异同?不同点:水是“自身”作用下发生的极微弱的电离。
相同点:均是部分电离,存在电离平衡提问:请学生计算水的浓度,1L 纯水的物质的量是55·6mol ,经实验测得250C 时,发生电离的水只有1×10-7mol ,二者相比,水的电离部分太小,可以忽略不计。
因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用K w 表示,即为水的离子积常数,简称水的离子积。
板书2、水的离子积K w = c (H +)·c (OH —)由于250C 时,c (H +)= c (OH —)= 1×10-7mol/L所以250C 时,K w = c (H +)·c (OH —)=1×10-14(定值)(省去单位)提问:当温度升高时,K w 如何变化?影响K w 的因素是什么?(电离过程是吸热过程)1000C 时,K w = c (H +)·c (OH —)=1×10-12影响因素:温度越高,Kw 越大,水的电离度越大。
对于中性水,尽管Kw,电离度增大,但仍是中性水,[H +]=[OH -].注:温度升高时K w 增大,所以说K w 时要强调温度。
过渡:在常温时,由于水的电离平衡的存在,不仅是纯水,就是在酸性或碱性的稀溶液里,H + 浓度和OH —浓度的乘积总是一个常数——1×10-14,请考虑一下,当纯水中加入盐酸或氢氧化钠时,c (H +)和c (OH —)如何变化? 板书:二、溶液的酸碱性和pH (常温下):1、 溶液的酸碱性与c (H +)和c (OH —)的关系: 投影显示空表,教师引导填写,然后推出结论。