兽药地方标准升国家标准工作说明
- 格式:pdf
- 大小:164.89 KB
- 文档页数:4

中华人民共和国兽药典一部定价:580元中华人民共和国兽药典二部定价:600元中华人民共和国兽药典三部定价:280元中国兽药典兽药使用指南化学药品卷定价:410元中国兽药典兽药使用指南中药卷定价:380元中国兽药典兽药使用指南生物制品卷定价:420元总定价:2670元优惠价1860元2010年版《中华人民共和国兽药典》及其《兽药使用指南》2010年版《中华人民共和国兽药典》(以下简称《中国兽药典》)是中国兽药典委员会编制的第四版兽药典,是兽药生产、经营、检验和监督管理等的法定技术依据。
《中国兽药典》2010年版分为一部、二部和三部,收载品种总计1829种。
兽药典一部收载化学药品、抗生素、生化药品及药用辅料共计592种;兽药典二部收载中药材及饮片、提取物、成方和单味制剂共1114种;三部收载生物制品123种。
各部均有各自凡例、附录、索引等。
一部、二部、三部共同采用的附录分别在各部中予以收载,方便使用。
《兽药使用指南》分为化学药品卷、中药卷和生物制品卷,是2010年版《中国兽药典》的配套丛书,主要对农业部批准的兽药品种提供兽医临床所需资料,指导兽药使用者科学、合理用药,在促进动物健康的同时,保证动物性食品安全。
本版《兽药使用指南》收载品种总计1492个,其中化学药品卷收载品种821个,中药卷收载成方制剂192个,生物制品卷收载品种479个。
2010年版《中国兽药典》及其《兽药使用指南》已于2010年12月27日由农业部公告第1521号颁布,并将于2011年7月1日起施行。
为更好地指导用药,《中国兽药典》二○一○年版配套丛书《兽药使用指南》化学药品卷、中药卷和生物制品卷同时出版。
在使用指南中,具体介绍了每种药物“作用与用途”、“用法与用量”、“注意事项”等项内容。
首次出版的《兽药使用指南(中药卷)》,有助于改变以往专业术语难懂,影响正确使用的状况,对弘扬我国传统兽医学,推动我国中兽药的产业化具有重要意义。
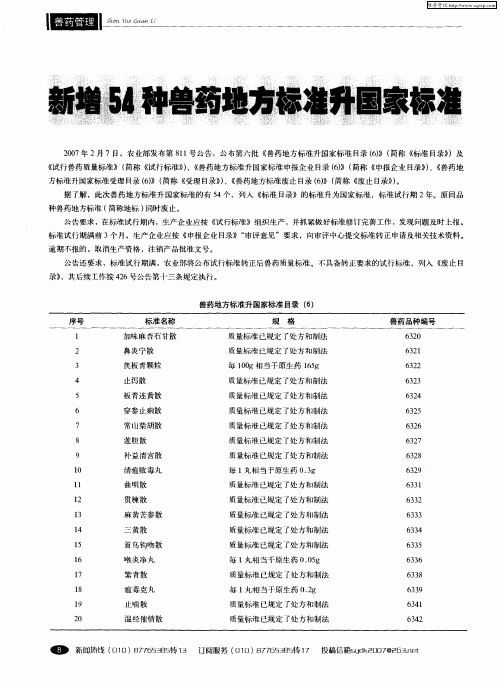

农业部公告第426号——清理兽药地方标准和换发原兽药地方产品批准文号有关事项公告文章属性•【制定机关】农业部(已撤销)•【公布日期】2004.11.09•【文号】农业部公告第426号•【施行日期】2004.11.09•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】畜牧业正文农业部公告(第426号)根据《兽药管理条例》规定,现就清理兽药地方标准和换发原兽药地方产品批准文号有关事项公告如下:一、农业部兽医局负责全国兽药地方标准清理工作的组织、协调、管理工作。
二、省级畜牧兽医行政管理部门负责本辖区内兽药地方标准和地方产品批准文号筛选、申报资料的审核、提出审查意见和组织上报等工作。
三、农业部兽药审评委员会负责兽药地方标准清理工作的技术审评,农业部兽药审评委员会办公室(以下简称审评办)负责兽药地方标准清理的日常管理和我部临时交办的有关工作。
四、中国兽医药品监察所和省级兽药监察所负责兽药地方标准产品的复核检验工作。
五、生产企业应向省级畜牧兽医行政管理部门提出兽药地方标准升国家标准的申请,填写《兽药地方标准升国家标准申请表》(见附件1),并按附件2所列要求提交申报资料。
六、省级畜牧兽医行政管理部门对申报资料进行审核,按每个标准立卷,卷内应有采用该标准的所有企业的申报资料,其中该标准研究企业申报资料在前,仿制生产企业申报资料在后。
七、省级畜牧兽医行政管理部门填写《兽药地方标准升国家标准审核登记表》(见附件3),连同有关资料一式三份,按以下情形和要求向审评办组织上报或处理。
1、属于组方不合理、生产工艺存在严重问题、疗效不确切、质量不可控、无菌分装复方抗生素制剂或其他制剂,以及不具备安全、有效等指标的兽药地方标准,于2005年6月底前自行撤消,并向我部上报撤销清单。
2、属于执行国家兽药标准(包括改变包装规格)的地方批准文号产品,于2005年6月底前上报标准目录及兽药生产企业产品目录。
3、属于依据国家兽药标准,但改变了含量规格、作用与用途和用法与用量而批准为地方标准的,于2005年6月底前上报标准目录、兽药标准、兽药生产企业产品目录及相关技术资料。


农业部公告第1030号――兽药地标评审有关事项的公告文章属性•【制定机关】农业部(已撤销)•【公布日期】2008.05.12•【文号】农业部公告第1030号•【施行日期】2008.05.12•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】畜牧业正文农业部公告(第1030号)根据《兽药管理条例》和农业部第426号公告(以下简称426公告)规定,我部组织完成了列入《兽药地方标准升国家标准受理目录》的中兽药地标评审工作。
经审核,现公布第十二批《兽药地方标准升国家标准目录(12)》(附件1,简称《标准目录》)及试行兽药质量标准(附件2,简称《试行标准》)、《兽药地方标准升国家标准申报企业目录(12)》(附件3,简称《申报企业目录》)、《兽药地方标准废止目录(12)》(附件4,简称《废止目录》),并就有关事项公告如下:一、自本公告发布之日起,列入《标准目录》的标准升为国家标准,标准试行期2年。
原同品种兽药地方标准(简称地标)同时废止。
二、列入《申报企业目录》的兽药GMP企业,可按规定程序向我部申请本企业有申报标准的产品批准文号。
三、自本公告发布之日起,列入《废止目录》的标准同时废止,涉及此类标准的后续工作按426号公告第十三条规定执行。
四、标准试行期内,生产企业应按《试行标准》组织生产,并抓紧做好标准修订完善工作,发现问题及时上报。
标准试行期满前3个月,生产企业应按《申报企业目录》“审评意见”要求,向农业部兽药评审中心(以下简称评审中心)提交标准转正申请及相关技术资料。
逾期不报的,取消生产资格,注销产品批准文号。
五、标准试行期满,我部将公布试行标准转正后的兽药质量标准。
不具备转正条件的试行标准,列入《废止目录》,其后续工作按426号公告第十三条规定执行。
六、各省级兽药监察所应按《试行标准》对本辖区企业申报产品质量复核检验工作,认真做好试行标准执行和总结工作,并将有关情况及时上报我部和评审中心。
![农业部办公厅关于兽药产品流通有关问题的通知农办医[2006]20号](https://img.taocdn.com/s1/m/057b4140e45c3b3567ec8b1a.png)
中华人民共和国农业部公告第596号根据《兽药管理条例》规定和农业部第426号公告(以下简称426公告)要求,经审核,现公布首批《国家兽药标准增加规格目录》(附件1,以下简称《规格目录》)、《兽药地方标准升国家标准受理目录》(附件2,以下简称《受理目录》)和《兽药地方标准废止目录》(附件3,以下简称《废止目录》),并就有关事项公告如下:一、自本公告发布之日起,列入《规格目录》的,按国家兽药标准(以下简称国标)增加含量或包装规格管理,不实行标准试行期和监测期保护。
拟生产该类产品的兽药生产企业,可按规定程序向我部履行产品批准文号申报手续。
二、自本公告发布之日起,除《规格目录》中所列规格外,其他同品种不同规格的兽药地方标准(以下简称地标)同时废止。
拟增加《规格目录》同品种的含量或包装规格的,按《兽药地方标准升国家标准技术资料审查原则》(农办医[2005]52号)相关规定办理。
三、法定兽药检验机构对列入《规格目录》的产品实施监督检验时,应根据检验工作需要适当调整取样量,以保证检验结果准确。
四、列入《受理目录》的,按426公告第九条规定执行。
农业部兽药审评委员会办公室(以下简称审评办)向申报企业发出受理通知书,并提出相关要求。
申报企业应按规定向审评办上报补充资料。
五、自本公告发布之日起,列入《废止目录》的同品种地标同时废止,其他后续工作按426号公告第十三条规定执行。
六、各地已批准但未列入《兽药地方标准废止目录》(农业部公告第560号)的、未列入本公告《废止目录》的、未列入本地自行撤销地标清单的地标,均可按照426号公告要求抓紧组织该类地标的申报。
七、对联合协作申报地标的,所有企业应分别填写《兽药地方标准升国家标准申请表》,由承办企业按426号公告第五条规定进行申报,并附联合协作协议书。
参与协作企业填写的《兽药地方标准升国家标准申请表》需经本辖区省级兽医行政管理部门签署意见、盖章、备案,作为地标升国标后申报产品批准文号的证明材料。