高考微专题复习酸碱中和滴定图像分析
- 格式:ppt
- 大小:1.39 MB
- 文档页数:30

酸碱中和滴定图像问题三大类型汇总【高考化学解析】酸碱中和滴定曲线图像是近年高考化学高频试题,也是考试大纲对化学学习能力的要求和学科核心素养变化观念与平衡思想、证据推理与模型认识考核的重要载体,此类题试题综合性强,难度较大,涉及微观粒子探析、定性与定量分析、电解质平衡理论、守恒思想及数形结合识图用图能力等,是学生常见的失分“痛点”,试题讲解教学中要强化电解质平衡理论相关知识点,注重图像试题分析方法及解题技巧的提升训练,构建解题模型,提高学生分析问题和解决问题的能力。
1一、认识辨析曲线突破数形结合问题读图能力是解题的核心,从图像横纵坐标物理量,从数学函数关系分析曲线的形状和走向,结合电解质的相关概念或理论,对试题的题给条件和图像进行深度分析,解决问题。
图像主要包括滴定量为横坐标pH为纵坐标的图像、横纵坐标均为对数的图像、二、巧用“四点”突破曲线定性和定量分析问题酸碱中和滴定曲线中的起点、滴定终点、中性点(25℃pH=7)、交点是解题的出发点.起点是未滴定溶液,其pH 可确定酸碱溶液的强弱或计算溶液的Ka/Kb;强酸与强碱相互滴定曲线滴定终点与中性点重叠(醋酸Ka与氨水Kb相等,曲线滴定终点与中性点重叠),强(弱)酸与弱(强)碱的滴定,滴定终点与中性点不重叠;任意点中微粒浓度大小比较必须确认溶液中溶质成分及比例,溶液的特性如中性、弱酸酸式根的电离程度与水解程度的大小等。
三、变式强化突破解题模型构建问题变式训练是提升学生解题能力的有效方法和途径,能深度检测学生掌握情况,课前预设若干个变式根据学生情况加以选用能达到事半功倍的成效。
滴定曲线习题教学从读题分析(题干条件、图像)、基本概念和理论知识载体强化、课堂讲评引导、解题思维训练、2解题方法探析等过程,循序渐进构建解题模型(如下图),促进学生解题能力的提升。
【知识储备】1.酸碱中和滴定,最原始的是酸溶液和碱溶液的滴定,变式有呈现酸性的盐和碱溶液滴定,或者是呈现碱性的盐和酸溶3液的滴定。


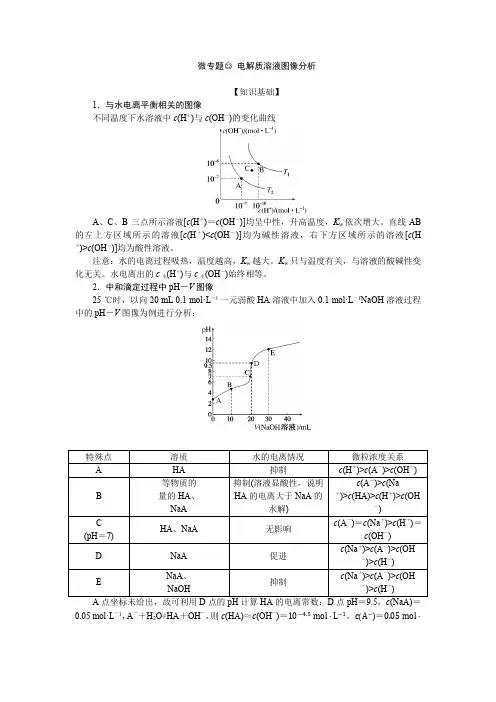
微专题○22电解质溶液图像分析【知识基础】1.与水电离平衡相关的图像不同温度下水溶液中c(H+)与c(OH-)的变化曲线A、C、B三点所示溶液[c(H+)=c(OH-)]均呈中性,升高温度,K w依次增大。
直线AB 的左上方区域所示的溶液[c(H+)<c(OH-)]均为碱性溶液,右下方区域所示的溶液[c(H +)>c(OH-)]均为酸性溶液。
注意:水的电离过程吸热,温度越高,K w越大。
K w只与温度有关,与溶液的酸碱性变化无关。
水电离出的c水(H+)与c水(OH-)始终相等。
2.中和滴定过程中pH-V图像25 ℃时,以向20 mL 0.1 mol·L-1一元弱酸HA溶液中加入0.1 mol·L-1NaOH溶液过程中的pH-V图像为例进行分析:0.05 mol·L-1,A-+H2O⇌HA+OH-,则c(HA)≈c(OH-)=10−4.5 mol·L−1,c(A−)=0.05 mol·L −1 −10−4.5mol ·L−1≈0.05 mol ·L −1,K h (A-)=c (HA )·c (OH −)c (A −)=10−4.5×10−4.50.05=2×10-8,则K a (HA)=K w K h (A −)=10−142×10−8=5×10−7。
3.分布分数图像分布分数图像一般是以pH 为横轴、分布分数(组分的平衡浓度占总浓度的分数)为纵轴的关系曲线,以草酸H 2C 2O 4为例,含碳元素的各组分分布分数(δ)与pH 的关系如图所示。
曲线含义分析:随着pH 的逐渐增大,溶质分子的浓度逐渐减小,酸式酸根离子浓度先逐渐增大后逐渐减小,酸根离子浓度逐渐增大,所以δ0表示H 2C 2O 4、δ1表示HC 2O 4−、δ2表示C 2O 42−。
特殊点的应用:对于物种分布分数图像,一般选择“交点”处不同微粒的等浓度关系,代入电离常数公式计算各级电离常数。




新高考微专题64 酸碱中和滴定与图像拓展一、选择题:每小题只有一个选项符合题意。
1.(2019·洛阳质量检测)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是()A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸B.锥形瓶用蒸馏水洗净,必须干燥后才能加入一定体积未知浓度的NaOH溶液C.滴定时没有排出滴定管中的气泡D.读数时视线与滴定管内液体凹液面最低处保持水平2.已知常温下CH3COOH的电离常数K=1.6×10-5,lg 4=0.6。
该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。
下列说法正确的是()A.a点溶液中c(H+)为1×10-4mol·L-1B.a、b、c、d四点中水的电离程度最大的是d点C.滴定过程中宜选用酚酞作指示剂D.b点溶液离子浓度大小顺序一定为c(CH3COO-)>c(H+)>c(K+)>c(OH-) 3.(2019·合肥六中模拟)用0.1mol·L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示(电导率的物理意义是表示物质导电的性能)。
下列有关叙述错误的是()A.曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液B.a点、c点均为滴定终点C.c点:c(Na+)>c(A-)>c(H+)>c(OH-)D.b点pH大于14.在一隔热系统中,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH 溶液,测得混合溶液的温度变化如图所示。
下列相关说法正确的是()A .若a 点溶液呈酸性,此时:c (CH 3COO -)-c (CH 3COOH)=2c (H +)-2c (OH -) B .从a 到b :c (CH 3COOH )c (CH 3COO -)逐渐增大C .水的电离程度:b 点<c 点D .b 点和c 点对应的溶液中,K w 相同5.(2020·镇江调研)已知:pOH =-lg c (OH -)。

2021届高三化学一轮复习——酸碱中和滴定曲线分析与应用素养说明:酸碱中和滴定曲线是近几年热点题型,通过分析建模,让考生形成解题程序,也体现大纲对考生对图形的识别与分析的能力要求。
知识梳理1.图示强酸与强碱滴定过程中pH曲线(以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例)2.强酸(碱)滴定弱碱(酸)pH曲线比较特别提醒 恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
强化训练1、(2020年北京3月份试测题)用一定浓度NaOH 溶液滴定某醋酸溶液。
滴定终点附近溶液pH 和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。
下列说法不正确...的是A .a 点对应的溶液中:c (CH 3COO -) = c (Na +)B .a→b 过程中,n (CH 3COO -)不断增大C .c→d 溶液导电性增强的主要原因是c (OH -)和c (Na +)增大D .根据溶液pH 和导电能力的变化可判断:V 2<V 3 答案 C2.常温下,用0.100 mol·L-1的NaOH 溶液分别滴定同浓度、体积均为20.00 mL 的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
下列说法正确的是( ) A .滴定醋酸的曲线是图1pH 7V 1 V 2 V (NaOH)V 1 V 3 V (NaOH)导电能力B .由图分析可得b >a =20C .D 点对应的溶液中:c (Na +)=c (A -)D .根据E 点可计算得K (HA)=[0.050+(10-6-10-8)]×10-810-6-10-8 答案 C解析 根据图知,图1中A 点未加氢氧化钠溶液时溶液的pH =1,由于酸的浓度是0.100 mol·L -1,所以图1中为强酸,即滴定盐酸的曲线是图1,选项A 错误;由选项A 分析可知图1滴定盐酸且滴定终点溶液呈中性,图2滴定醋酸且滴定终点溶液呈碱性,故b =a =20,选项B 错误;根据图示可知,D 点显示中性;c (H +)=c (OH -),结合电荷守恒可知:c (Na +)=c (A -),选项C 正确;E 点pH =8,则c (H +)=10-8mol·L -1,c (OH-)=10-6mol·L -1,c (Na +)=0.050mol·L -1,结合电荷守恒可知;c (A -)=c (Na +)+c (H +)-c (OH -)=0.050 mol·L -1+10-8 mol·L -1-10-6mol·L -1,c (HA)=0.050 mol·L -1-(0.050+10-8-10-6) mol·L -1=(10-6-10-8)mol·L -1,K (HA)=c (H +)·c (A -)c (HA )=10-8×(0.050+10-8-10-6)10-6-10-8,选项D 错误。
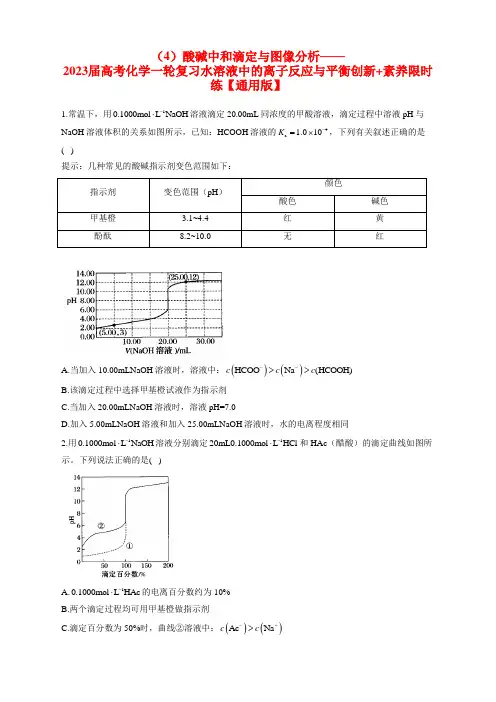
(4)酸碱中和滴定与图像分析——2023届高考化学一轮复习水溶液中的离子反应与平衡创新+素养限时练【通用版】1.常温下,用10.1000mol L NaOH -⋅溶液滴定20.00mL 同浓度的甲酸溶液,滴定过程中溶液pH 与NaOH 溶液体积的关系如图所示,已知:HCOOH 溶液的4a 1.010K -=⨯,下列有关叙述正确的是( )提示:几种常见的酸碱指示剂变色范围如下:A.当加入10.00mLNaOH 溶液时,溶液中:()()HCOO Na (HCOOH)c c c -->>B.该滴定过程中选择甲基橙试液作为指示剂C.当加入20.00mLNaOH 溶液时,溶液pH=7.0D.加入5.00mLNaOH 溶液和加入25.00mLNaOH 溶液时,水的电离程度相同2.用10.1000mol L NaOH -⋅溶液分别滴定120mL0.1000mol L HCl -⋅和HAc (醋酸)的滴定曲线如图所示。
下列说法正确的是( )A.10.1000mol L HAc -⋅的电离百分数约为10%B.两个滴定过程均可用甲基橙做指示剂C.滴定百分数为50%时,曲线②溶液中:()()Ac Na c c -+>D.图像的变化证实了Ac -的碱性很强3.室温下,用0.1000 1mol L ⋅- NaOH 溶液分别滴定0.1000 1mol L ⋅- HA ~HD 酸的滴定曲线如图所示。
下列说法不正确的是( )A.等物质的量浓度时,a K 越小滴定突变越不明显,滴定误差越大B.滴定HC 时,滴定终点的pH =7C.滴定HB 时,应该选择酚酞作为指示剂D.由图像可知在计算HD 滴定前溶液pH 时不能忽略水的电离4.常温下,向20mL 10.1mol L -⋅的34H PO 溶液中滴加10.1mol L -⋅的NaOH 溶液,所得溶液的pH 与NaOH 溶液体积的关系如图所示,下列说法正确的是( )A.34H PO 溶液第一步滴定可用酚酞作指示剂B.A 点溶液中()()()224344H PO H PO HPO c c c -->> C.图像中A 、B 、C 三处溶液中()()()2424H PO OH HPO c c c ---⋅相等D.B 点溶液存在()()()()()324244342Na PO H PO HPO H PO c c c c c +---=+++ 5.常温下,分别取浓度不同、体积均为20.00mL 的3种HCl 溶液,分别滴入浓度为1.0001mol L -⋅、0.10001mol L -⋅和0.010001mol L -⋅的NaOH 溶液,测得3个反应体系的pH 随(NaOH)V 的变化的曲线如图所示,在(NaOH)V =20.00mL 前后出现突跃。
高考化学专题复习—中和滴定曲线的分析与应用1、(2016·天津高考)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是()A.三种酸的电离常数关系:KHA>KHB>KHDB.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)2、常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是()A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的顺序可能为c(CH3COO-) >c(Na+)>c(H+)>c(OH-)D.这两次滴定都可以用甲基橙作为指示剂3、室温下,将1.00 0 mol·L-1盐酸滴入20.00 mL1.00 0 mol·L-1氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示,下列有关说法正确的是()A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1B.b点时:c( NH4+ )+c(NH3·H2O)=c(Cl-)C.c点时:c(Cl-)=c(NH4+ )D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热4、室温下用0.100 mol·L-1 NaOH 溶液分别滴定20.00 mL 0.100 mol·L-1盐酸和醋酸。