碘盐中碘含量的 检测实验
- 格式:doc
- 大小:109.50 KB
- 文档页数:5

制盐工业通用试验方法碘的测定制盐工业的碘含量检测,就像是给盐瓶装上了“智能芯片”。
这个“芯片”就是碘含量
测试仪。
想象一下,当它一接触到盐,就像手机解锁一样,立刻显示出盐中的碘含量。
这就好比你打开手机,一看电量,就知道还剩多少电可以玩。
而制盐厂里,碘的含量就像是手机的电量,决定了盐的质量和口感。
在制盐的过程中,碘是不可或缺的。
它就像是盐里的“调味料”,让盐变得美味可口。
如果少了碘,盐就像失去了灵魂,变得索然无味。
这就是为什么制盐厂要严格控制碘的含量,就像厨师炒菜时,必须掌握好火候和调料的比例。
有了碘含量测试仪,制盐厂就像拥有了一双慧眼,能够随时监测盐中的碘含量,确保每一批盐都符合标准。
就像你每天出门前都要检查一下手机电量,确保不会因为电量不足而耽误了重要的事情。
制盐厂在用碘含量测试仪检测盐的时候,也要注意安全。
就像你在厨房做饭时,不能随便打开煤气开关,以免发生危险。
在使用碘含量测试仪时,也要遵循操作规程,确保安全。
制盐工业通用试验方法碘的测定,就像是给盐装上了“智能芯片”,让我们能够准确地了解盐中的碘含量。
这对于保证食品安全、提升产品质量具有重要意义。
这也提醒我们,在享受美食的也要关注食品的安全和健康。
碘是合成甲状腺激素的主要成分,适量的碘可供应人体合成生产发育所必须的甲状腺激素,如果缺乏碘,会产生甲亢(甲状腺功能亢进症),俗称大脖子病,但过量的碘则又可引起甲减(甲状腺功能减退症)。
为了保障人民群众的健康,国家规定食用盐中必须加碘,且严格控制碘加入量,通常主要是加入碘酸钾。
因而对于食用盐中碘含量的测定十分重要。
碘化物检测方法有容量法[1]、光度法[2]和离子色谱法[3]等。
笔者使用抗坏血酸将碘酸钾还原成碘离子,在离子色谱仪上进行检测,获得较为满意的检测结果,能满足实验中碘含量的检测要求,并且操作简单、快捷。
1仪器与试剂1.1试剂碘化物标准贮备液:购自国家有色金属分析测试研究所100µg/mL ,50mL ;抗坏血酸:分析纯。
1.2仪器及工作条件离子色谱仪:戴安ICS-1100AR ,抑制器ASRS_4mm ,RFC-30淋洗液发生器,Dionex IonPac TM AG11-HC4×50mm ,Dionex IonPac TM AS11-HC 4×250mm 。
仪器工作条件:淋洗液40mmol/L KOH 溶液,淋洗液流速1.0mL/min ,进样量250µL ;柱温30℃,池温度30℃,抑制器电流99mA 。
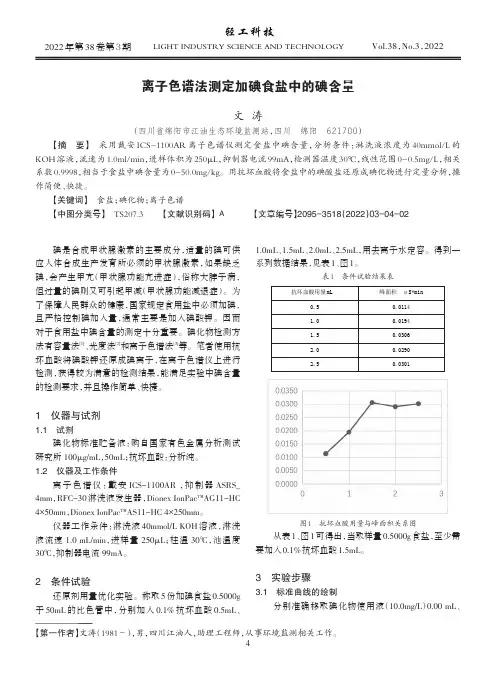
2条件试验还原剂用量优化实验。
称取5份加碘食盐0.5000g于50mL 的比色管中,分别加入0.1%抗坏血酸0.5mL 、1.0mL 、1.5mL 、2.0mL 、2.5mL ,用去离子水定容。
得到一系列数据结果,见表1、图1。
表1条件试验结果表抗坏血酸用量mL0.51.01.52.02.5峰面积μS*min0.01140.01940.03060.02900.0301图1抗坏血酸用量与峰面积关系图从表1、图1可得出,当取样量0.5000g 食盐,至少需要加入0.1%抗坏血酸1.5mL 。
3实验步骤3.1标准曲线的绘制分别准确移取碘化物使用液(10.0mg/L )0.00mL 、【第一作者】文涛(1981-),男,四川江油人,助理工程师,从事环境监测相关工作。


高效液相色谱法测定食盐中碘含量长春市卫生防疫站任凯刘剑平左社清长春市中心医院孙轶峰碘被认为是体内不能合成的必需的微量元素U当机体摄入量不足时则可引起碘缺乏病V人体摄入的碘主要来自碘盐U而碘盐中的碘酸钾易被氧化为单质碘而逸失U使碘盐中的碘化物与碘的比例达不到%aC KK K K b%aS KK K K U降低了补碘的作用U因此对碘盐定期监测是对碘盐市场进行监督的手段U是消除碘缺乏病的重要措施之一V近年来碘的检测方法发展迅速U过去使用的氧化法W比色法等化学法及\N]*_<法均有操作繁锁W使用试剂较多等缺点U本文作者现将高效液相色谱法测定食盐中的碘含量介绍如下V%实验部分c仪器[高效液相色谱仪%%K K型7美国惠普公司;Vd试剂[K$%B@e碘酸钾标准液W%K=B@e碘酸钾标准应用液Vf仪器测定条件[色谱柱C K K==OJ==U</)+1(’+#g&<C$S h=V流动相S$C B@eL流速%=6@=1-U柱C i]g J@N j k E S a%S V温C J lU进样量%K h6V检测器m N&U电极[玻璃碳工作电极W计数电极W参考电极V工作电压为%n U操作方法是电流滴定分析V o标准曲线[准确移取%K=B@e碘化钾标准应用液K$K K W K$C K W K$J K W K$H K W K$E K和%$K=6于小烧杯中U加去离子水至%K=6U在上述色谱条件下进样C K h6U以蜂面积定量U工作曲线相关系数为+pK$T T S VC结果与讨论加标回收实验U在市售碘盐样品中加入碘标准液U用本法进行回收率实验V回收率在T H$J qb%K%$E q之间U 取含碘量为D E$H S h B@B的样品U在同一周内进行五次实验U变异系数在%$E%qbC$J E q之间V食盐中碘含量测定方法的改进是本着准确W简易W快速W经济的原则V高效液相色谱法测定食盐中碘含量U具有选择性强W方法简单W快速W准确W使用化学试剂少等优点U此方法也适用于其它样品中碘含量的测定U对防治碘缺乏病具有重要意义V万方数据r%S%r高效液相色谱法测定食盐中碘含量作者:任凯, 刘剑平, 左社清, 孙轶峰作者单位:任凯,刘剑平,左社清(长春市卫生防疫站), 孙轶峰(长春市中心医院)刊名:白求恩医科大学学报英文刊名:JOURNAL OF NORMAN BETHUNE UNIVERSITY OF MEDICAL SCIENCES年,卷(期):2001,27(2)本文链接:/Periodical_bqeykdxxb200102055.aspx。


检测市售加碘食盐中碘元素课题组成员:季建林(组长)孙天宇倪鹏黄艳曹晓丹王青菊指导老师:虞红娟摘要:通过上网查资料和老师的指导,我们利用淀粉的特征反应,设计了“检测市售食盐中碘元素”的实验方案。
经过实验过程的观察和记录,我们计算得到的数值符合国家规定,即实验使用的食盐是合格产品。
关键词:检测、食盐、碘元素一、选题原因:碘,是一个不陌生的名词。
我们的日常生活都离不开碘。
碘是人体必不可少的微量元素,它对人体的生理有着极其重要的作用。
碘在人体中主要存在于甲状腺内。
甲状腺内的甲状腺球蛋白是一种含碘的蛋白质,是人体的碘库。
一旦体内机能需要,甲状腺球蛋白就会很快水解为有生物活性的甲状腺素,并通过血液送到人体中的各个组织。
甲状腺素是一种含碘的氨基酸,它具有促进体内物质和能量代谢,促进身体生长发育,提高神经系统的兴奋等生理功能。
人体中如果缺碘,甲状腺就得不到足够的碘,甲状腺素的合成就会受到影响,使甲状腺组织产生代偿性增生,形成甲状腺肿(即我们通常说的大脖子病)。
甲状腺肿等碘缺乏病是世界上分布最广,发病最多的一种地方病。
碘缺乏病给人类的智力与健康造成了极大的损害,特别是对婴幼儿的危害尤为严重,使婴幼儿身体矮小,智力低下,发育不全,甚至痴呆,即使是轻症患儿也多智力低下。
我国政府为了消除碘缺乏病,在食用盐中均加入了一定量的碘酸钾,以确保人体对碘的需要。
值得注意的是,人体摄入过多的碘也是有害的。
因此,为确保人体对碘的摄入量,检查我们日常生活中食用的盐是否合格,我们课题组将“检测市售加碘食盐中的碘元素”作为这次的研究性学习的研究课题。
二、研究方法:实验研究法实验探究2.1 提出问题日常生活中通常食用的是碘盐,但市售“碘盐”是不是真的含有碘?如果含碘,那么,碘的存在形式又是怎样的呢?2.2 假设与猜想假设1:食盐中含有碘。
可能以碘单质、碘化物或碘酸盐的形式存在。
猜想1:食盐中的碘成分以碘单质的形式存在。
碘单质常温下为紫黑色固体,且加热容易升华,若食盐中含碘单质,烹调时碘容易遇热升华而流失。


未加碘盐中微量碘的测定方法——碘淀粉比色法一、测定范围本方法适用检测范围(4~20)µg/50mL。
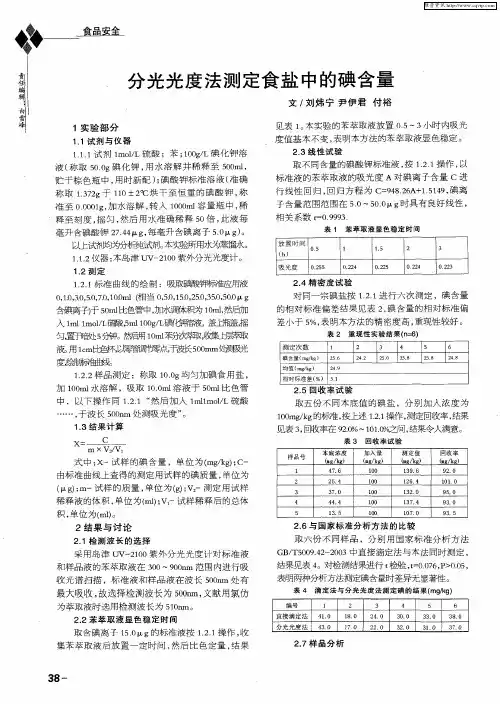
二、实验部分1、方法原理:在酸性溶液中,试样中的碘酸根被碘化钾还原为游离碘,与淀粉生成蓝色化合物,用分光光度法进行测定。
2、仪器设备2.1 分光光度计。
2.2 一般实验室仪器3、主要试剂和溶液3.1 碘离子标准储备溶液:1mg/mL称取0.8432g于110℃±2℃烘至恒重的基准碘酸钾(GB/T1258),称准至0.0002g,溶解后转移到500mL容量瓶中,加水至刻度,摇匀,备用。
3.2碘离子标准工作溶液:5µg /mL(用时新配)。
3.3 碘化钾(GB/T1272):30g/L溶液(用时新配)。
称取3.0g碘化钾,加100mL水溶解,转移到棕色试剂瓶中,摇匀。
3.4 可溶性淀粉(HGB):5g/L溶液(用时新配)。
称取0.5g淀粉,用水调成糊状,倾入100mL沸水中,搅拌后再煮沸0.5min,冷却,取上层清夜。
3.5 磷酸(GB 1282):3.6 盐酸(622):c(HCl)=0.1mol/L溶液3.7饱和溴水:3.8甲酸钠(HGB966):100g/L溶液。
4、实验方法4.1 绘制标准工作曲线:分别吸取碘离子标准工作溶液(3.2)0,1.0,2.0,3.0,4.0 mL于50mL比色管内,加水至35mL,加入1.0mL磷酸(3.5),1.0mL碘化钾(3.3),1分钟后再加入2.0mL淀粉(3.4),加水稀释至刻度,摇匀后放置30min ,用2cm 比色皿在波长590nm 处,以蒸馏水作参比,测定吸光度。
绘制标准工作曲线(或回归计算)。
4.2 样品的测定:称取盐样10.0g 于50mL 烧杯中,加入约35mL 水,加入c(HCl)=0.1mol/L 1滴,加入饱和溴水(3~5)滴(溶液呈微黄色),搅拌至样品溶解,放置5分钟,加入100g/L 甲酸钠溶液(6~10)滴,搅拌至黄色褪去,放置5分钟。


/JL( ) 食盐加碘含量测定一、测定方法直接滴定法(GB/T 13025.7-1999)二、原理在酸性溶液中,样品中的碘酸根氧化碘化钾(游离出碘,以淀粉为指示剂)析出碘,用硫代硫酸钠标准溶液滴定,测定碘离子;计算其含量。
反应式:IO3- + 5I-+ 6H-→3I2 + 3H2O2NaS2 + I2→ 2NaI + Na2S4O6三、玻璃仪器1、滴定管(最好用25ml)2、250ml碘量瓶(或三角烧瓶)四、试剂的配制本方法所用试剂水,均使用分析纯试剂和相应纯度的蒸馏水。
1、碘酸钾:0.002 mol/L碘酸钾标准溶液(很稳定)用分析天平称取1.427g于110℃±2℃烘至恒重的基准碘酸钾,称准至0.0001g,加水溶解,用水准确稀释20倍,得浓度0.002 mol / L碘酸钾标准溶液。
2、硫代硫酸钠:0.1mol / L硫代硫酸钠溶液(一定要准)称取26g(标准)硫代硫酸钠置于1L 容量瓶中,加入400ml刚刚煮沸过的蒸馏水(CO2容易分解Na2S2O3),至完全溶解。
(防止溶液分解可加入0.05g碳酸钠,防止发霉可加入0.01g 碘化汞)。
然后用刚煮沸过的蒸馏水稀释至刻度。
摇匀,贮藏于暗处备用。
0.02N硫代硫酸钠溶液吸取10ml 0.1N硫代硫酸钠溶液,置于500ml容量瓶中,加水至刻度。
3、浓磷酸:1mL (可用硫酸代替)4、5%碘化钾,用水溶解并稀释至500mL溶液贮存于棕色瓶内。
5、0.5%淀粉溶液(用时新配)(一定新鲜配制,发黄就不能用)称取0.5g淀粉,用水调至糊状。
倾入100mL沸水,搅拌后再煮沸0.5min,冷却、备用。
五、硫代硫酸钠标准溶液的标定吸取10.00mL 0.002 mol / L[或1mg / L 碘酸钾(1.646g)0.5mL]碘酸钾标准溶液于250mL碘量瓶,加约80mL 水、2mL 1 mol / L 磷酸、5mL 50g /L碘化钾,立即用0.002mol / L硫代硫酸钠标准溶液滴定。
学教学的有效性.例如ꎬ在教学 离子键 时ꎬ由于离子键属于微观粒子运动知识ꎬ学生难以想象和理解ꎬ是一大教学难点.为此ꎬ笔者利用多媒体进行了难点解读.首先ꎬ利用多媒体展示钠在氯气中的燃烧试验ꎻ其次ꎬ动画演示氯化钠的晶体样品和晶体空间结构模型ꎬ辅助学生理解无数个Na+与Cl-相互连接向空间无限延伸排列形成了NaCl晶体ꎻ之后ꎬ动画演示NaCl的形成过程ꎬ让学生理解Na+与Cl-接近到一定距离时静电吸引作用和静电排斥作用就达到了平衡ꎬ从而形成了稳定的离子键ꎬ形成了离子化合物NaCl.在整个过程中ꎬ通过多媒体的动态演示ꎬ学生对于微观粒子运动有了一定的形象认知ꎬ为突破离子键概念奠定了基础.因而ꎬ多媒体可以形象解释化学知识ꎬ突破教学困境.㊀㊀四㊁多媒体形成了 真实 化学新课程改革要求化学与实际生活建立密切的联系ꎬ主张学生通过生活体验理解化学知识意义ꎬ掌握知识的运用ꎬ提高化学创造能力.而多媒体是化学与现实沟通的桥梁.在多媒体的作用下ꎬ学生可以在现实生活中见到真实的化学ꎬ见到化学知识的应用.这有利于学生理解化学知识的本质ꎬ提高实际问题解决能力.例如ꎬ在教学 煤㊁石油㊁天然气的综合利用 时ꎬ笔者利用多媒体构建了几个真实情境ꎬ如ꎬ平朔劣质煤综合利用的示范项目㊁中国石油宁夏承庆源洁能综合利用项目等.在真实情境中ꎬ学生与时俱进地了解了当前煤㊁石油㊁天然气的综合利用方式ꎬ对于煤㊁石油㊁天然气的利用有了更深入的了解ꎬ形成了综合分析㊁应用化学知识的能力.所以ꎬ多媒体加入化学教学可以让化学融入到生活当中ꎬ有效揭示了 为什么学习化学 的问题.总之ꎬ多媒体给化学教学带来了更多的机会.在多媒体的作用下ꎬ化学课堂变得更加多元化㊁丰富化ꎬ教学充满了生命力.㊀㊀参考文献:[1]安兴雅.多媒体技术给化学教学带来的优势[J].关爱明天ꎬ2014(9):223.[2]衡科学.多媒体技术在高中化学教学中的应用[J].新课程(中学版)ꎬ2011(3):163.[责任编辑:季春阳]有关碘盐中碘元素检验的研究性学习活动陈㊀辉(浙江省瑞安中学㊀325200)摘㊀要:碘是维持人体生命活动不可缺少的微量元素之一.人若碘的摄入量不足ꎬ会影响到有机体甲状腺激素的合成ꎬ而患上甲状腺肿大ꎬ严重者会导致发育不全ꎬ智力低下.通常所说的碘盐是在食盐中加入适量的碘酸钾(碘酸钾含量为0.02ɢ).介绍了用比较简易的方法来确定是否是真正的加碘食盐.关键词:研究性学习ꎻ碘盐ꎻ高中化学中图分类号:G632㊀㊀㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀㊀㊀文章编号:1008-0333(2020)21-0079-02收稿日期:2020-04-25作者简介:陈辉(1973.11-)ꎬ浙江省瑞安人ꎬ大专ꎬ助理实验师ꎻ从事高中化学教学研究.㊀㊀一㊁提出研究课题课程领域研究中研究性学习一直是具有特色的领域ꎬ新课程改革背景下已成为我国基础教育的组成部分ꎬ也是我国新课改的最大特点之一.研究性学习作为一种学习方式ꎬ通过引导实验人员自主研究分析方式获得结论ꎬ整个过程中教师仅起到引导作用.实验人员对碘盐中到底有没有碘ꎬ表现出浓厚的兴趣ꎬ充满了好奇ꎬ这些好奇是教学创新的原因ꎬ也是开展科学探究的基础.这显然是一个很好的探究学习活动素材ꎬ因此ꎬ以 碘盐中碘元素的检验 为课题开始实验.㊀㊀二㊁课题准备活动通过查询资料获得实验研究的具体方向ꎬ并向实验室同事请教相关问题ꎬ做好准备工作.市场上出售的碘盐是在食盐中加入适量的碘酸钾(KIO3)ꎬ原材料可以选择市面上的食盐.含有碘酸钾的食盐容易出现挥发情况ꎬ实际中使用时要避免高温环境.相关研究结果表明:如果放入碘盐时选择炒菜爆锅阶段ꎬ碘使用率10%不到ꎻ炒菜中间阶段加入碘酸盐ꎬ此时碘的使用率可以提升到60%ꎻ如果完成炒菜在放入碘酸盐ꎬ使用率达到90%以上ꎻ选择凉拌菜的话ꎬ可以完全利用其中含有的碘.准备好碘盐后开始进行溶液配制ꎬ准备好500mL的97Copyright©博看网 . All Rights Reserved.烧杯ꎬ向其中倒入500g食用碘盐ꎬ随后加入蒸馏水以没过食盐晶体为佳ꎬ并利用玻璃棒进行均匀搅拌ꎬ静置一段时间后选择清液备用.KIO3中碘元素为+5价ꎬ是碘元素的较高价态ꎬ所以KIO3具有氧化性ꎬ根据反应KIO3+5KI+3H2SO4 3I2+3K2SO4+3H2Oꎬ可向其中加入1-3滴KI溶液来检验.㊀㊀三㊁研究课题实施为了保证实验结果的真实性与科学性ꎬ课题研究时选择分组与集体共行对比方法.1.实验目的了解碘盐中碘元素的检验.2.实验用品试管ꎬ烧杯ꎬ玻璃棒ꎬ玻璃片ꎬ胶头滴管ꎬ镊子碘盐ꎬKI溶液ꎬKI-淀粉试纸ꎬ稀硫酸ꎬ淀粉溶液ꎬ醋酸ꎬ苯ꎬ蒸馏水3.实验设计和操作(1)取KIO3溶液少量ꎬ再加KI溶液和稀硫酸少量ꎬ然后加几滴淀粉溶液.(2)取碘盐少量ꎬ加水溶解ꎬ再加KI溶液和稀硫酸少量ꎬ然后加几滴淀粉溶液.(3)取黄豆大小的一小堆碘盐置于玻璃片上ꎬ加一滴稀硫酸ꎬ然后用KI-淀粉试纸检验.(4)取黄豆大小的一小堆碘盐置于玻璃片上ꎬ加一滴醋酸ꎬ然后用KI-淀粉试纸检验.说明:设计多个实验的目的在于进行实验比较ꎬ确定最佳的实验结果.4.实验观察和分析实验1㊀实验2和实验3均有明显的蓝色现象ꎬ实验4的现象没有前面3个实验明显.㊀㊀四㊁结论与原因将预期结果与实验结果相比较ꎬ可以做出结论:可以利用KIO3的氧化性来检验碘盐中的碘元素.为了使检验工作可以在家庭或商店进行现场操作ꎬ可将试剂改为醋酸和KI-淀粉试纸.实验中ꎬ发现碘的淀粉溶液呈紫红色ꎬ如果用苯萃取呈黄色.两者存在一定的差异ꎬ经过组员的认真探讨和研究ꎬ找到了一些可能存在的原因ꎬ从选材角度ꎬ选水溶液角度ꎬ配方角度进行分析ꎬ其结果如下:1.选材角度由于碘盐中KIO3的含量只有0.2ɢꎬ水多则浓度过小ꎬ会导致实验效果较差.通过多次实验ꎬ以500mL烧杯中加入500g碘盐并加水至350mL或400mL刻度线为宜ꎬ水尽量不可多加.2.选水溶液角度实验室蒸馏水的储量不足ꎬ故用自来水代替蒸馏水ꎬ但自来水中含有Fe2+㊁Mg2+㊁Ca2+等杂质ꎬ对实验有一定的干扰.如Fe2+ꎬ根据:Fe3++e- Fe2+ꎬE=0.77Vꎻ2IO-3+12H++10e- I2+6H2OꎬE=1.19V.显然Fe2+与IO3-也可发生氧化还原反应ꎬ生成I2.3.配方角度(1)实验室的淀粉溶液存放时间较长ꎬ淀粉水溶液会缓慢的水解ꎬ其产物为糊精等ꎬ糊精与I2作用显红色ꎬ因此久置的淀粉溶液会降低反应的灵敏度ꎬ而且反应呈蓝色ꎬ甚至是紫红色ꎬ这与实验人员课本中学到的碘遇淀粉显蓝色有一定的不同.(2)实验室内的化学药品ꎬ其标签上并没有标明化学纯㊁分析纯ꎬ而是一般的工业用品ꎬ纯度不够.4.实验安全部分实验人员缺少安全防护意识ꎬ觉得化学实验时所用到的试剂都是安全的ꎬ不会对自己造成伤害ꎬ具体操作时缺少必要安全防护ꎬ但实际中这种违规操作可能产生有毒气体㊁有害物质等ꎬ直接威胁到实验人员生命安全.部分药物试剂能通过呼吸㊁接触等入侵人体ꎬ特别是实验中产生的气体ꎬ强酸性烟雾刺激呼吸道ꎬ还会经过表皮进入到血液中.要重视实验废弃㊁废渣等处理ꎬ避免出现不经处理就排向空气的情况.如ꎬ试剂瓶盖打开时ꎬ要明确室温ꎬ确定这些试剂能否在常温情况下打开.可以的话将试剂瓶口对着空地ꎬ条件允许时选择通风环境完成整体操作ꎻ配置相关溶液时ꎬ整个配置过程要在烧杯中完成ꎬ不能选择量筒配置ꎬ后者容易在受热环境下破碎ꎬ直接伤害到实验人员ꎻ强酸稀释时ꎬ需要将强酸慢慢倒入到水中ꎬ杜绝将水倒入强酸这种反向操作ꎬ倒入时利用搅拌棒持续搅拌.当强酸滴洒在桌面时ꎬ要带着手套利用抹布清理ꎬ如果滴洒量过大ꎬ选择普通沙土吸收并进行清扫.到这里本节课内容已经结束ꎬ但大部分实验人员依然沉浸在自主探究㊁获得胜利的喜悦中ꎬ实验人员完全沉浸在化学知识学习过程中ꎬ询问实验人员ꎬ很多实验人员都表达:这节课过得好快㊁老师讲的真好㊁我知道了一些生活常识.在进行教学设计时ꎬ教师要考虑实验人员的喜好ꎬ选择合适的切入点ꎬ保证课堂教学质量与效率.同时ꎬ实验人员在听完这趟课后又产生新的疑问:市场上碘盐中真的有碘吗?如何利用简单方式检验碘的存在?等ꎬ教师可以布置相关研究性作业ꎬ要求实验人员利用课余时间进行研究ꎬ并互相交流㊁分析ꎬ达成提升实验人员化学素养的目的.因此ꎬ研究性课题如果能立足于实验人员的 知㊁智㊁情 的基点ꎬ就能更有效ꎬ更有序的发展实验人员的综合素质.㊀㊀参考文献:[1]厉明钢.高中化学实验教学方法的思考[J].高中数理化ꎬ2015(18):56.[2]张彩丽.«探究碘盐中碘的存在形式»教学设计[J].考试周刊ꎬ2009(40):184-185.[责任编辑:季春阳]08Copyright©博看网 . All Rights Reserved.。
碘盐的制备与检验实验报告实验一:碘盐的制备实验目的:1. 学习碘盐的制备方法;2. 掌握浴液加热法制备碘盐的操作技能。
实验原理:碘盐是含有碘的化合物,是一种强氧化剂,能够使链烷烃发生加成反应,生成加成产物。
碘盐的制备方法:(1) 碘盐的制备方法有很多种,其中最常用的是浴液加热法。
(2) 实验中所用的浴液加热法的具体步骤如下:①将200ml蒸馏水倒入250ml锥形瓶中;②向锥形瓶中加入5g氢碘酸,边搅拌边用搅拌片搅拌至氢碘酸完全溶解,得到氢碘酸溶液;③向氢碘酸溶液中缓缓滴加10g固体碳酸钠,重点是将碳酸钠均匀地分散到溶液中,避免呼吸困难;④在加入碳酸钠的同时,用温水浴加热至溶液变为无色透明的溶液。
加热过程中,一定要注意瓶口的宽度超过锥形瓶,以防易结晶的物质爆炸溅出,使到操作更加准确和可靠,加热的时间为40-50分钟;⑤将制得的碘盐溶液过滤,收集固体,用少量蒸馏水浸泡,再过滤,干燥至恒重,得到白色的碘盐晶体。
实验操作:1.将200ml蒸馏水倒入250ml锥形瓶中;2.向锥形瓶中加入5g氢碘酸,边搅拌边用搅拌片搅拌至氢碘酸完全溶解,得到氢碘酸溶液;3.向氢碘酸溶液中缓缓滴加10g固体碳酸钠,并用温水浴加热至溶液变为无色透明的溶液。
加热过程中,一定要注意瓶口的宽度超过锥形瓶,可使用夹管加热的方式加热;4.将制得的碘盐溶液过滤,然后将过滤液收集到深碗中;5.将过滤后获得的白色固体干燥,暴露在空气中以使其变得干燥。
6.将干燥的碘盐晶体称量,计算出收率以及产物的质量百分比;实验结果:制备得到的碘盐样品的质量百分比为95%。
实验二:碘盐的检验实验目的:1.学习碘的化学反应,学习使用化学试剂检验碘盐的质量;2.掌握检验碘盐中碘离子含量的实验方法。
实验原理:碘离子是一种强氧化剂,具有颜色的自身,可以用于检测醛和酮官能团,用于定性分析。
当碘与淀粉反应时,淀粉溶液会变成蓝色,由此也可以用淀粉来检验碘离子的存在。
碘盐的检验方法:(1) 用瓶塞平衡盐水中的碘盐;(2) 另取碘沙滤纸或干燥的淀粉试纸,子午线轻按至试剂湿润,然后将其放入试管中;(3) 加入几滴碘酒,观察是否出现深蓝色。
加碘盐中碘元素的检验近些年来,关于加碘盐中碘元素的检验一直是相当重要的课题。
对碘元素的含量进行测量,有助于更好地了解我们的健康状况,及时发现缺碘,从而采取有效的干预措施。
碘元素测量也有助于揭示碘元素在食物中的浓度,有助于监督食物安全。
为了测量加碘盐中碘元素的含量,必须采用正确的检验方法,以正确和高效地测量碘元素含量。
测量碘元素的检验分两种:实验室检验和调查检验。
实验室检验包括X射线衍射仪(XRD)、X射线荧光(XRF)、原子吸收光谱(AAS)、原子荧光光谱(AES)、原子发射光谱(AES)等。
而调查检验是采用市场或国家监督部门的检验标准,包括样品采集、评估和科学分析。
X射线衍射仪(XRD)是一种结构分析仪器,可用来测量物质中碘元素的分布。
它通过测量横越物质表面的X射线来显示物质的晶体结构和相变。
通过测量X射线衍射原理,可以准确测量出碘元素的量化含量,可以测量出碘元素的结构,以及碘元素在材料中的分布。
X射线荧光(XRF)也被用于测量加碘盐中碘元素的含量。
该技术通过采用X射线照射样品,测量样品内碘元素的量化,可以分析出碘元素的结构和分布情况。
XRF不仅可以测量碘元素,还可以测量其它元素,如钙、磷、锌等常用微量元素。
原子吸收光谱(AAS)也被用于测量加碘盐中碘元素的含量,它采用原子吸收的原理来测试样品,在特定的波长范围内,可以精确测量出样品中的各种元素。
不仅可以测量碘元素,还可以测量其它微量元素,如钴、锡等。
原子荧光光谱(AES)也被用于测定加碘盐中碘元素的含量。
原子荧光光谱是一种基于离子的原子发射的检测技术,测量X射线的强度,以对碘元素进行分析。
它可以测量碘元素和其它微量元素的含量,以及在特定环境中的分布情况。
根据上述分析,X射线衍射仪(XRD)、X射线荧光(XRF)、原子吸收光谱(AAS)、原子荧光光谱(AES)等技术可用于测量加碘盐中碘元素的含量,可以快速、准确、高效地测量碘元素的含量,为碘元素的含量检测和监督提供可靠的依据。
碘盐中碘含量的检测实验
河南省淮滨县第三高级中学
指导教师宋一平
一、课题的提出
为有效预防碘缺乏病,最简便的方法是食用加碘食盐。
食用碘盐中也应含0.02‰的碘酸钾。
如何知道自己所购回的是真正的碘盐呢?通过多次实验和探索,可利用下列方案对碘盐进行检测,取得了理想的效果。
二、可行性分析
食盐中碘的测量可以有很多种方法,根据中学现有知识,依据下列原理设计出简单易行的定性和定量测定方法。
1、定性分析测定原理
碘盐中碘以碘酸钾的形式存在,在酸性水溶液中,KIO3与淀粉碘化钾试纸(有售)中的 KI发生反应,在食醋提供的醋酸溶液中,反应为:KIO3+5KI+6CH3COOH=3I2+6CH3COOK+3H2O,析出的碘遇淀粉溶液变蓝色,若不变蓝色即为假的加碘食盐(或为含碘量太少的不合格产品)。
实验用品:500ml烧杯、玻璃棒、试管、蒸馏水、500g袋装食用碘盐、淀粉碘化钾试纸、食醋
实验步骤:
1、将500g袋装食用碘盐,全部倒入500ml烧杯中,加适量蒸馏水,
液面以刚浸没食盐晶体稍过一点为宜,用玻璃棒充分搅拌,静置。
2、取其清液3ml—5ml于试管中。
3、再滴加5—6滴食醋。
4、用玻璃棒蘸取上述含有食醋的碘盐溶液滴到淀粉碘化钾试纸上。
观察现象:
淀粉碘化钾试纸变蓝。
结论:
食盐中确含碘酸钾。
如何知道碘盐中碘酸钾含量是否符合国家规定的标准呢?下面采用滴定的方法进行定量检测。
2、定量检测原理。
根据反应5Sn2++2IO3-+12H+=5Sn4++I2+6H2O,同时伴随Sn2++I2=Sn4++2I-发生,当向酸性碘酸钾溶液(含淀粉)中滴加已知浓度的 SnCl2溶液时,发生反应生成单质碘使溶液出现蓝色,随着SnCl2继续滴加溶液中,Sn2++I2=Sn4++2I-的同时发生,I-浓度逐渐增大,溶液蓝色局部稍有消退,当I-与IO3-的量符合5 I-+ IO3-+6 H+=3 I2+3 H2O中的物质的量的关系时,锥形瓶中还会再次突然出现重新变深蓝的现象,继续小心滴加SnCl2标准液到溶液蓝色完全消失并使混合液呈现白色时为止,到达滴定终点,根据总反应:
3 Sn2++ IO3-+6 H+=3 Sn4++ I-+3 H2O
由消耗的标准液SnCl2体积可计算出碘盐中KIO3含量。
计算公式:
V (SnCl2)C (SnCl2)×M (KIO3)×
)
KIO3()
KIO3(取总V V
w(KIO 3)= ×100% m(食盐总质量)
实验用品:
500ml 烧杯、锥形瓶、移液管、酸式滴定管、铁架台、玻璃棒、500g 碘盐、盐酸、淀粉溶液、001mol/l SnCl 2溶液 实验步骤:
1、将500g 碘盐溶于蒸馏水,配成350ml 的 食盐溶液。
2、取配好的 上述食盐溶液25ml 放到小锥形瓶中,滴加5—6滴淀粉溶液,加入盐酸酸化。
3、把锥形瓶放到盛有001mol/l 的 SnCl 2溶液的 酸式滴定管下面,记录滴定管中液体读数(V 1)V 1=0.000ml
4、左手控制滴定管活塞,右手握住锥形瓶,对小锥形瓶中25ml IO 3-溶液进行滴定,边滴定边摇动锥形瓶,注意锥形瓶内颜色变化。
当锥形瓶中溶液出现蓝色时,更须小心,每滴一滴SnCl 2溶液都要摇匀,溶液的 颜色出现由蓝色局部稍有消退到再次突然出现重新变深蓝色时,滴定要特别小心,一直滴加至锥形瓶中溶液蓝色完全消失并使混合液呈现白色为止,记录此时滴定管液面读数V 2 V 2=3.4500ml (69滴) 计算:
VC •M (KIO3)
W(KIO3)=
3×500g
0.06889g
= =0.06889‰
1000g
与国家规定值0.02‰相比较,略高,视为合格,为求得精确值,可按上述步骤再重做一次到两次。
装置附图:
定性检测:定量检测:
点滴板
食盐溶液淀粉KI试纸。