课题常见的酸和碱时酸碱盐溶液的导电性
- 格式:pptx
- 大小:1.09 MB
- 文档页数:18


常见的酸和碱基础知识(一)一、酸碱盐的概念及溶液的导电性:1、酸:电离时得到的阳离子全部是_______离子的化合物,酸=()+()2、碱:电离时得到的阴离子全部是_______离子的化合物,碱=()+()3、盐:电离时得到_______和_______的化合物,盐=()或()+()4、溶液中阳离子所带正电荷总数与阴离子所带负电荷总数_______。
5、酸碱盐溶液能够到点的原因是___________________________________。
二、酸碱指示剂6、酸碱指示剂:能够鉴别溶液______________的物质叫做酸碱指示剂。
常用的酸碱指示剂有_______色的_______溶液和_______色的_______溶液。
8、酸溶液_______是酸性溶液;但酸性溶液_______都是酸溶液,如硫酸铵、硝酸铵溶液显酸性,其溶质是_____________________,他们不属于_______而是_______。
同样,碱溶液_______是碱性溶液,但是践行溶液_______都是碱溶液。
如碳酸钠、碳酸氢钠、碳酸钾都是_______性,其溶质是______________,他们不属于_______而是_______。
常见的酸和碱基础知识(二)3、浓硫酸的特性(1)脱水性:能够将纸张、木材、布料、皮肤里的氢、氧元素按水的组成比夺去,使他们脱水生成黑色的碳,发生碳化。
(思考:脱水性是什么性质?)(2)_______:浓硫酸跟空气接触,能够_______空气里的水分,可用作某些气体的_______。
(3)强烈的_______。
(4)强氧化性:与金属反应时一般不生成氢气,而生成水。
4、浓硫酸的稀释:稀释浓硫酸时,应将_______沿其杯壁慢慢倒入_______中,且边倒边搅拌。
而不能把_______往_______里倒,以免水沸腾将硫酸带出,造成危险。
(因为浓硫酸溶于水时放出大量的热),万一浓硫酸洒在皮肤上,请立即______________,然后涂3%-5%的______________溶液。


课题1 常见的酸和碱课时1 认识酸碱盐必考必会一、溶液的导电性1、溶液导电的原因存在的可以自由移动的带电离子2、电离:定义:物质溶解于水后,离解成自由移动的离子的过程。
表示方法:电离方程式注:难电离的物质是:___________________________________________质量守恒电荷守恒:__________________________________________________二、酸、碱、盐1、常见的酸○1盐酸、硝酸和硫酸都能够导电,说明在水溶液中电离生成了能够自由移动的离子。
(盐酸)HCl ___________________________(硫酸)H2SO4___________________________(硝酸)HNO3___________________________○2定义:电离时生成的阳离子全部是氢离子的化合物叫做酸。
○3初中常见的几种酸:__________________________________________________○4常见酸的命名方法根据有无氧元素分为:有氧酸:例如:________________________; 命名__________无氧酸:例如:________________________;命名__________根据电离出氢离子的个数:一元酸:例如_________________________二元酸:例如_________________________三元酸:例如:_______________________注:醋酸(CH3COOH )为几元酸_____________________________________读名称找到氢2.常见的碱○1氢氧化钠、氢氧化钡和氢氧化钙的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
氢氧化钠:______________________________氢氧化钡:______________________________氢氧化钙:_____________________________○2定义:____________________________________________________○3常见的碱:_________________________________________________○4碱的命名方法:氢氧化某或氢氧化亚某例如:___________________________________________注:碱中一定含有含有金属元素???3.常见的盐○1碳酸钠、硫酸钾和氯化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
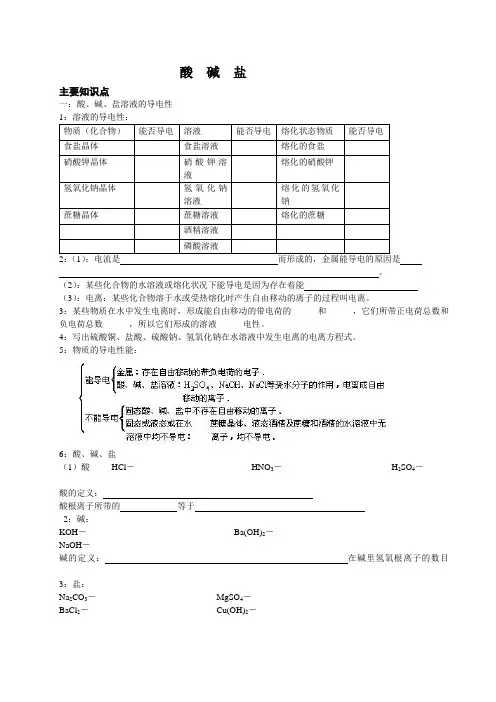
酸碱盐主要知识点一:酸、碱、盐溶液的导电性1:溶液的导电性:物质(化合物)能否导电溶液能否导电熔化状态物质能否导电食盐晶体食盐溶液熔化的食盐硝酸钾晶体硝酸钾溶液熔化的硝酸钾氢氧化钠晶体氢氧化钠溶液熔化的氢氧化钠蔗糖晶体蔗糖溶液熔化的蔗糖酒精溶液磷酸溶液2:(1):电流是而形成的,金属能导电的原因是。
(2):某些化合物的水溶液或熔化状况下能导电是因为存在着能(3):电离:某些化合物溶于水或受热熔化时产生自由移动的离子的过程叫电离。
3:某些物质在水中发生电离时,形成能自由移动的带电荷的______和______,它们所带正电荷总数和负电荷总数______,所以它们形成的溶液______电性。
4:写出硫酸铜、盐酸、硫酸钠、氢氧化钠在水溶液中发生电离的电离方程式。
5:物质的导电性能:6:酸、碱、盐(1)酸HCl-HNO3-H2SO4-酸的定义:酸根离子所带的等于2:碱:KOH-Ba(OH)2-NaOH-碱的定义:在碱里氢氧根离子的数目3:盐:Na2CO3-MgSO4-BaCl2-Cu(OH)2-盐的定义:在盐中,金属离子所带的二:几种常见的酸(一):盐酸(HCl)盐酸是盐酸的物理性质:瓶口的白雾是什么?白雾是怎样产生的?说明浓盐酸具有什么性质?如何保存浓盐酸?敞口放置后的浓盐酸质量和溶质的质量分数有何改变?盐酸的化学性质:1:盐酸跟紫色石蕊、酚酞等物质的反应:紫色石蕊溶液遇盐酸变色,无色酚酞遇盐酸不变色2:盐酸跟活泼的金属反应,一般生成(现象为:有气泡生成,固体逐渐减小至消失或金属溶于酸)(1):锌和稀盐酸反应:Zn + HCl-(2):铁和稀盐酸反应:Fe + HCl-(3):镁和稀盐酸反应:Mg+ HCl-(4):铝和稀盐酸反应:Al + HCl -3:盐酸跟金属氧化物(碱性氧化物)反应,一般生成Fe2O3 + HCl -CuO + HCl -4:盐酸跟碱反应,一般生成(1):盐酸和烧碱起反应:HCl + NaOH -(2):盐酸和氢氧化钾反应:HCl + KOH -(3):盐酸和氢氧化铜反应:HCl + Cu(OH)2-(4):盐酸和氢氧化钙反应:HCl + Ca(OH)2-(5):盐酸和氢氧化铁反应:HCl + Fe(OH)3-5:盐酸与某些盐反应,一般生成(1):大理石与稀盐酸反应:CaCO3 + HCl -(2):碳酸钠与稀盐酸反应: Na2CO3 + HCl -(3):碳酸镁与稀盐酸反应: MgCO3 + HCl -(4):盐酸和硝酸银溶液反应:HCl + AgNO3-复分解反应盐酸的用途(二):硫酸(H2SO4)浓硫酸(1)浓硫酸具有哪些物理性质?(2)浓硫酸具有哪些特性?①吸水性(可做干燥剂)②脱水作用(使某些物质碳化)③溶解于水放出大量的热。



酸、碱、盐溶液的导电性学习目标1、了解某些化合物溶于水后,能导电的原因;2、了解电离的概念,掌握电离方程式的书写;3、从离子的观点理解酸、碱、盐的概念。
知识讲解1.电流形成的原因是带电粒子的定向移动。
在金属中存在着能自由移动的电子,所以金属能导电。
由此可推知能导电的物质中必须有能自由移动的带电的粒子。
如果一种物质中存在着带电粒子,但这些带电粒子不能自由移动,那么它也不能导电。
2.一些化合物(如酸、碱、盐)溶于水,在水分子的作用下(或受热熔化时),离解成能自由移动的带电粒子—离子,这个过程叫电离。
这样我们就可以解释为什么食盐固体不导电,而食盐水却可以导电的原因了。
这主要是因为在食盐()固体中,虽然存在带电的和,但这些离子不能自由移动,所以固体不导电;当食盐溶于水中时,在水分子的作用下,原来紧密排列的和被解离开,可以自由移动了。
如果接通电源,这些带电的离子就会定向移动。
从而可以形成电流一导电了。
所以,物质的水溶液导电的原因是在溶液中存在自由移动的离子。
显然,一些化合物的电离是在水分子的作用下自然产生的,跟是否通电无关。
溶于水电离后,整个溶液仍是电中性。
3.电离的表示方法—电离方程式。
书写方法①正确写出该物质的化学式。
(尊重事实,用化合价检查正误)②离解通常发生在正价与负价元素(或原子团)的连接处。
③离子所带电荷数与该离子在化合物中的化合价数值相同,“+”、“-”号相同,写出离子符号。
(一般原子团电离时不解离,不拆开)。
④配平:在离子符号前填上适当的化学计量数,使阳离子所带正电荷总数与阴离子所带负电荷总数相等;使电离方程式左、右两侧的各元素的原子个数相等。
⑤一般难电离(难溶于水)的物质不写电离方程式。
(要求熟记书后的溶解性表)4.一些物质的电离方程式如下:5.酸、碱、盐的电离酸:电离时生成的阳离子全部是氢离子的化合物。
酸=+酸根离子(由氢和酸根组成)电离生成的的个数=酸根离子所带电荷数特点:阳离子只有,这是判断依据。


酸碱盐主要知识点一:酸、碱、盐溶液的导电性1:溶液的导电性:物质(化合物)能否导电溶液能否导电熔化状态物质能否导电食盐晶体食盐溶液熔化的食盐硝酸钾晶体硝酸钾溶液熔化的硝酸钾氢氧化钠晶体氢氧化钠溶液熔化的氢氧化钠蔗糖晶体蔗糖溶液熔化的蔗糖酒精溶液磷酸溶液2:(1):电流是而形成的,金属能导电的原因是。
(2):某些化合物的水溶液或熔化状况下能导电是因为存在着能(3):电离:某些化合物溶于水或受热熔化时产生自由移动的离子的过程叫电离。
3:某些物质在水中发生电离时,形成能自由移动的带电荷的______和______,它们所带正电荷总数和负电荷总数______,所以它们形成的溶液______电性。
4:写出硫酸铜、盐酸、硫酸钠、氢氧化钠在水溶液中发生电离的电离方程式。
5:物质的导电性能:6:酸、碱、盐(1)酸HCl-HNO3-H2SO4-酸的定义:酸根离子所带的等于2:碱:KOH-Ba(OH)2-NaOH-碱的定义:在碱里氢氧根离子的数目3:盐:Na2CO3-MgSO4-BaCl2-Cu(OH)2-盐的定义:在盐中,金属离子所带的二:几种常见的酸(一):盐酸(HCl)盐酸是盐酸的物理性质:瓶口的白雾是什么?白雾是怎样产生的?说明浓盐酸具有什么性质?如何保存浓盐酸?敞口放置后的浓盐酸质量和溶质的质量分数有何改变?盐酸的化学性质:1:盐酸跟紫色石蕊、酚酞等物质的反应:紫色石蕊溶液遇盐酸变色,无色酚酞遇盐酸不变色2:盐酸跟活泼的金属反应,一般生成(现象为:有气泡生成,固体逐渐减小至消失或金属溶于酸)(1):锌和稀盐酸反应:Zn + HCl-(2):铁和稀盐酸反应:Fe + HCl-(3):镁和稀盐酸反应:Mg+ HCl-(4):铝和稀盐酸反应:Al + HCl -3:盐酸跟金属氧化物(碱性氧化物)反应,一般生成Fe2O3 + HCl -CuO + HCl -4:盐酸跟碱反应,一般生成(1):盐酸和烧碱起反应:HCl + NaOH -(2):盐酸和氢氧化钾反应:HCl + KOH -(3):盐酸和氢氧化铜反应:HCl + Cu(OH)2-(4):盐酸和氢氧化钙反应:HCl + Ca(OH)2-(5):盐酸和氢氧化铁反应:HCl + Fe(OH)3-5:盐酸与某些盐反应,一般生成(1):大理石与稀盐酸反应:CaCO3 + HCl -(2):碳酸钠与稀盐酸反应: Na2CO3 + HCl -(3):碳酸镁与稀盐酸反应: MgCO3 + HCl -(4):盐酸和硝酸银溶液反应:HCl + AgNO3-复分解反应盐酸的用途(二):硫酸(H2SO4)浓硫酸(1)浓硫酸具有哪些物理性质?(2)浓硫酸具有哪些特性?①吸水性(可做干燥剂)②脱水作用(使某些物质碳化)③溶解于水放出大量的热。
酸碱盐溶液的导电性一、素质教育目标(一)知识教学点1.溶液的导电性。
2.电离。
3.常见酸、碱、盐的电离方程式。
4.酸、碱、盐的初步概念。
(二)能力训练点通过溶液导电性和电离概念的教学过程,培养学生的抽象思维能力和逻辑推理能力。
(三)德育渗透点通过观察实验,对实验现象进行从宏观到微观,从现象到本质进行抽象思维分析和逻辑推理,给予科学的解释的过程中,帮助学生形成抽象思维能力和逻辑推理能力。
二、教学重点、难点、疑点及解决办法1.重点(1)电离。
(2)书写常见的酸、碱、盐的电离方程式。
2.难点教会学生根据宏观现象,进行微观本质的分析方法和逻辑推理能力,3.疑点(1)酸、碱、盐溶液导电和金属导电的本质区别。
(2)NaHSO4和Cu2(OH)2CO3属于哪一类化合物?4.解决办法采用的方法是边实验,边分析,边讨论,要注意调动学生学习的主动性和积极性,启迪他们积极思考问题,用他们已知的知识通过思维和现象,推理去理解新的知识。
三、课时安排2课时。
四、教具准备试验物质导电性的装置,干燥的氯化钠固体,硝酸钾固体,氢氧化钠固体,蔗糖固体,酒精,蒸馏水,氯化钠溶液,硝酸钾溶液,氢氧化钠溶液,磷酸溶液,酒精溶液,蔗糖溶液,盐酸,硝酸溶液,硫酸溶液,氢氧化钾溶液,氢氧化钡溶液,碳酸钠溶液,硫酸镁溶液,氯化钡溶液。
五、学生活动设计1.教师演示课本第149页[实验8—1]。
学生观察灯泡是否亮。
[目的:培养学生观察能力,并使学生产生学习兴趣。
]2.教师提问:(1)根据已有的物理知识回答,电流是怎么形成的?金属能导电的原因?(2)氯化钠是哪种类型的化合物?它的组成微粒是什么?[目的:启迪学生思维,引起疑问进一步激发兴趣。
]3.教师将上述实验物质加入蒸馏水配制溶液,再分别做导电性实验。
学生观察实验现象,想想这是为什么?[目的:进一步培养观察能力和思维能力,引起注意,启迪思维,提高兴趣。
]4.教师提问:上述物质变成溶液后,为什么有的物质能够导电?有的物质仍不能导电呢?相邻座位的学生互相讨论,并在教师引导学生讨论的过程中得出答案。
初中化学《酸、碱、盐溶液的导电性》优质教学设计一等奖《初中化学《酸、碱、盐溶液的导电性》优质教学设计一等奖》这是优秀的教学设计一等奖文章,希望可以对您的学习工作中带来帮助!1、初中化学《酸、碱、盐溶液的导电性》优质教学设计一等奖教案示例酸、碱、盐溶液的导电性之三第一课时教学目的知识:通过溶液导电性实验,了解电离,初步学会电离方程式的书写。
能力:培养并发展学生分析问题、抽象思维和逻辑推理的能力。
思想教育:对学生进行从宏观到微观,透过现象看本质的辨证唯物主义观点教育。
培养严谨认真的科学态度。
重点难点电离、电离方程式的书写。
教学方法实验、讨论、启发引导法。
教学用品仪器:低压直流电源、小灯泡、导线、盛待测物的容器、石墨电极。
药品:食盐固体、硝酸钾固体、氢氧化钠固体、蔗糖固体、蒸馏水、酒精、氯化钠溶液硝酸钾溶液、氢氧化钠溶液、磷酸溶液、酒精溶液、蔗糖溶液。
教学过程附1:课堂练习一1.为什么用湿手接触正在通电的电器设备更容易发生触电事故?附2:课堂练习二。
2.写出下列物质的电离方程式:(1)氯化镁(2)硫酸(3)氢氧化钙(4)氯化钾(5)硝酸3.下列电离方程式错误的是4.下列物质中存在氯离子的是A.Cl2B.HCl气体C.NaClD.KClO35.物质发生电离时一定相等的是A.阴离子和阳离子个数B.阴离子和阳离子所带电性C.每个阴离子和阳离子所带电荷数D.阴离子和阳离子所带电荷总数附3:课堂练习答案1.由于出汗,人的皮肤上都有氯化钠等物质,当手湿的时候,这些物质发生电离形成自由移动的阴、阳离子,在接触电器设备时这些离子导电,致使发生触电事故。
2.(1)MgCl2=Mg2++2Cl-(3)Ca(OH)2=Ca2++2OH-(4)KCl=K++Cl-3.D4.C5.D附4:随堂检测一、填空:1.物质溶解于水时离解成______的过程叫电离。
2.某些物质在水中发生电离时,形成能自由移动的带电荷的.______和______,它们所带正电荷总数和负电荷总数______,所以它们形成的溶液______电性。