最新5章腐蚀金属电极的极化
- 格式:ppt
- 大小:761.50 KB
- 文档页数:79


极化曲线分析钢筋的腐蚀过程极化曲线分析钢筋的腐蚀过程摘要:为了确定混凝土中钢筋锈蚀速率的控制因素,运用腐蚀极化曲线图分析活化钢筋阴阳极极化曲线和腐蚀电流随环境相对湿度的变化规律,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程。
结果表明,有锈蚀产物存在时,锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程的阴极去极化剂,钢筋的总腐蚀电流为氧去极化和锈蚀产物去极化产生的腐蚀电流的加和。
钢筋的总腐蚀电流随着环境相对湿度的提高而增大,和氧在混凝土中的扩散速率的变化趋势截然相反,从而证明氧仅是混凝土内钢筋开始的锈蚀的必备条件,但却不是混凝中钢筋锈蚀过程控制素。
关键词:混凝土;钢筋;极化曲线;氧;腐蚀产物混凝土中钢筋的锈蚀是一个非常复杂的电化学过程,目前国内外学者在建立钢筋锈蚀速率模型时,普遍借鉴了金属腐蚀学的研究成果,假定混凝土中钢筋的锈蚀速率受氧扩散速率所控制[1-7],这种假定的正确和合理性直接决定了由此建立的理论模型的适用程度.由于金属腐蚀学研究的对象,大都是金属处于溶液、水或土壤中,整个腐蚀过程受氧扩散控制已为无数的研究所证实。
然而大气环境混凝土中钢筋的腐蚀和前几种不同,目前已有的研究发现钢筋的锈蚀速率随混凝土湿含量增大而增大,直至混凝土饱水,钢筋锈蚀速率也没有出现下降[8-9],和混凝土中氧扩散速率的变化趋势[10]截然相反,这是上述假定所无法解释的.姬永生等[11]通过试验研究和钢筋锈蚀产物物相组成的变化分析证明锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程阴极反应的新的去极化剂,传统的氧作为单一阴极去极化剂的锈蚀机理面临着严峻的挑战。
因此,探究高湿供氧困难情况下混凝土内钢筋仍高速锈蚀的内在机理,对于建立正确、合理钢筋锈蚀速率模型具有重要的意义。
腐蚀极化曲线图是进行金属腐蚀机理分析的重要工具之一。
本文在文献[11]研究的基础上,运用腐蚀极化曲线图全面解释混凝土中钢筋锈蚀过程,探究混凝土由干燥到饱水变化过程混凝土内钢筋锈蚀速率变化的内在机理,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程,为预测钢筋混凝土的使用寿命奠定基础。


金属电极的极化曲线是描述金属电极在电化学反应过程中电势与电流之间关系的曲线。
它通常是通过进行极化实验来获取的,其中对电极施加一定的电位或电流,并测量相应的电流或电势响应。
极化曲线通常具有三个主要区域:
1. 阳极极化区:在该区域内,电极表面发生氧化反应,即金属电极溶解或氧化。
在该区域,电流随电位的增加而增加,形成一个斜上升的曲线。
2. 反极化区:在该区域内,电极表面的氧化反应逐渐减弱或停止,电流开始饱和。
在该区域,电流变化缓慢,形成一个相对平缓的曲线。
3. 阴极极化区:在该区域内,电极表面发生还原反应,即金属电极得到电子或还原。
在该区域,电流随电位的增加而减小,形成一个斜下降的曲线。
极化曲线的形状和特征取决于金属电极的特性、电解质溶液的成分和浓度,以及外部施加的电位或电流。
通过分析极化曲线,可以获得有关电极的电化学反应、电化学反应动力学以及电极的电化学性能的信息。
这对于研究腐蚀、电镀、电池等电化学过程具有重要意义。

一、实验目的1. 了解腐蚀极化的基本原理。
2. 掌握腐蚀极化实验的方法和步骤。
3. 分析腐蚀极化曲线,研究腐蚀速率与极化参数的关系。
二、实验原理腐蚀极化实验是研究金属腐蚀过程的一种重要方法。
在腐蚀过程中,金属表面会发生电化学反应,导致金属溶解。
腐蚀极化实验通过测量金属在不同电极电势下的腐蚀电流,绘制腐蚀极化曲线,分析腐蚀速率与极化参数的关系,从而了解金属的腐蚀行为。
三、实验材料与仪器1. 实验材料:纯铁片、饱和食盐水、pH=7的蒸馏水、饱和硫酸铜溶液、饱和氯化钠溶液、饱和硫酸锌溶液、pH=1的盐酸溶液、pH=14的氢氧化钠溶液、玻璃电极、甘汞电极、腐蚀池、腐蚀电流测量仪、恒电位仪、数字万用表、电极线、砂纸等。
2. 实验仪器:腐蚀池、恒电位仪、数字万用表、腐蚀电流测量仪、玻璃电极、甘汞电极、电极线、电极夹具、磁力搅拌器、电子天平、秒表等。
四、实验步骤1. 准备工作:将纯铁片用砂纸打磨至表面光滑,清洗并晾干。
准备不同pH值的溶液,将电极分别浸泡在相应溶液中。
2. 测量腐蚀电流:将铁片作为工作电极,玻璃电极作为参比电极,甘汞电极作为辅助电极,将电极连接到腐蚀电流测量仪上。
调节腐蚀电流测量仪,使腐蚀电流为1mA。
记录此时腐蚀电流值。
3. 测量极化参数:逐渐改变腐蚀电流,每次改变0.1mA,记录相应的腐蚀电流值。
重复步骤2,共测量10次。
4. 绘制腐蚀极化曲线:以腐蚀电流为横坐标,电极电势为纵坐标,绘制腐蚀极化曲线。
五、实验结果与分析1. 实验结果:通过腐蚀极化实验,得到了纯铁在不同pH值溶液中的腐蚀极化曲线。
2. 结果分析:(1)腐蚀速率与电极电势的关系:在腐蚀极化曲线上,腐蚀电流随电极电势的增大而减小,说明腐蚀速率与电极电势呈负相关。
(2)腐蚀速率与pH值的关系:在pH=7的溶液中,腐蚀速率最小;在pH=1和pH=14的溶液中,腐蚀速率较大。
这表明金属在弱酸性或弱碱性溶液中腐蚀速率较小,而在强酸性或强碱性溶液中腐蚀速率较大。



第5章金属的钝化铁、铝等金属在稀HNO3或稀H2SO4中能很快腐蚀,但是在浓HNO3或浓H2SO4中腐蚀现象几乎完全停止。
1836年斯柯比(Schobein)称金属在浓HNO3或浓H2SO4中获得的耐蚀状态为钝态。
从此,人们对金属的钝化进行了广泛的研究。
现今钝化在控制金属腐蚀和提高金属材料的耐蚀性方面占有十分重要的地位。
经钝化的铁重新放入稀HNO3中也不会再溶解,因为铁处于钝态。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为金属的钝化(Passivation of metals)。
由某些钝化剂(氧化剂)所引起的金属钝化,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4和O2等氧化剂都可使金属钝化。
此外,用电化学方法也可使金属钝化,如将铁置于H2SO4溶液中作为阳极,用外加的直流电使铁的电位升高到一定数值(即阳极极化),也能使铁的表面生成钝化膜。
由阳极极化引起的金属钝化现象,叫电化学钝化或阳极钝化。
研究钝化现象有很大的实际意义。
金属处于钝化状态能显著降低金属的自溶解和阳极溶解速度,保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如化学电源中电极的钝化常常带来有害的后果,使最大输出电流密度以及活性物质的利用率降低。
所以,长期以来,对钝化现象的研究受到很大的重视。
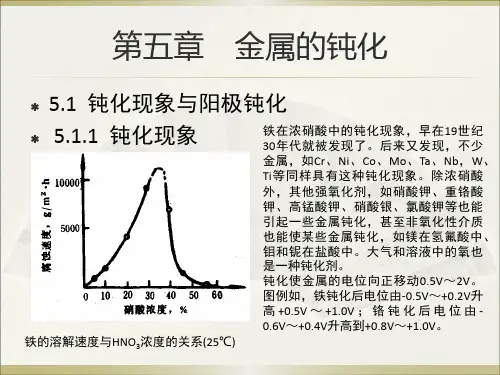
5.1 金属的钝化现象5.1.1 金属钝化的两种方式—化学钝化与电化学钝化1.化学钝化如果把一块铁片放在HNO3中,并考察铁片的溶解速度与HNO3浓度的关系(如图5.1所示),可以发现铁在稀硝酸中剧烈地溶解,并且铁的溶解速度随着HNO3浓度的增大而迅速增大。
当HNO3的浓度增加到30~40%时,铁的腐蚀速度达到最大值,若继续增加HNO3浓度超过40%,则铁的溶解速度就突然下降到原来的的1/4000,这一现象称为钝化。
如果继续增大HNO3浓度到90%以上,腐蚀速度又有较快的上升(在95%HNO3中铁的腐蚀速度约为90%HNO3中的10倍),这一现象称为过钝化。


第五章腐蚀的控制⽅法第五章腐蚀的控制⽅法在不同情况下引起⾦属腐蚀的原因是不尽相同的,因此根据不同情况采⽤的防腐技术也是多种多样的。
在⽣产实践中⽤的最多的防腐技术⼤致可分为如下⼏类:1、合理选材,根据不同介质和使⽤件选⽤合适的⾦属材料和⾮⾦属材料;2、阴极保护:利⽤⾦属电化学腐蚀原理,将被保护⾦属设备进⾏外加阴极化以降低或防⽌⾦属腐蚀;3、阳极保护,对于钝化溶液和易钝化⾦属组成的腐蚀体系,可以采⽤外加阳极电流的⽅法使被保护⾦属设备进⾏阳极钝化以降低⾦属腐蚀;4、介质处理,包括去除介质中促进腐蚀的有害成分(例如锅炉给⽔的除氧)调节介质的PH 值及改变介质的湿度等;5、添加缓蚀剂。
往体系中添加少量能阻⽌或减缓⾦属腐蚀的物质以保护⾦属;6、⾦属表⾯覆盖层。
在⾦属表⾯喷、射、渗、镀、涂上⼀层耐蚀性好的⾦属或⾮⾦属物质以及将⾦属进⾏氧化处理。
使被保护⾦属表⾯与介质机械隔离⽽降低⾦属腐蚀;7.合理的防腐蚀设计及改进⽣产⼯艺流程以减轻或防⽌⾦属的腐蚀。
每⼀种防腐蚀措施都有其应有范围和条件。
使⽤时要注意。
对⼀种情况有效的措施,在另⼀种情况下就可能是⽆效的;有时甚⾄是有害的。
例如:阳极保护只适⽤于⾦属在介质中易于阳极钝化的体系,如果不能造成钝态,则阳极极化不仅不能减缓腐蚀,反⽽会加速⾦属的阳极溶解。
另外,在某些情况下,采取单⼀的防腐蚀措施其效果并不明显,但如果采⽤两种或多种防腐蚀措施进⾏联合保护,就⽐单⼀种⽅法效果好得多。
对于⼀个具体的腐蚀体系究竟采⽤哪种措施的防腐蚀,应根据腐蚀原因,环境条件各种措施的防腐蚀效果,施⼯难易以及经济效益综合考虑。
第⼀节合理选⽤耐腐蚀材料⼀、设备的⼯作条件(介质,温度和压⼒)对材料的要求设备的⼯作介质的情况是选材时⾸先要分析考虑的。
例如⼯作介质是硝酸,其为氧化性酸,应选⽤在氧化性介质中易形成氧化膜的材料,如不锈钢,铝,钛等⾦属材料,稀硝酸⽤不锈钢,浓硝酸⽤纯铝;如果⼯作介质是盐酸,其为还原性酸,应选⽤⾮⾦属材料。