溶液复习课李少坤
- 格式:pptx
- 大小:3.54 MB
- 文档页数:28

第九单元溶液复习教学设计第2课时一、教学设计思路承接上节课的复习思路,借助“溶液”辐射出来的第七方面内容——“分类”这条复习主线对本单元的课题2中的重要知识进行穿连复习和加深理解。
二、教案课题第九单元溶液复习课(第2课时)教学目标1.课题2的基本知识和技能;2.继续完善全单元的知识网络编织;3.学会处理好几组概念的区别与联系(①溶解性和溶解度;②溶解度和溶质质量分数;③饱和溶液、不饱和溶液和浓溶液、稀溶液);4.进一步体验知识整理的优越性和重要性重点课题2的基本知识和技能难点培养学生管理知识的意识和能力教学方法引导、问答、讨论、练习仪器用具电脑或投影仪教师活动学生活动设计意图[提问]同学们,上节课我们复习了溶液哪些方面的内容?[要求]好,现在请一位同学用网络的形式把这些内容整合在一起。
(提示:可以用我们上节的板书形式,也可以用你特有的形式把这些知识点在黑板上整合体现出来。
)[教师巡回检查和指导] 总体回答:溶液的组成、特征、命名、用途、配制和浓度表示方法。
一位学生在黑板上画知识网络图,其他学生在自己的练习簿上画。
强化用网络法整理知识的意识和能力,同时为下面的教学做好准备。
[讲述]××同学(上讲台画网络图的同学)画很不错,其他同学也构建很好,大大地出乎我的意料。
[讲述]接下来我们来复习上节课有的同学想到的问题,即溶液分类问题。
[板书](在学生在黑板上画出的知识网络图上继续完善)听讲给予学生构建知识网络的信心(即使学生构建得不怎么样,也要给予鼓励)尊重学生的劳动成果,体现师生协作精神。
[提问和板书]按溶液的饱和程度,可把溶液分为?[提问]饱和溶液的概念是什么?如何判断一种溶液是不是饱和溶液?[提问]很好,请坐下。
那在讲溶液饱和或不饱和问题上,为什么要指明“温度”和“溶剂量”?[提问]回答很精彩。
你刚才解释涉及到饱和溶液和不饱和溶液的转化,请你继续说出饱和溶液和不饱和溶液互相转化的一般法。


九年级下册化学第九单元《溶液》复习课教案
一、【教学目标】
1、通过对本单元各知识点进行梳理,形成溶液的知识体系;培养学生自己构建知识网络意识和能力
2、加深对溶液、饱和溶液、溶解度、溶质的质量分数等概念的理解和掌握。
利用溶解度曲线解决相关问题并能进行溶质质量分数相关的计算。
二、【教学重点】
1.理解和掌握本单元的基本概念。
2. 能利用溶解度曲线解决相关问题。
三、【教学难点】
学生构建知识网络意识和能力的培养。
四、【教学过程】
情景导入
1.溶液在生产、生活中应用广泛,我们应该掌握溶液哪些方
面的知识?
2.出示学习目标,由学生对学习目标进行解读。
[讲述]根据同学们对知识的梳理,可以清楚的知道溶液的组成、分
类等;前面学习过程中我们采用了树状图将物质分类的知识进行整
合,对于溶液我们能不能也采用这种方式对知识进行整理。
[展示]
溶质
1、组成
溶剂浓溶液
不限条件的粗略分类
2、分类稀溶液
溶液
限定条件的分类:
增加溶剂、升高温度
饱和溶液不饱和溶液
增加溶质、蒸发溶剂、降低温度
溶质溶解性的量度————溶解度
3、量度
溶质含量的量度-------溶质质量分数
4、混合物的分离:结晶
教师活动
五、【板书设计】。

九年级化学下册《溶液(复习)》教学设计
九年级化学下册《溶液(复习)》教学设计
溶液(复习)
中考动向分析:
本节教学大纲上要求并不高,只要求对溶液的组成--溶质、溶剂及溶液的定义及饱和和不饱和溶液的区别.现代教育是素质教育,即在于提高人的综合素质,如创造能力,思维能力等.本节中的有关知识都是进行创新的基础,培养具有创新精神、创新能力的人,已成为社会对教育的基本要求.本节是中考必考知识,在中考中常以选择、填空形式出现
复习目标要求
1、弄清溶液的概念、特征及组成和溶质与溶剂的辩证关系
2、饱和溶液、不饱和溶液的概念.
3、饱和溶液与不饱和溶液的相互转化的途径、关系.
知识要点梳理
(一)溶液
1.溶液的概念
(1)悬浊液固体小颗粒悬浮于液体里形成的混合物叫做悬浊液,如含有大量泥沙的洪水,悬浊液静置后,固体小颗粒会成为沉淀。
(2)乳浊液小液滴分散到液体里形成的混合物叫做乳浊液.如植物油注人水中,搅拌后得到的乳状浑浊液体.乳浊液静置后,会分层.如油层在上,水层在下,
液,分别呈现不同的颜色.
②溶液是由溶质和溶剂组成的.溶液的质量等于溶质质量和溶剂质量之和.但溶液体积不等于溶质体积和溶剂体积之和,这是受到分子间的间隔的影响.。

九年级化学《溶液》复习课教学设计单元知识结构一、溶液重点难点剖析 1. 溶液(1)特征:均一性:指溶液内各部分的性质都相同;稳定性:指条件不变时,溶质、溶剂不会分离(2)组成:溶质、溶剂想一想:什么叫溶质、溶剂?怎样判断溶液中谁是溶质、溶剂?溶液一定是无色的吗?2.饱和溶液和不饱和溶液(1)条件:一定温度、一定量溶剂。
饱和溶液和不饱和溶液只有在这两个条件下才有确定的意义。
想一想:改变条件,二者间可怎样转化?改变温度实质上是通过改变物质的溶解度来实现转化的,所以(1)中所说的转化条件适用于溶解度随温度升高怎样变化的物质?(2)饱和溶液是在两个条件下,溶质溶解的最大值。
(3)溶液是否饱和只是对某一溶质而言。
例如:一定温度下、一定量溶剂的食盐饱和溶液,食盐不能继续溶解,但对于其他物质还可以溶解。
议一议:在什么条件下,饱和溶液一定比不饱和溶液要浓?3.溶解度(1)准确理解这个概念,必须抓住以下关键词:“一定温度”──条件;“100 g溶剂”──衡量标准;“饱和状态”──对溶液的要求;“溶解的质量”──溶解度单位是“克”;“这种物质在这种溶剂里的”──严格说明(如不指明溶剂,则溶剂是水)。
举例:20 ℃时食盐的溶解度是36 g。
这里指20 ℃时,100 g水里最多溶解食盐36 g。
(或20 ℃时,100 g水里溶解36 g食盐达到饱和)练一练:30 ℃时硝酸钾的溶解度是45.8 g,它表示什么意义?想一想:根据20 ℃时溶解度的大小,物质可分为哪几类?(2)溶解度曲线:①概念:表示物质的溶解度随温度变化而变化的情况的曲线。
②表示意义:点:曲线上的点:该点所示温度下的溶解度;两曲线交点:两物质在该点所示温度下溶解度相等线:物质在不同温度下的溶解度;固体的溶解度随温度变化的趋势面:曲线下面的各点:表示溶液为不饱和溶液;曲线上面的各点:表示溶液为饱和溶液且有未溶晶体。
③规律:想一想:固体物质的溶解度受温度影响情况是怎样的?气体的溶解度除了与本身因素有关外,还受哪些因素影响?怎样影响?方法指导:气体溶解度和固体溶解度实质是一样的,都是用来衡量物质溶解能力大小的。
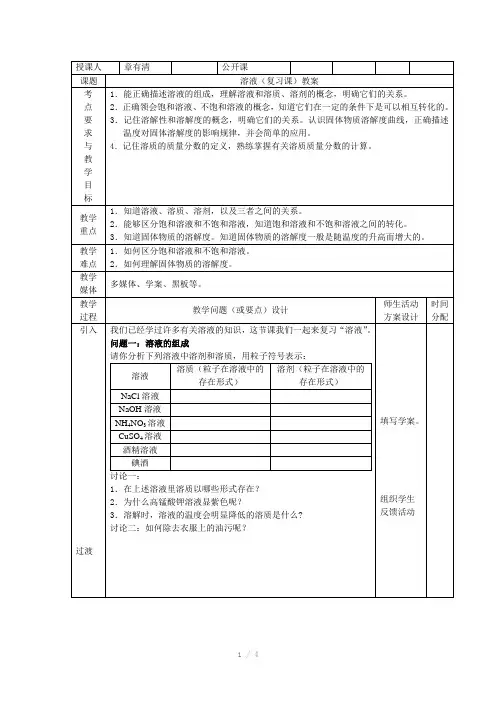
0 t 1t 2温度/℃溶解度/g4020A BCP .Q .X .R .问题三:溶解度的表示方法及意义[思考1]下面的表格中列出了NH 4Cl 在不同温度下的溶解度:温度/℃ 0102030 4050607080溶解度/g29.4 33.3 37.245.8 50.4 55.2 60.2 65.6(1)上表空格处所缺的数据可能是( )A .10.2 B.31.5 C.41.4 D.52.8 (2)在20℃时,向100 g 水中加入50 gNH 4Cl ,形成的 (填“饱和”或“不饱和”)溶液,讨论:用列表法表示溶解度时我们能得到哪些信息呢?[思考2]如右图所示思考下列问题:(1)三种物质的溶解度曲线的变化规律如何?(2)对于a 物质来讲Q 点、X 点和R 点分别代表什么意思? P 点又表示什么意思? (3)对于b 物质,它的曲线下方表示什么意思?上方呢? (4)阴影部分对于A 、B 两物质有何意思?讨论:从溶解度曲线图上能得到哪些信息呢?[问]对于气体物质来讲它的溶解度受什么因素影响呢?[练习]右图是a 、b 、c 、d 四种固体物质的溶解度曲线;下表是这些固体物质在部分温度时的溶解度。
根据图表信息判断下列说法正确的是( ) A .图中a 曲线表示KNO :的溶解度曲线 B .b 的溶解度小于a 的溶解度 C .要从a 与d 的混合物中得到a ,通常采用蒸发溶剂使其结晶的方法 D .60℃时将120gKNO 3放入100g 水中充分溶解后形成的溶液的溶质的质量分数为54.5%[小结]饱和溶液中溶质的质量分数=[S/(S+100)]×100%。
组织学生 讨论组织学生 讨论组织学生 练习并讨 论师生共同 小结本单 元知识点。

一种特殊的混合物——溶液
李少坤
【期刊名称】《科学课:7-9年级》
【年(卷),期】2005(000)08X
【摘要】一、什么是溶液、悬浊液和乳浊液?把泥土放入水中时,泥土沉到水底,振荡后得到浑浊的液体。
这种液体不稳定,静置一会儿后,固体逐渐下沉。
这种固体小颗粒悬浮于液体里形成的混合物叫做悬浊液(或悬浮液)。
【总页数】3页(P21-23)
【作者】李少坤
【作者单位】武汉第一初级中学,430022
【正文语种】中文
【中图分类】G633.8
【相关文献】
1.水华蓝藻生物质与底泥混合物对溶液中Cd的吸附作用 [J], 李溦;邵继海;曾清如;苗霄霖
2.一种特殊溶液可让脑变透明 [J],
3.一种新的NMR法测定溶液中碱土金属混合物的方法原理 [J], 袁汉珍
4.离子浮选在稀溶液金回收中的一种特殊应用 [J], Engel,MD;许鹏秋
5.科技文献中常用混合物和溶液浓度的正确标度 [J], 普及
因版权原因,仅展示原文概要,查看原文内容请购买。

溶液复习(第一课时)
学习目标:
1、掌握溶液的概念、特征、组成;
2、掌握饱和溶液与不饱和溶液的概念,并学会饱和溶液与不饱和溶液之间的相互转化方法;
3、理解溶解度的概念,影响溶解度的因素等;
4、掌握溶解度曲线的变化规律及应用;
5、结晶提纯的方法。
教学重难点:
1、溶解度曲线的规律和应用;
2、结晶提纯的方法。
教学过程:
【问题导入】什么是溶液?我们生活中接触过哪些溶液呢?溶液这个单元,我们要掌握哪些知识呢?学生归纳。
同学都归纳的很好,让我们看看中考是怎么考查溶液这部分知识的。
【分析地位】分析本课知识在近三年中考中的题型、分值和难易水准,让学生心中有数。
【找考点】表现本课知识所涉及的考点,并找出刚才所做题目的对应考点,明确本节课要解决的主要问题。
【过考点】考点1的知识梳理,完成对应的例1和第1题。
考点2的知识梳理,完成对应的例2和第2题。
考点3的知识梳理,并以提问的方式过知识。
【播放视频】归纳总结出溶解度曲线图中的相关信息。
让学生完成例3和第3题,并小结。
【水平提升】做学案上的1-3题,做完学生讲评。
【板书设计】
一、溶液的概念、特征和组成
二、饱和溶液与不饱和溶液
三、溶解度曲线
【布置作业】
必做题:《金牌学案》P14-P16 第4、5、6、7、11、12、19、25题
选做题:《金牌学案》P14-P16 第20、21、22题。