烃类燃烧专题
- 格式:ppt
- 大小:228.00 KB
- 文档页数:16


专题:烃的燃烧规律1.气态烃C x H y (x ≤4)完全燃烧前后气体体积的变化(燃烧前后温度、压强相同)。
C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃x CO 2+y 2H 2O (1)燃烧后温度高于100 ℃时,水为气态:ΔV =V 后-V 前=y 4-1,y =4时,ΔV =0,体积不变,对应有机物CH 4、C 2H 4等。
y >4时,ΔV >0,体积增大。
(2)燃烧后温度低于100 ℃时,水为液态:ΔV =V 前-V 后=1+y 4,体积总是减小。
(3)无论水为气态,还是液态,气态烃燃烧前后气体体积的变化都只与烃分子中的氢原子数有关,而与烃分子中的碳原子数无关。
2.烃完全燃烧时消耗氧气的量的规律。
C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃x CO 2+y 2H 2O (1)相同条件下等物质的量的烃完全燃烧时,⎝ ⎛⎭⎪⎫x +y 4值越大,耗O 2量越大。
(2)质量相同的有机物,其含氢百分率⎝ ⎛⎭⎪⎫或y x 值越大,则耗O 2量越大。
(3)1 mol 有机物每增加一个CH 2,耗O 2量增加1.5 mol 。
(4)1 mol 含相同碳原子数的烃完全燃烧时,烷烃耗O 2量比烯烃要多。
(5)质量相同的烃C x H y ,x y 越大,则生成的CO 2越多;若两种烃的x y 相等,质量相同时,则生成的CO 2和H 2O 均相等。
[练习]________________________________________1.等物质的量的下列有机物,分别在氧气中完全燃烧,耗氧量最多的是( )A .CH 4B .C 2H 6 C .C 4H 8D .C 4H 6O 2答案:C2.某气态烃10 mL 与55 mL 氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气50 mL 、一氧化碳和二氧化碳各20 mL(各气体体积均在同温、同压下测定),该烃的分子式为( )A .C 2H 6B .C 3H 8 C .C 4H 8D .C 4H 10解析:相同条件下气体体积之比等于物质的量之比,根据条件可写出方程式:烃+5.5O 2――→点燃5H 2O +2CO +2CO 2,由质量守恒定律知烃分子式为C 4H 10。

专题1 烃的燃烧规律1、气态烃完全燃烧前后气体体积的变化根据燃烧通式CxHy + (x+4y )O 2 −−→−点燃 xCO 2 + H 2O 推断 (1)燃烧后温度高于100 ℃,即水为气态时:ΔV=V 后 - V 前=4y -1 ①y>4时,ΔV>0,体积增大;②y=4时,ΔV=0,体积不变;③y<4时,ΔV<0,体积减小。
(2)燃烧后温度低于100 ℃,即水为液态时:ΔV=V 前 - V 后=1+4y 气体体积一定减小。
(3)无论水为气态还是液态,燃烧前后气体体积的变化都只与烃分子中的氢原子数有关,而与碳原子数无关。
2、烃的组成与燃烧产物的关系(1)质量相同的烃 CxHy, y x 越大,则生成的CO 2越多;若两种烃中yx 相等,质量相同,则生成的CO 2和H 2O 的量均相等。
(2)碳的质量分数相同的有机物(最简式可以相同,也可以不同),只要总质量一定,以任意比例混合,完全燃烧后产生的CO 2的量总是一个定值。
(3)等质量、碳的质量分数相同的有机物完全燃烧生成二氧化碳的量相同;等质量、氢的质量分数相同的有机物完全燃烧生成水的量相同。
(4)不同的有机物完全燃烧时,生成的CO 2和H 2O 的物质的量之比相同,则它们分子中碳原子和氢原子的物质的量之比相同。
3、耗氧量大小比较(1)等质量的烃(CxHy)完全燃烧,耗氧量与碳的质量分数(或氢的质量分数)有关,碳质量分数越小(或氢质量分数越大)耗氧量越多,即xy 比值越大,耗氧量越多。
(2)等质量的烃,若最简式相同,完全燃烧耗氧量相同,且燃烧产物的量均相同,推广:最简式相同的有机物无论以何种比例混合,只要总质量相同,完全燃烧耗氧量就不变。
(3)等物质的量的烃完全燃烧时,耗氧量取决于x+4y 值的大小,其值越大,耗氧量越多。
(4)等物质的量的不饱和烃和该烃与水加成的产物(如乙烯和乙醇)或该烃与水加成的产物的同分异构体完全燃烧,耗氧量相同。

有关烃燃烧的规律巧解含烃的混合气体计算题一、甲烷、乙烯、乙炔的燃烧对比:由烷、烯、炔的通式,知其W(C)依次增大,故燃烧时分别产生无黑烟、有黑烟、浓烟等现象,W(C)越大黑烟越多。
此性质也可用于典型物质的鉴别。
2.等物质的量的三者完全燃烧时放出热量最多的是乙烯,但火焰温度最高的却是乙炔,氧炔焰的温度可高达3000℃以上。
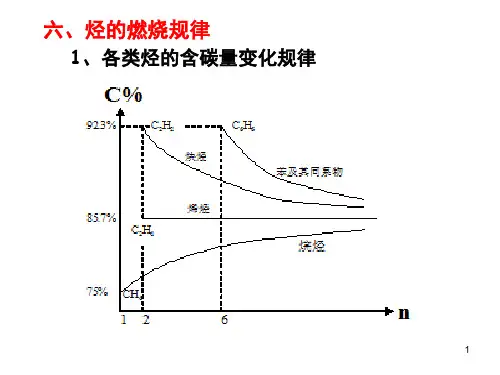
二、烷烯炔各类烃含碳(或氢)质量分数的变化规律:1.烷烃:C n H2n+2(n≥1)W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。
甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):C n H2n(n≥2)W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
3.炔烃(或二烯烃):C n H2n-2(n≥2)W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。
乙炔是炔烃中含碳量最高的。
三、烃的燃烧规律:烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。
烃类燃烧可用通式表示:CxHy + (x+y/4)O2 点燃xCO2 + y/2H2O 1.等物质的量的不同烃燃烧时的耗氧规律:(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4、C2H4、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是…………………………………………………………()A.C2H2含碳量最高,燃烧生成的CO2最多B.C2H2燃烧时火焰最明亮C.CH4含氢量最高,燃烧生成的水最多D.CH4、C2H4燃烧生成的水质量不同,消耗的氧气不同。

专题一 烃的燃烧规律烃:只含C 、H 两种元素的有机物——C x H y烃类(C x H y )完全燃烧的化学方程式:一、烃完全燃烧耗氧量的计算1.等物质的量的烃(C x H y )完全燃烧时, 的值越大,耗氧量越多。
其中 值越大,生成的CO 2越多; 值越大,生成的水越多。
如物质的量均为1 mol 的下列物质燃烧C 2H 6+ O 2――→点燃 CO 2+ H 2OC 3H 6+ O 2――→点燃 CO 2+ H 2OC 3H 8+ O 2――→点燃 CO 2+ H 2O[思考-延伸]1.不同的有机物完全燃烧时,若生成的CO 2和H 2O 的物质的量之比相同,则它们分子中C 原子与H 原子的原子个数比 。
[思考-延伸]2.等物质的量的烃的含氧衍生物(C x H y O z )完全燃烧时, 的值越大,耗氧量越多;其中 值越大,生成的CO 2越多; 值越大,生成的水越多。
【注】烃还是烃的含氧衍生物选用方程式不同【小试牛刀】1.等物质的量的下列烃完全燃烧,消耗氧气最多的是( )A. CH 4B.C 2H 6C. C 3H 6D.C 6H 62.若1mol 某气态烃C x H y 完全燃烧,需用3molO 2,则( )A.x=2,y=2B.x=2,y=4C. x=3,y=6D.x=3,y=8【能力提升】(双选)下列各组有机物,无论两种有机物以何种比例混合,只要总物质的量一定,则在完全燃烧时,消耗的氧气为恒量的是( )A .C 3H 8和C 4H 6 B.C 5H 10和C 5H 12O C. C 5H 10和C 6H 6 D.C 2H 6O 和C 2H 6O 22.等质量的烃(C x H y )完全燃烧时, 的值越大,耗氧量 ,H 元素的质量分数 ,生成的水 ,生成的CO 2 。
[理解]有机物燃烧时有机物中的碳元素生成CO 2,氢元素生成H 2OC~O 2~CO 2 4H~O 2~2H 2On/mol 1 1 1 4 1 2m/g 12 4完全燃烧时,每 g 碳原子消耗1mol 氧气;每 g 氢原子消耗1mol 氧气;即等质量的 元素的质量分数越大的烃,耗氧量越大。

烃类燃烧规律专题练习一、单选题:共25题每题4分共100分1.观察下列①~④组气体有机混合物的分子组成特点:①C2H4和C2H4(H2O);②C2H2(H2O)和C2H2(H2O)2;③CH4和CH4(CO2);④C2H6和C2H6(CO2)(H2O)。
各组分以任意比混合充分燃烧。
下列结论正确的是A.各组混合物总物质的量不变,消耗氧气的质量不变B.各组混合物总质量不变,消耗氧气的质量不变C。
各组混合物总质量不变,生成水的质量不变D。
各组混合物总物质的量不变,生成CO2的质量不变2.某气态烃在一密闭容器中与氧气混合,完全燃烧后容器内的压强与燃烧前容器内的压强相等,燃烧前后的温度均保持在150°C,则该气态烃是A.C2H6B.C3H6C.CH4D。
C4H103.在室温下的某密闭容中,将某气态烷烃与适量氧气混合,点火使之恰好完全燃烧后,冷却到室温,容器中压强为反应前压强的1/2,该气态烃是A.甲烷B。
乙烷 C.丙烷 D.丁烷4.某有机化合物的蒸气完全燃烧时,所需氧气体积为相同状况下该有机化合物的蒸气体积的3倍,产生二氧化碳的体积是自身体积的2倍,该有机化合物可能是①乙烯②乙醇③乙醚④乙烷A。
①② B.②③C。
③④ D.①④5.某有机化合物在氧气中充分燃烧,生成水蒸气和CO2的物质的量之比为1:1由此可以得出的结论是A.该有机化合物分子中C、H、O原子个数比为1:2:3B。
分子中C、H原子个数比为1:2C。
有机化合物中必定含有氧D。
有机化合物中一定不含氧6.现有两种有机化合物,不论以何种比例混合,只要物质的量之和不变,则完全燃烧时消耗氧气和生成的水的物质的量也不变。
则它们可能是C.CH4、A。
C6H6O、C7H8O2 B。
C7H8、C3H8O3D.C3H4、C3H6OC2H4O27.下列各组烃的混合物中,不论两者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是A。

微专题(三)烃类的燃烧规律1.烃类燃烧的耗氧量⑴等物质的量的烃C x H y完全燃烧时,其耗氧量的大小取决于1+4的值,其值越大,耗氧量越多。
⑵等质量的烃C(CHJ完全燃烧,其耗氧量的大小取决于该烃分子中氢的质量分数,X的x H y值越大,则耗氧量越多,生成的CO2越少,生成的H2O越多。
(3)实验式(最简式)相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧生成的CO2和H2O的量均为定值。
2.烃类燃烧前后体积的变化(1)若反应前后的温度保持在100℃以上,则气态烃完全燃烧前后气体的体积变化为C x H y+(x+》O2――燃%CO2+2H2O V1x+4故反应前后气体体积的变化与氢原子数y有关。
当y=4,反应前后体积相等;当y>4,反应后气体体积,反应前气体体积;当y<4,反应后气体体积〈反应前气体体积。
⑵若反应前后的温度低于100℃,此时气体的体积一定是减小的,减少的体积为V=1+4,也与氢原子数有关。
3.根据烃类燃烧产物CO2和H2O之比,推断烃的种类⑴若生成的CO2和H2O之比为1:1,则此有机物的组成为C n H2n,该有机物可能为烯烃或环烷烃。
⑵若生成的CO2和H2O之比小于1:1,则此有机物的组成为C n H2n+,该有机物为烷烃。
4.对混合烃,根据烃类燃烧产物CO2和H2O之比,推断烃的平均分子式如0.1mol混合烃完全燃烧,生成0.12molCO2和0.2molH2O,根据原子守恒就可以确定该混合烃的平均分子式是C1.2H4,从而推断出该混合烃中一定含有甲烷。
1下列说法正确的是()A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为C〃H2nB.一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积C.某气态烃C x H y与足量O2恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则y=4;若体积减少,则y>4;否则y<4D.相同质量的烃完全燃烧,消耗O2越多,则烃中含H量越高答案D解析有机物燃烧只生成CO2和H2O,则该有机物中一定含有碳、氢元素,可能含有氧元素,A项不正确;烃在足量的氧气中燃烧,产生的气体体积也可能比燃烧前的气体体积小,B项不正确;C x H y+(x+4)02――燃:CO2+2H2O体积变化A V如果反应前后气体体积不变,则y =4;若体积减少,则y <4;若体积增加,则y >4,C 项不正确;相同质量的烃完全燃烧,含H 量越高,耗氧量越多,D 项正确。

烃的燃烧规律1.烃完全燃烧前后气体体积的变化完全燃烧时的通式:C x H y +⎝⎛⎭⎫x +y 4O 2――→点燃x CO 2+y 2H 2O (1)燃烧后温度高于100 ℃时,水为气态:ΔV =V 后-V 前=y 4-1(烃为气态) ①y =4时,ΔV =0,体积不变;②y >4时,ΔV >0,体积增大;③y <4时,ΔV <0,体积减小。
(2)燃烧后温度低于100 ℃时,水为液态:ΔV =V 前-V 后=y 4+1(烃为气态),体积总是减小。
无论水为气态,还是液态,燃烧前后气体体积的变化都只与烃分子中的氢原子数有关,而与烃分子中的碳原子数无关。
2.烃完全燃烧时所耗氧气量的规律完全燃烧时的通式:C x H y +⎝⎛⎭⎫x +y 4O 2――→点燃x CO 2+y 2H 2O (1)由烃完全燃烧的通式可知,等物质的量的烃(C x H y )完全燃烧时,耗氧量的大小取决于⎝⎛⎭⎫x +y 4的值,其值越大,耗氧量越大;其值越小,耗氧量越小;若值相同,耗氧量相等。
(2)烃(C x H y )燃烧可看作烃中的C 和H 分别与氧结合。
其关系式为:C + O 2~CO 2 4H + O 2~2H 2O12 g 32 g 4 g 32 g由上面的关系式可知:相同质量的C 和H ,H 的耗氧量大于C 的耗氧量,故质量一定时,烃(C x H y )中氢的质量分数越大,其耗氧量越多,即等质量的烃的耗氧量的多少取决于y x的值的大小,y x 的值越大,耗氧量越多;y x 的值越小,耗氧量越少;y x的值相等,耗氧量相同。
(3)最简式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。
3.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮,黑烟越浓,如C 2H 2、C 6H 6(含碳量均为92.3%)燃烧时火焰明亮,伴随有大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH 4(含碳量为75%)就是如此;对于C 2H 4及其他单烯烃(含碳量均为85.7%),燃烧时火焰较明亮,并有少量黑烟。
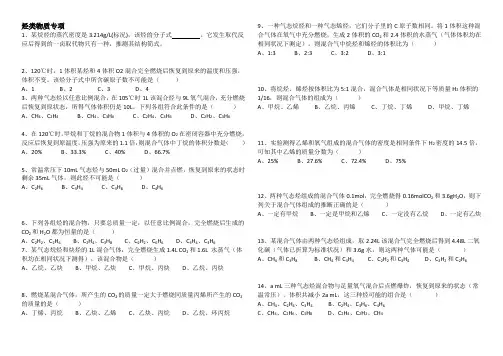
烃类物质专项1、某烷烃的蒸汽密度是3.214g/L(标况),该烃的分子式。
它发生取代反应后得到的一卤取代物只有一种,推测其结构简式。
2、120℃时,1体积某烃和4体积O2混合完全燃烧后恢复到原来的温度和压强,体积不变。
该烃分子式中所含碳原子数不可能是()A、1B、2C、3D、43、两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。
下列各组符合此条件的是()A、CH4、C2H4B、CH4、C3H6C、C2H4、C3H6D、C2H2、C3H64、在120℃时,甲烷和丁烷的混合物1体积与4体积的O2在密闭容器中充分燃烧,反应后恢复到原温度,压强为原来的1.1倍,则混合气体中丁烷的体积分数是()A、20% B、33.3% C、40% D、66.7%5、常温常压下10mL气态烃与50mL O2(过量)混合并点燃,恢复到原来的状态时剩余35mL气体,则此烃不可能是()A、C2H6B、C3H4C、C3H8D、C4H66、下列各组烃的混合物,只要总质量一定,以任意比例混合,完全燃烧后生成的CO2和H2O都为恒量的是()A、C2H2、C2H6B、C2H4、C3H8C、C2H2、C6H6D、C3H4、C3H67、某气态烷烃和炔烃的1L混合气体,完全燃烧生成1.4L CO2和1.6L 水蒸气(体积均在相同状况下测得),该混合物是()A、乙烷、乙炔B、甲烷、乙炔C、甲烷、丙炔D、乙烷、丙炔8、燃烧某混合气体,所产生的CO2的质量一定大于燃烧同质量丙烯所产生的CO2的质量的是()A、丁烯、丙烷B、乙炔、乙烯C、乙炔、丙烷D、乙烷、环丙烷9、一种气态烷烃和一种气态烯烃,它们分子里的C原子数相同。
将1体积这种混合气体在氧气中充分燃烧,生成2体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气中烷烃和烯烃的体积比为()A、1:3B、2:3C、3:2D、3:110、将烷烃、烯烃按体积比为5:1混合,混合气体是相同状况下等质量H2体积的1/16,则混合气体的组成为()A、甲烷、乙烯B、乙烷、丙烯C、丁烷、丁烯D、甲烷、丁烯11、实验测得乙烯和氧气组成的混合气体的密度是相同条件下H2密度的14.5倍,可知其中乙烯的质量分数为()A、25%B、27.6%C、72.4%D、75%12、两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,则下列关于混合气体组成的推断正确的是()A、一定有甲烷B、一定是甲烷和乙烯C、一定没有乙烷D、一定有乙炔13、某混合气体由两种气态烃组成,取2.24L该混合气完全燃烧后得到4.48L二氧化碳(气体已折算为标准状况)和3.6g水,则这两种气体可能是()A、CH4和C3H8 B、CH4和C3H4C、C2H2和C3H4 D、C2H2和C2H614、a mL三种气态烃混合物与足量氧气混合后点燃爆炸,恢复到原来的状态(常温常压),体积共减小2a mL,这三种烃可能的组合是()A、CH4、C2H4、C3H4B、C2H4、C3H6、C4H6C、CH4、C2H6、C3H8D、C2H4、C2H2、CH415、相同条件下,乙炔和乙烯的混合气体完全燃烧需要O2的体积是混合气体体积的2.8倍,则混合气体与H2发生加成反应时,需要H2的体积是混合气体体积的()A、1.2倍B、1.4倍C、1.6倍D、1.8倍16、两种气态烃以一定比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体的体积为11L,下列各组混合烃中不符合此条件的是()A、C3H6、C4H10B、C3H8、C4H8C、C2H4、C4H10D、CH4、C3H817、某混合气体由烷烃、烯烃、炔烃中的两种气体组成,将1.0 L混合气体在O2中完全燃烧生成3.0 L CO2和3.7L水蒸气(气体体积在相同条件下测定),判断混合气的成分并求两类烃的体积比。

烃的燃烧规律总结烃的燃烧是很简单的,但它的计算现象丰富多彩,从而成为考查学生综合应用能力的一个不可多得的知识点。
一、烃的燃烧化学方程式不论是烷烃、烯烃、炔烃还是苯及苯的同系物,它们组成均可用C x H y来表示,这样当它在氧气或空气中完全燃烧时,其方程式可表示如下:二、烃燃烧时物质的量的变化烃完全燃烧前后,各物质的总物质的量变化值与上述燃烧方程式中的化学计量数变化值一致,即。
也就是说,燃烧前后物质的量变化值仅与烃分子中的氢原子数有关,而与碳原子数无关。
且:当y>4时,,即物质的量增加;当y= 4时,,即物质的量不变;当y<4时,,即物质的量减少。
三、气态烃燃烧的体积变化要考虑燃烧时的体积变化,必须确定烃以及所生成的水的聚集状态。
因此,当气态烃在通常压强下燃烧时,就有了两种不同温度状况下的体积变化:1. 在时,。
说明,任何烃在以下燃烧时,其体积都是减小的;2. 在时,。
当y>4时,,即体积增大;当y=4时,,即体积不变;当y<4时,,即体积减小。
四、烃燃烧时耗氧量(nO2)、生成二氧化碳量(nCO2)、生成水量(nH2O)的比较在比较各类烃燃烧时消耗或生成的量时,常采用两种量的单位来分别进行比较:1. 物质的量相同的烃C x H y,燃烧时也就是说:(1)相同条件下等物质的量的烃完全燃烧时,(x+y/4)值越大,消耗O2越多;x值越大,生成的CO2越多;y值越大,生成的水越多。
(2)1mol有机物每增加一个CH2,消耗O2量增加为:(1+2/4)=1.5molCH2. 质量相同的烃C x H y转换成,燃烧时yx也就是说:(1)质量相同的含氢质量分数(y/x)大的烃,燃烧时耗氧量大,生成水量大,生成二氧化碳量小。
(2)最简式相同的烃,不论以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
五、混合烃燃烧时的加和性尽管烃的混合物燃烧时,具有单一烃各自的燃烧特征,但它们具有加和性。
《烃》烃的燃烧反应在我们的日常生活和工业生产中,烃类物质的燃烧是一种常见且重要的化学反应。
烃,这个听起来有些专业的名词,其实与我们的生活息息相关。
无论是驱动汽车的汽油,还是为家庭供暖的天然气,其主要成分都属于烃。
首先,让我们来了解一下什么是烃。
烃是仅由碳和氢两种元素组成的有机化合物。
根据其结构的不同,烃可以分为烷烃、烯烃、炔烃等。
烷烃是饱和烃,其分子中的碳原子之间都是单键相连;烯烃含有碳碳双键;炔烃则含有碳碳三键。
这些不同类型的烃在物理性质和化学性质上都有所差异。
那么烃的燃烧反应是怎样发生的呢?简单来说,烃的燃烧是烃与氧气发生的剧烈氧化反应。
在这个过程中,烃分子中的碳和氢分别与氧结合,生成二氧化碳和水,并释放出大量的能量。
以甲烷(CH₄)为例,它是最简单的烃之一。
甲烷燃烧的化学方程式为:CH₄+ 2O₂ → CO₂+ 2H₂O 。
在这个反应中,一个甲烷分子与两个氧气分子反应,生成一个二氧化碳分子和两个水分子。
同时,释放出大量的热能,这就是我们利用天然气做饭、取暖的原理。
再来看乙烷(C₂H₆)的燃烧。
乙烷燃烧的化学方程式为:2C₂H₆+ 7O₂ → 4CO₂+ 6H₂O 。
从这个方程式可以看出,随着烃分子中碳原子数量的增加,燃烧所需的氧气量也相应增加,生成的二氧化碳和水的量也会增多。
对于含有双键或三键的不饱和烃,其燃烧反应与饱和烃类似,但反应的速率和条件可能会有所不同。
例如乙烯(C₂H₄)的燃烧方程式为:C₂H₄+ 3O₂ → 2CO₂+ 2H₂O 。
烃燃烧反应的能量释放是巨大的。
这一特性使得烃类物质成为重要的能源来源。
然而,烃燃烧也带来了一些问题。
一方面,不完全燃烧可能会产生一氧化碳等有害气体,对环境和人体健康造成危害。
另一方面,大量燃烧烃类物质会导致二氧化碳等温室气体的排放,加剧全球气候变化。
为了减少烃燃烧带来的负面影响,我们采取了一系列措施。
在能源利用方面,不断提高燃烧效率,使烃类物质能够更充分地燃烧,减少有害气体的产生。
烃的燃烧规律及应用烃是一类由碳和氢元素组成的有机化合物,常见的烃包括烷烃、烯烃和炔烃。
烃具有较高的能量含量和燃烧性能,因此广泛应用于能源、化工和燃料等领域。
下面将从燃烧规律和应用两个方面来详细介绍烃的特点和用途。
燃烧规律:烃的燃烧是指烃与氧气发生氧化反应,产生二氧化碳和水。
燃烧的化学方程式如下:CnHm + (n+m/4)O2 →nCO2 + m/2H2O根据这个方程式,可以得出烃的燃烧规律:1. 反应物:烃燃烧的反应物主要是烃和氧气。
烃是能够提供燃料的有机物,而氧气是燃烧所需的氧化剂。
当烃和氧气充分接触时,燃烧反应会自发进行。
2. 产物:烃的燃烧主要产生二氧化碳和水。
二氧化碳是一种常见的废气,在空气中存在会造成温室效应。
水是燃烧过程中产生的水蒸气。
产物的生成主要取决于烃和氧气的化学反应。
3. 反应条件:烃的燃烧需要一定的温度和氧气浓度来提供充分的反应条件。
当温度较高、氧气浓度足够时,燃烧反应速率较快,燃烧产热较多。
应用:烃的燃烧具有高能量含量和方便燃烧等特点,因此被广泛用于以下领域:1. 能源:烃是重要的化石燃料,如石油和天然气主要由烃组成。
燃烧烃类化合物可以产生大量的热能,用于发电、供暖和工业生产等,是主要的能源来源之一。
2. 燃料:烃可用作汽车、飞机和船舶等交通工具的燃料。
烷烃类化合物如汽油、柴油和天然气都可以作为燃料使用,为交通工具提供动力。
3. 化工:烃可作为化学工业的原料和中间体。
通过烃类化合物可以合成各种有机化学品,如塑料、纤维、润滑油和溶剂等。
烃也可以用于制备合成氨、甲醇和乙醇等重要化学品。
4. 生活用品:烃也被用于生活用品的制备。
例如,烷烃类化合物可以提炼成石蜡,用于制作蜡烛、抛光剂和防水剂等。
而烷烃类烃燃烧产生的火焰可以用于灶具、热水器等家庭用具。
总结起来,烃的燃烧规律和应用主要体现在烃与氧气发生氧化反应,产生二氧化碳和水。
烃的高能量含量和方便燃烧性质使其在能源、化工和燃料等领域有着广泛的应用。
烃类的燃烧与环境污染防治措施烃类是一类广泛存在于自然界和人类活动中的有机化合物,其在工业生产、能源利用和日常生活中广泛应用。
然而,烃类的燃烧过程常常伴随着环境污染问题。
本文将对烃类的燃烧特点及环境污染防治措施进行探讨。
一、烃类的燃烧特点烃类燃烧是指烃类与氧气发生反应,产生二氧化碳和水等物质,释放出热能的过程。
烃类的燃烧有以下几个特点:1. 高燃烧热:烃类的燃烧热值较高,能够释放大量热能,广泛用于能源生产和供暖等领域。
2. 完全燃烧产物:烃类完全燃烧时,主要产生二氧化碳和水,不产生毒性气体和有害物质。
3. 不完全燃烧:若燃烧不充分,烃类会生成一氧化碳、氮氧化物等有害物质,并排放到大气中,对环境和人体健康造成危害。
二、烃类燃烧产生的环境污染问题1. 大气污染:燃烧排放的一氧化碳、氮氧化物和挥发性有机物等物质,会导致空气质量恶化,形成雾霾天气,影响人体呼吸健康。
2. 温室气体排放:烃类的燃烧产生大量二氧化碳,是温室效应的主要原因之一,加剧气候变化问题。
3. 水体污染:从工业生产和船只机动等活动中释放的未燃尽的烃类、石油等污染物,进入水体中,损害水生生物和水质。
4. 土壤污染:烃类的不完全燃烧会在地表积累有害物质,对土壤产生污染,降低土壤质量,影响农作物生长。
三、烃类燃烧环境污染防治措施为了减少烃类燃烧过程中的环境污染问题,采取以下措施是必要且有效的:1. 推广清洁燃烧技术:使用高效燃烧器、催化剂等设备,提高燃烧效率,减少不完全燃烧产物的生成。
2. 控制燃烧过程温度:通过调节燃烧温度,减少氮氧化物的生成,降低大气污染。
3. 强化排放控制:建立严格的燃烧排放标准,监测和控制工业企业、机动车辆等烟气排放,限制有害物质的释放。
4. 发展清洁能源替代:大力发展清洁能源,如风能、太阳能等,减少对化石燃料的依赖,降低温室气体排放量。
5. 加强环境监测和治理:建立完善的燃烧污染监测系统,及时发现和处理燃烧排放问题,确保环境质量符合标准。