Western blot详解及问题分析
- 格式:ppt
- 大小:2.72 MB
- 文档页数:42

WesternBlot常见问题及处理总结免疫细胞研究western blotWestern Blot常见问题及处理总结阿木1、western blot得优点答: 灵敏,可达ng级,用Ecl显色法理论上可达pg 级、方便,特异性高。
2、为什么我得细胞提取液中没有目标蛋白?答: 原因有很多: a)您得细胞中不表达这种蛋白质,换一种细胞;b) 您得细胞中得蛋白质被降解掉了,您必需加入PMSF,抑制蛋白酶活性;c)您得抗体不能识别目标蛋白,多瞧瞧说明,瞧就是否有问题。
3、我得细胞提取液有得有沉淀,有得很清亮,为什么呢?答: a)有沉淀可能因为您得蛋白没有变性完全,可以适当提高SDS 浓度,同时将样品煮沸时间延长, b) 也不排除您得抗原浓度过高,这时再加入适量上样缓冲液即可。
4、我做得蛋白质分子量很小(10KD),请问怎么做WB?答:可以选择0。
2μml得膜,同时缩短转移时间。
也可以将两张膜叠在一起,再转移、其她按步骤即可。
5、我得目得带很弱,怎么加强?答:可以加大抗原上样量、这就是最主要得、同时也可以将一抗稀释比例降低。
6、胶片背景很脏,有什么解决方法? 答:减少抗原上样量,降低一抗浓度,改变一抗孵育时间,提高牛奶浓度、7、目标带就是空白,周围有背景,就是为什么?答:您得一抗浓度较高,二抗上HRP 催化活力太强,同时您得显色底物处于一个临界点,反应时间不长,将周围底物催化完,形成了空白即“反亮现象”。
将一抗与二抗浓度降低,或更换新底物。
8、我得胶片就是一片空白,就是怎么回事?答:如果能够排除下面得几个问题那么问题多半出现在一抗与抗原制备上。
a)二抗得HRP 活性太强,将底物消耗光;b)ECM底物中H2O2,不稳定,失活;c) ECL底物没覆盖到相应位置;d) 二抗失活。
9、我在显影液中显影1分钟与5分钟后,底片漆黑一片,就是什么原因呢?答:a)可能就是红灯造成得, 胶片本来就被曝光了,可以在完全黑暗得情况下操作.瞧就是否有改善、;b) 显影时间过长。

WesternBlot详解(原理、分类、试剂、步骤及问题解答)Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
本文主要通过以下几个方面来详细地介绍一下Western Blot技术:一、原理二、分类i.放射自显影ii.底物化学发光ECLECFiv.底物DAB呈色三、主要试剂四、主要步骤五、实验常见的问题指南1.参考书推荐2.针对样品的常见问题3.抗体4.滤纸、胶和膜的问题5.Marker的相关疑问6.染色的选择7.参照的疑问8.缓冲液配方的常见问题9.条件的摸索10.方法的介绍11.结果分析一、原理与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
二、分类现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP 标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
三、主要试剂1、丙烯酰胺和N,N’-亚甲双丙烯酰胺,应以温热(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O至100ml。





Western Blot详解Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
该文主要通过以下几个方面来详细地介绍一下W e stern Blot技术。
Conten ts:(1)原理(2)分类i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光EC Fiv. 底物DAB呈色(3)主要试剂(4)主要程序(5)实验常见的问题指南1. 参考书推荐2. 针对样品的常见问题3. 抗体4. 滤纸、胶和膜的问题5. Marker的相关疑问6. 染色的选择7. 参照的疑问8. 缓冲液配方的常见问题9. 条件的摸索10. 方法的介绍11. 结果分析(1)原理与South ern或N o rthe rn杂交方法类似,但Weste rn Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
(2)分类wester n显色的方法主要有以下几种:i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光EC Fiv. 底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
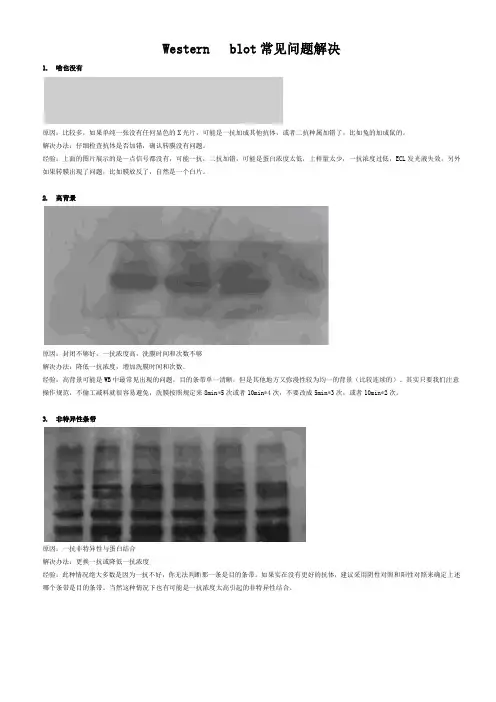
Western blot常见问题解决1. 啥也没有原因:比较多,如果单纯一张没有任何显色的X光片,可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
解决办法:仔细检查抗体是否加错,确认转膜没有问题。
经验:上面的图片展示的是一点信号都没有,可能一抗,二抗加错,可能是蛋白浓度太低,上样量太少,一抗浓度过低,ECL发光液失效。
另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
2. 高背景原因:封闭不够好,一抗浓度高,洗膜时间和次数不够解决办法:降低一抗浓度,增加洗膜时间和次数。
经验:高背景可能是WB中最常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景(比较连续的)。
其实只要我们注意操作规范,不偷工减料就很容易避免,洗膜按照规定来8min*5次或者10min*4次,不要改成5min*3次,或者10min*2次。
3. 非特异性条带原因:一抗非特异性与蛋白结合解决办法:更换一抗或降低一抗浓度经验:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。
如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。
当然这种情况下也有可能是一抗浓度太高引起的非特异性结合。
4. 条带中出现边缘规则的白圈原因:电转中膜和胶之间存在气泡。
解决办法:转膜前去掉膜和胶之间的气泡经验:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。
然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。
注意不要来回赶气泡,这样反而会带入气泡。

Western Blot(蛋白质印迹)技术是生物医学研究中常用的蛋白质分析技术之一,可以用于检测蛋白质样品中的特定抗原。
然而,在进行Western Blot实验时,可能会遇到一些问题,下面列举了一些常见问题及解决方法:1.电泳条带不清晰或无条带:解决方法:•检查样品质量,确保待检测样品是可用的,无降解或污染。
•调整电泳参数,如电压、电流和时间等,以优化电泳效果。
•更换抗体,确认抗体的特异性,避免非特异性结合。
2.膜上背景过重:解决方法:•在抗体孵育之前,使用封闭剂封闭膜上的非特异性位点,减少抗体非特异性结合。
•减少一抗和二抗的浓度,减轻非特异性结合。
•增加洗涤次数和时间,以清除未结合的抗体和蛋白质。
3.目的蛋白信号弱或无:解决方法:•调整一抗和二抗的浓度,提高特异性结合的信号强度。
•选择更灵敏的显色方法,如化学发光法等。
•在转膜前,优化样品处理,如提取、纯化和浓缩等步骤。
4.非特异性条带:解决方法:•检查抗体特异性,确认抗体的特异性,更换抗体以减少非特异性结合。
•检查样品处理步骤,避免样品中的杂蛋白干扰。
•增加洗涤次数和时间,以清除未结合的抗体和非特异性结合的蛋白质。
5.显影后膜上条带处变为黄色或白色:解决方法:•可能是由于曝光时间过长或显影液浓度过高导致的,可以降低曝光时间和减少显影液浓度来解决问题。
•在膜清洗时使用甲醇或乙醇等有机溶剂,清除膜上的多余抗体和显色剂。
6.条带内无显影的白点:解决方法:•在转膜前检查是否存在气泡,气泡会影响转膜效果和条带形成。
•增加转膜时间和电流,以促进蛋白质的转移。
•检查显影液是否过期或存在质量问题。
7.存在散在小圆斑:解决方法:•这可能是由于封闭液中的杂质颗粒导致的,可以通过过滤封闭液来清除杂质。
•检查一抗和二抗是否含有杂质抗体或存在抗体污染的情况,更换抗体可以解决问题。
•检查显色液是否存在问题,如过期或存在杂质等,更换显色液可以解决问题。
8.条带变形或不均匀:解决方法:•检查电泳胶的质量和制备过程是否存在问题。
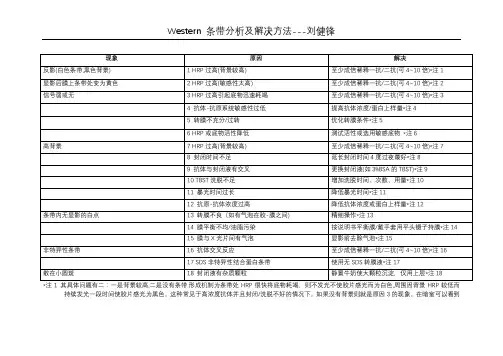
*注1 其具体问题有二:一是背景较高,二是没有条带.形成机制为条带处HRP很快将底物耗竭,则不发光不使胶片感光而为白色,周围因背景HRP较低而持续发光一段时间使胶片感光为黑色。
这种常见于高浓度抗体并且封闭/洗脱不好的情况下。
如果没有背景则就是原因3的现象。
在暗室可以看到条带周围荧光而条带处为暗。
如是则要么通过降低抗体解决,要么动作迅速早期未耗竭底物时压片,否则一旦耗竭通过减少压片时间不能解决问题。
也可以过一段时间鼿RP稍减后重加底物迅速压片。
还有另外一种反影现象就是压出条带粗大模糊,但条带中心是空的白色,原因和上面的一样,主要是条带中心耗竭底物引起的,也可以在暗室看到中空的荧光带,但与上面的区别主要在于特异性要好一些,若继续发展则就是原因3的现象。
其分析和解决同上。
*注2 其原因主要是HRP太高超速催化底物生成的产物使膜发黄,压出的片子可以是正常的或和原因1或原因3的现象同时存在,只是一种现象,在压过的膜可以看出来(只在加底物后一段时间出现,几小时后可能还会消退,有时甚至刚加底物1~2min就可以看出来,所以要把握时机)。
如果没有达到原因1和原因3的程度,那么这种情况一定能够看到很强的荧光,是一种良好的状态,是我们所期盼的。
如果压出正常片子而不出现原因1和原因3的现象,可以不予处理。
但因为荧光太强极易导致条带增粗变大,所以也可以不稀释抗体而通过调整压片时间来解决,一般压10s~30s,甚至可以3~5s,即时根据结果在暗室调整,荧光持续时间长的话都可连续压十数张片子而效果良好。
但也有这种情况,就是由于HRP过强无论怎么减少压片时间条带都依然粗大(如果时间过短如<3s则可因感光不足导致条带太淡,这样就不可取了,但依然是粗大的、非条带的本来面目),那么如果想获得漂亮条带则必须通过降低抗体浓度(减少上样量很不稳定且能力有限,故很少使用)来解决。
原因1和3若如是则解决也是一样的。
*注3 这是与1类似但抗体特异性较好时的一种表现,经常与下面的原因4、5、6混淆,特别需要注意。

关于western blot原理和常见故障分析关于western blot原理:通过电泳区分不同的组分,并转移至固相支持物,通过特异性试剂(抗体作为探针,对靶物质进行检测,蛋白质的Western印迹技术结合了凝胶电泳的高分辨率和固相免疫测定的特异敏感等多种特点,可检测到低至1~5ng(最低可到10-100pg中等大小的靶蛋白。
一、抗原的选择和制备A:样品的制备1组织:组织的处理方法:组织洗涤后加入3倍体积预冷的PBS,0℃研磨,加入5×STOP buffer,180W,6mins,0℃超声波破碎,5000rpm,5mins离心,取上清。
加入β-ME(9.5ml加入0.5ml,溴酚蓝(9.5ml加入0.5ml煮沸10min,分装后于-20℃保存,用时取出,直接溶解上样。
2细胞:细胞的处理方法:离心收集细胞或者直接往细胞培养瓶内加入5×STOP buffer,收集,180W,6mins,0℃超声波破碎,5000rpm,5mins离心,取上清。
加入β-ME(9.5ml 加入0.5ml,溴酚蓝(9.5ml加入0.5ml煮沸10min,分装后于-20℃保存,用时取出,直接溶解上样。
3分泌蛋白的提取(特例:直接收集分泌液,加入β-ME、溴酚蓝制样。
B:蛋白的定量方法及影响蛋白定量原因1.双缩脲法:双缩脲法是第一个用比色法测定蛋白质浓度的方法。
在需要快速,但不很准确的测定中,常用此法。
硫铵不干扰显色,这对蛋白质提纯的早期阶段是非常有利的。
双缩脲法的原理是Cu2+与蛋白质的肽键,以及酪氨酸残基络合,形成紫蓝色络合物,此物在540nm波长处有最大吸收。
双缩脲法常用于0.5g/L~10g/L含量的蛋白质溶液测定。
干扰物有硫醇,以及具有肽性质缓冲液,如Tris、Good缓冲液等。
可用沉淀法除去干扰物,即用等体积10%冷的三氯醋酸沉淀蛋白质,然后弃去上清液,再用已知体积的1m NaOH溶解沉淀的蛋白质进行定量测定。
*注1 其具体问题有二:一是背景较高,二是没有条带.形成机制为条带处HRP很快将底物耗竭,则不发光不使胶片感光而为白色,周围因背景HRP较低而持续发光一段时间使胶片感光为黑色。
这种常见于高浓度抗体并且封闭/洗脱不好的情况下。
如果没有背景则就是原因3的现象。
在暗室可以看到条带周围荧光而条带处为暗。
如是则要么通过降低抗体解决,要么动作迅速早期未耗竭底物时压片,否则一旦耗竭通过减少压片时间不能解决问题。
也可以过一段时间鼿RP稍减后重加底物迅速压片。
还有另外一种反影现象就是压出条带粗大模糊,但条带中心是空的白色,原因和上面的一样,主要是条带中心耗竭底物引起的,也可以在暗室看到中空的荧光带,但与上面的区别主要在于特异性要好一些,若继续发展则就是原因3的现象。
其分析和解决同上。
*注2 其原因主要是HRP太高超速催化底物生成的产物使膜发黄,压出的片子可以是正常的或和原因1或原因3的现象同时存在,只是一种现象,在压过的膜可以看出来(只在加底物后一段时间出现,几小时后可能还会消退,有时甚至刚加底物1~2min就可以看出来,所以要把握时机)。
如果没有达到原因1和原因3的程度,那么这种情况一定能够看到很强的荧光,是一种良好的状态,是我们所期盼的。
如果压出正常片子而不出现原因1和原因3的现象,可以不予处理。
但因为荧光太强极易导致条带增粗变大,所以也可以不稀释抗体而通过调整压片时间来解决,一般压10s~30s,甚至可以3~5s,即时根据结果在暗室调整,荧光持续时间长的话都可连续压十数张片子而效果良好。
但也有这种情况,就是由于HRP过强无论怎么减少压片时间条带都依然粗大(如果时间过短如<3s则可因感光不足导致条带太淡,这样就不可取了,但依然是粗大的、非条带的本来面目),那么如果想获得漂亮条带则必须通过降低抗体浓度(减少上样量很不稳定且能力有限,故很少使用)来解决。
原因1和3若如是则解决也是一样的。
*注3 这是与1类似但抗体特异性较好时的一种表现,经常与下面的原因4、5、6混淆,特别需要注意。
Western Blot 结果条带全面分析Q1. 啥也没有[原因]:比较多,如果单纯一张没有任何显色的X光片,最可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
[解决办法]:仔细检查抗体是否加错,确认转膜没有问题。
[经验]:上面的图片展示的是一点信号都没有,如果是这样大部分情况是抗体加错了。
如果中间出现了细微的条带,可能原因是蛋白上样量太少,一抗浓度过低,ECL发光液失效。
另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
Q2. 高背景[原因]:封闭不够好,一抗浓度高,洗膜时间和次数不够[解决办法]:降低一抗浓度,增加洗膜时间和次数。
[经验]:高背景可能是WB中最常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景(比较连续的)。
其实只要我们注意操作规范,不偷工减料就很容易避免,洗膜按照规定来5min*5次或者10min*3次,不要改成5min*3次,或者10min*2次。
Q3. 非特异性条带[原因]:一抗非特异性与蛋白结合[解决办法]:更换一抗[经验]:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。
如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。
当然这种情况下有一种很小几率的可能是一抗浓度太高引起的非特异性结合。
Q4. 条带中出现边缘规则的白圈[原因]:电转中膜和胶之间存在气泡。
[解决办法]:转膜前去掉膜和胶之间的气泡[经验]:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧中间,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。