右移 增大 增大 减小 增大 右移 增大 减小 增大 增大
黄色变浅 黄色变浅
右移 增大 增大 减小 减小 左移 增大 增大 减小 减小 右移 减小 减小 增大 增大 左移 增大 增大 减小 减小
黄色加深 黄色加深 红褐色沉淀 黄色加深
右移 减小 减小 增大
增大
有红褐色沉淀 及气体产生
左移 减小 减小 增大 减小 黄色变浅
常见双水解情况:
Al3+ 与HCO3-、CO32-、HS-、S2- 、 〔Al(OH)4〕-
Fe3+ 与HCO3-、CO32- 、〔Al(OH)4〕NH4+与 SiO32-
试写出上述双水解反应的离子方程式。
练习
1、为了使Na2S溶液中的C(Na+)和C(S2-)比值变小,
可加入的物质是( CD)
2、配制和储存易水解的盐溶液时,需考虑抑 制盐的水解。
如,配制FeCl3溶液? 将FeCl3粉末溶于水,加入稀盐酸抑制Fe3+的水解 配制CuSO4溶液? 将CuSO4溶于水,加入稀硫酸抑制Cu2+的水解
3、比较盐溶液酸碱性的强弱
(1)pH NaA大于 NaB
< 酸性 HA HB
(2)pH MgCl2大于AlCl3,
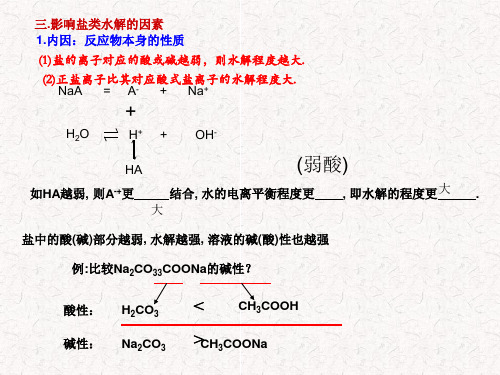
三.影响盐类水解的因素 1.内因:反应物本身的性质
(1)盐的离子对应的酸或碱越弱,则水解程度越大.
(2)正盐离子比其对应酸式盐离子的水解程度大. NaA = A- + Na+
+
H2O
H+ + OH-
HA
(弱酸)
如HA越弱, 则A-+更
结合, 水的电离平衡程度更
大
, 即水解的程度更大 .