第3讲配合物的立体结构
- 格式:ppt
- 大小:1.03 MB
- 文档页数:44

1第三讲 配合物赛点回顾与展望配合物化学一般是指金属原子或金属离子同其他分子或离子发生配位反应的化学,现代配位化学研究领域远远突破了无机化学范围,它涉及金属有机化学、催化机理、物质结构、生命科学和材料科学等,正在成为一门充满活力的边缘学科,应用极为广泛,如核原料和核反应堆材料的生产,超导材料,纳米材料,表面加工工艺,稀土金属的提取与分离,半导体,激光材料的分离与提纯,新药制备与提纯,海水淡化,稀土农业,沙尘暴的防治,沙漠的开发利用等等,国内、国际化学竞赛题涉及的内容也较广泛,但都立足于基础概念与基本原理,如组成、结构、稳定性、综合平衡、反应规律、异构现象、运用原理解释日常生活、社会热点问题,今后测试走向既有连续性,又有新意,新意不外乎原理的重组,综合性、智能性要求更高而已,万变不离其宗,扎实基础,灵活运用,就能永立潮头。
一、配合物(一)基本概念1、配合物2、配合物组成(1)中心体,是配合物的核心成分,该核心叫中心体或形成体。
(2)配合体,向中心体提供电子对的原子、分子或离子的微粒。
常见的配位体分类(3)配位数:向中心体提供电子形成配位键的数目。
3、配合物的分类24、配合物的命名:含阴离子的配合物,先内界后外界;含阳离子的配合物,先外界后内界。
内蜀命名:配体数目(汉字表达)→配体名称→合→中心体名称(用罗马字母标出化合价),如:Na 3AlF 6:六氟合铝酸钠(中心体无变价可不标),俗名冰晶石。
K 4[Fe(CN)6]:六氰合铁(Ⅱ)酸钾,俗名亚铁氰化钾,又名黄血盐K 3[Fe(CN)6]:六氯合铁(Ⅲ)酸钾,俗名铁氰化钾,又名赤血盐H 2SiF 6:六氟合硅酸,俗名氟硅酸(二)配合物结构33、几何异构几何异构是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反应式两种异构体。
如:PtCl 2(NH 3)2有两种几何异构体:另外 ,八面体构型有其他多种类型的几何异构体,如[PtBr 3(NH 3)3]+有下图:两种几何异构体。


高三化学配位化合物的配位数与立体构型化学配位化合物是由中心金属离子和周围配体离子或分子组成的。
在配位化合物中,中心金属离子能够与不同数目的配体形成不同配位数的配合物,并且配位数的不同还可以导致配合物的立体构型发生变化。
本文将探讨高三化学中配位化合物的配位数与立体构型的关系。
一、配位数的定义和影响因素配位数指的是中心金属离子所配位的配体数目。
常见的配位数包括2、4、6以及8等。
而影响配位数的主要因素有以下几个方面。
1. 配体的种类和性质:不同的配体具有不同的配位能力,一些配体能够给予中心金属离子更多的电子密度,使得中心金属离子更容易接受更多的配位。
2. 配体的空间构型:一些配体本身的空间构型限制了其与中心金属离子的配位方式,从而影响了配位数的大小。
3. 中心金属离子的电子排布:中心金属离子的电子排布也会影响其对配位数的选择,一些电子排布不利于接受多个配位。
二、配位数与立体构型的关系配位数的不同将导致配位化合物的立体构型发生变化。
根据配位数的不同,配合物的立体构型分为以下几类。
1. 配位数为2的立体构型:配位数为2的立体构型形式上类似于线性结构,中心金属离子和配体排列在一条直线上。
常见的例子是[Ni(CO)4],其中镍离子与4个一氧化碳分子形成配位键。
2. 配位数为4的立体构型:配位数为4的立体构型形式上类似于四面体结构或平面方形结构。
四面体结构中,中心金属离子和4个配体形成四面体的形状,常见的例子是[TiCl4]。
平面方形结构中,中心金属离子和4个配体形成平面方形的形状,常见的例子是[Ni(CN)4]2-。
3. 配位数为6的立体构型:配位数为6的立体构型常见的是八面体结构或正八面体结构。
八面体结构中,中心金属离子和6个配体构成八面体的形状,常见的例子是[Co(NH3)6]3+。
正八面体结构中,中心金属离子和6个配体构成正八面体的形状,常见的例子是[Cr(H2O)6]3+。
4. 配位数为8的立体构型:配位数为8的立体构型常见的是双四面体结构或正二十面体结构。

配位化学与配合物的立体构型配位化学是化学领域中的一个重要分支,研究金属离子和配体之间的相互作用。
配合物是由一个中心金属离子和周围配位基团构成的化合物。
在配位化学中,配位基团的排列方式对配合物的物理和化学性质起着关键的影响。
配位化学与配合物的立体构型密切相关,本文将探讨配位化学与配合物的立体构型的研究内容和意义。
一、立体构型的定义及分类在配位化学中,立体构型指的是配合物中利用空间排列方式描述配体和金属离子之间的关系。
立体构型可以通过分子结构的确定、光谱学以及理论计算等方法进行研究和解析。
配合物的立体构型分类主要有以下几种:1. 线性构型:配位基团沿直线排列。
这种构型通常出现在两个配位基团与金属离子之间的配位数为2时,如[Ag(NH3)2]+。
2. 方阵构型:配位基团沿正方形排列。
这种构型通常出现在四个配位基团与金属离子之间的配位数为4时,如[Ni(CN)4]2-。
3. 正八面体构型:配位基团沿正八面体排列。
这种构型通常出现在六个配位基团与金属离子之间的配位数为6时,如[Co(NH3)6]3+。
4. 正四面体构型:配位基团沿正四面体排列。
这种构型通常出现在四个配位基团与金属离子之间的配位数为4时,如[PtCl4]2-。
5. 正十二面体构型:配位基团沿正十二面体排列。
这种构型通常出现在八个配位基团与金属离子之间的配位数为8时,如[UO2(C2O4)4]4-。
二、配位化学与配合物的立体构型研究方法在配位化学中,研究配合物的立体构型的方法主要包括实验方法和理论计算方法。
1. 实验方法:实验方法是通过使用各种各样的实验手段来确定配合物的立体构型。
其中最常见的方法包括X射线晶体衍射、核磁共振、红外光谱等。
通过这些实验手段,可以确定配合物的原子间距离、键角等参数,从而推断立体构型。
2. 理论计算方法:理论计算方法是通过数学建模和计算机模拟来推测和预测配合物的立体构型。
其中最常用的方法包括量子化学计算和分子力场计算。

7、配位数为81)四方反棱柱。
如[TaF8]3-、[Sr(H2O)8]2+2)三角十二面体。
如[Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
2.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:偶极矩的大小与配合物中原子排列的对称性有关,因此通过偶极矩的测量可鉴定几何异构体。
例:Pt(II)配合物的偶极矩(Debye):顺式反式[Pt(PPr n3)2Cl2] 11.5 0[Pt(PEt3)2Cl2] 10.7 0Pr n= CH3CH2CH2- ; Et =CH3CH2-2) X射线衍射法该方法可确定原子在空间的确切位置(三维坐标),因此可用来鉴定几何异构体。
例:trans-[Cu(py)2Cl2] (平面正方形)。
第三节旋光异构现象(optical isomerism)1、旋光异构及其与对称性的关系1)旋光异构体:相互成为镜象而不能重合的一对分子称为旋光异构体(又称对映异构体)。
例:具有四个不同取代基的四面体碳原子:CHClBrI。
2)分子具有旋光异构体的对称性判据可以证明:分子具有旋光异构体的充分必要条件是该分子不具备任意次的旋转反映轴(非真轴)S n。
S n的定义:先转动2π/n,然后再通过垂直于转动轴的平面进行反映。
例:CCl4(S4),交叉构型的二茂铁(S10)。
特例:S1=σ(对称面)S2=i (对称中心)因此具有对称面或对称中心的分子不存在旋光异构体。
2、旋光异构体实例* 平面正方形配合物不存在旋光异构体。
1)[Rh(en)2Cl2]+除存在顺、反几何异构体外,其顺式几何异构体还可分出两种旋光异构体:3)[Co(NO2)2(C2O4)(NH3)2]-的三个几何异构体中,有一个具有旋光异构体。
例:[Co(C2O4)(en)2]2(C2O4).8H2O2)化学拆分法该方法将对映体首先转化为非对映体,然后再利用非对映体溶解度或其它物理性质的不同来进行分离。




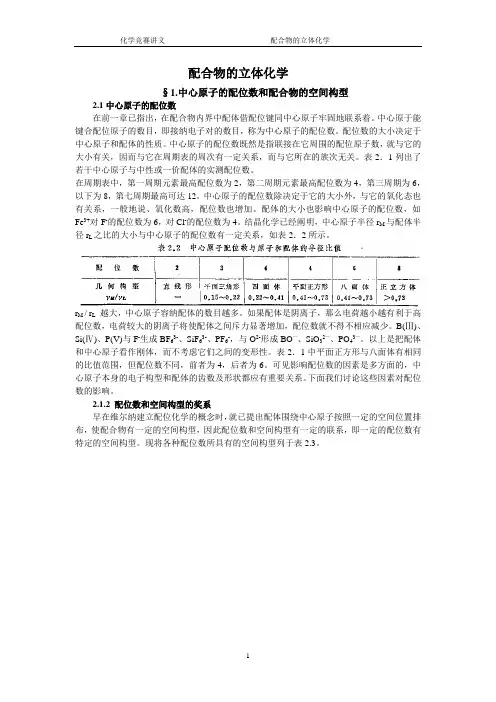
配合物的立体化学§1.中心原子的配位数和配合物的空间构型2.1中心原子的配位数在前一章已指出,在配合物内界中配体借配位键同中心原子牢固地联系着。
中心原于能键合配位原子的数目,即接纳电子对的数目,称为中心原子的配位数。
配位数的大小决定于中心原子和配体的性质。
中心原子的配位数既然是指联接在它周围的配位原子数,就与它的大小有关,因而与它在周期表的周次有一定关系,而与它所在的族次无关。
表2.1列出了若干中心原子与中性或一价配体的实测配位数。
在周期表中,第一周期元素最高配位数为2,第二周期元素最高配位数为4,第三周期为6,以下为8,第七周期最高可达12。
中心原子的配位数除决定于它的大小外,与它的氧化态也有关系,一般地说、氧化数高,配位数也增加。
配体的大小也影响中心原子的配位数,如Fe3+对F-的配位数为6,对Cl-的配位数为4。
结晶化学已经阐明,中心原子半径r M与配体半径r L之比的大小与中心原子的配位数有一定关系,如表2.2所示。
r M / r L越大,中心原子容纳配体的数目越多。
如果配体是阴离子,那么电荷越小越有利于高配位数,电荷较大的阴离子将使配体之间斥力显著增加,配位数就不得不相应减少。
B(Ⅲ)、Si(Ⅳ)、P(V)与F-生成BF63-、SiF63-、PF6-,与O2-形成BO—、SiO32—、PO43—。
以上是把配体和中心原子看作刚体,而不考虑它们之间的变形性。
表2.1中平面正方形与八面体有相同的比值范围,但配位数不同,前者为4,后者为6。
可见影响配位数的因素是多方面的,中心原子本身的电子构型和配体的齿数及形状都应有重要关系。
下面我们讨论这些因素对配位数的影响。
2.1.2 配位数和空间构型的奖系早在维尔纳建立配位化学的概念时,就已提出配体围绕中心原子按照一定的空间位置排布,使配合物有一定的空间构型,因此配位数和空间构型有一定的联系,即一定的配位数有特定的空间构型。
现将各种配位数所具有的空间构型列于表2.3。

配位化合物的立体结构配位化合物是一类重要的化合物,在许多领域都有广泛的应用。
了解其立体结构对于化学家来说至关重要。
本文将探讨配位化合物的立体结构及其影响因素。
一、配位化合物及其定义配位化合物是指一个中心原子或离子周围通过化学键连接的一组原子或离子的总称。
其中中心原子或离子通常为过渡金属离子,周围的原子或离子被称为配体。
配位化合物在生物学、药学、材料科学等领域都有着重要的应用。
二、配位化合物的立体结构主要由以下因素决定:1. 配位数配位化合物的配位数指中心离子与配体之间的化学键数目。
不同的配位数会对分子的立体结构产生影响。
例如,对于六配位的金属离子(如六配位的铜离子),它的配体通常会排列成一个八面体的形状,其中六个配体位于八面体的六个顶点上,另外两个配体位于八面体的两个反对面上。
2. 配体不同的配体对于分子的立体结构也有着重要的影响。
如溴化物和氨分别是双原子配体和单原子配体,它们与中心金属离子之间的作用力不同,通常会对配位化合物的几何形状产生不同的影响。
3. 配位键长度和强度配位键长度和强度也影响着分子的立体结构。
一般认为,配位键长度越短,配位键强度越大,分子几何形状就越稳定。
而长键则会导致分子结构的不稳定,容易发生反应。
4. 配位键的取向配位键的取向也是影响分子立体结构的关键因素。
这与配体的配位方式、空间构型和分子电荷分布等有关。
三、配位化合物的应用配位化合物是一类十分重要的化合物,具有广泛的应用。
例如:1. 用于催化反应。
配位化合物中的金属离子可以作为催化剂,促进化学反应的进行。
2. 用于药物研究。
许多药物都是金属离子与配体组成的配位化合物,了解其立体结构对药物的设计及功能研究具有十分重要的意义。
3. 用于材料科学。
一些配位化合物具有复杂的晶体结构,可以作为功能材料的设计及合成的重要模板和前体物。
四、结论本文对配位化合物的立体结构进行了探讨,其立体结构受配位数、配体、配位键长度和强度以及配位键的取向等多种因素影响。
化学配位化合物的立体构型化学配位化合物是由中心金属离子与一或多个配位体形成的化合物。
在配位化学中,研究和了解配位化合物的立体构型对于理解其性质和反应机制至关重要。
本文将介绍配位化合物的立体构型以及相关的分子几何形状。
一、线性型构型线性型构型是指配位体以直线方式与中心金属离子配位形成的构型。
例如,一价阳离子氯离子(Cl-)可以以线性方式配位到两个一价阳离子银离子(Ag+)上,形成Ag-Cl-Ag的线性链状结构。
此外,双原子分子中的配位体,如一氧化碳(CO)和氰化物(CN-),也可形成线性型构型。
二、四面体型构型四面体型构型是指四个配位体环绕着中心金属离子呈四面体形状排列而成的构型。
在这种构型中,配位体通常位于四面体的四个顶点位置。
例如,四个一价阴离子氯离子(Cl-)可以与一个四价阳离子钛离子(Ti4+)形成四面体型构型,其中氯离子位于四面体的四个顶点。
三、正方形平面型构型正方形平面型构型是指四个配位体环绕着中心金属离子呈正方形平面形状排列而成的构型。
在这种构型中,配位体位于正方形平面的四个角位置。
例如,四个一价阴离子氰化物离子(CN-)可以与一个二价阳离子镍离子(Ni2+)形成正方形平面型构型,其中氰化物离子位于正方形平面的四个角。
四、八面体型构型八面体型构型是指八个配位体环绕着中心金属离子呈八面体形状排列而成的构型。
在这种构型中,配位体通常位于八面体的八个顶点位置。
例如,八个二价阴离子氟离子(F-)可以与一个二价阳离子镍离子(Ni2+)形成八面体型构型,其中氟离子位于八面体的八个顶点。
五、扭曲型构型扭曲型构型是指配位体与中心金属离子配位形成的构型具有非常规形状的情况。
在某些情况下,配位体之间的相互作用会导致立体构型偏离理想的几何形状。
例如,五个一价阴离子溴离子(Br-)和一个一价阳离子铜离子(Cu+)形成的配位化合物呈扭曲型构型。
结论化学配位化合物的立体构型对其性质和反应机制有着重要影响。
不同的立体构型决定了配位化合物的形状以及与其他分子的相互作用方式。