配合物的结构
- 格式:ppt
- 大小:3.04 MB
- 文档页数:38







人类对配合物结构的认识配合物是指由中心金属离子和配体通过化学键相结合,形成的稳定存在的化合物。
它是无机化学中的一个非常重要的分支,因为配合物在很多领域都有广泛的应用,如生物医药、材料科学、环境治理等。
为了更好地利用和开发这些应用,人类对配合物的结构进行了深入的研究。
本文将从不同的角度探讨人类对配合物结构的认识,包括配位数、配体种类、键的类型等方面。
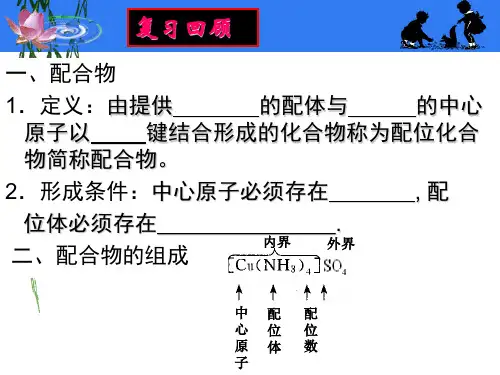
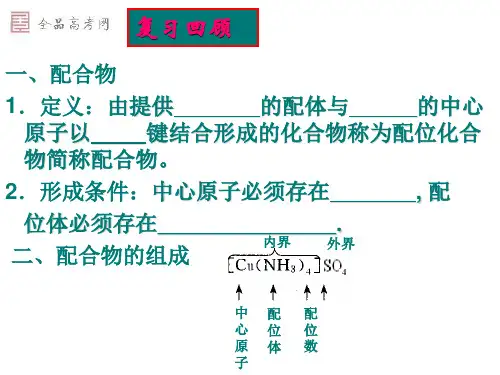
配位数所谓配位数,就是中心金属离子周围配位面(不一定是平面)上配体原子或离子的数目。
据此,配位数可以分为一、二、三、四、五、六等。
一般来说,较小的离子和较大的配体可以形成较高的配位数,反之会形成较低的配位数。
以六配位配合物为例,它的八面体形结构可以通过配体排列方式的不同而得到五种不同的立体异构体,如下图所示。
F——--—M———--F/ \\ / \\/ \\ / \\F——--—M———--F——\\ / \\ /\\ / \\ /F——--—M———--F这些不同的立体异构体于1966年被命名为极谷体(octahedral)和哈利切克体(hexahedral)等,它们的名称与其配位数、配体向中心离子的方向和其他几何形状有关。
配体种类配体种类也是人类研究配合物结构的重要方面之一。
有机配体和无机配体是两类较基本的配体种类,其中前者包括了常见的乙二胺(en)、异构化二胺(ien)等,而后者则包括了水、氨、一些卤素离子和有机酸根等。
此外,还有大量新型配体的发现和研究,如氮杂环烯、磷杂环烯和金属有机配体等,这些新型配体在探索新的配合物结构及其应用上也起到了积极的作用。
键的类型配位化合物中键的类型主要有离子键、配位键和共价键。
其中离子键主要存在于阴离子配体和阳离子金属离子之间,它们通过静电作用相互吸引形成一般的离子晶体。
配位键则是配体原子与中心金属离子之间的键,它可以是配体中的单个原子中的孤对电子或共振的非键电子与中心金属离子之间的成键。
不同配位键的一般距离不同。

配合物知识点总结一、配合物的定义配合物是由金属离子和配体通过共价键结合而成的化合物。
金属离子在配合物中通常为正离子,配体是通过给电子对金属离子形成配位键。
配合物可以根据配体数目的不同,分为配位数配合物和低配位数配合物。
配合物具有特定的结构和性质,可以发挥重要的应用价值。
二、配合物的结构1. 配合物的中心离子配合物的中心离子通常是金属离子,其常见的价态有+1、+2、+3等。
金属离子的价态决定了配合物的性质和反应活性。
在配合物中,金属离子通常是八面体、四面体等形状的配位几何构型,取决于其配位数和电子排布。
2. 配位键配位键是配体与金属中心之间形成的化学键,通常由配体的一个或多个孤对电子与金属中心的空的d轨道形成。
配位键的强度和稳定性决定了配合物的性质和应用。
3. 配位数配位数是指一个金属离子中与配体形成共价键的个数。
配合物的配位数决定了其化学性质和反应活性。
配位数的不同可以导致配合物的结构和形态的差异,从而影响其性质和应用。
4. 配位几何构型配合物的配位几何构型是指配位体围绕金属中心排布的结构。
常见的配位几何构型有八面体、四面体、三角双锥等形状,配位几何构型决定了配合物的形态和稳定性。
三、配合物的性质1. 配合物的稳定性配合物的稳定性是指其在不同条件下的稳定程度。
配合物的稳定性受金属离子的化合价、配体的性质、配位数和配位方式等因素的影响。
稳定的配合物通常具有良好的溶解度和化学稳定性。
2. 配合物的光谱性质配合物在紫外可见光谱和红外光谱中表现出特定的吸收和发射特性,这些光谱性质可以用来确定配合物的结构和配位方式,从而揭示其化学性质和反应机理。
3. 配合物的磁性由于金属离子的d轨道电子结构的特殊性,配合物具有特定的磁性特性。
配合物可以表现出顺磁性、反磁性和铁磁性等磁性行为,这些性质对于配合物的结构和性质具有重要意义。
4. 配合物的溶解度配合物的溶解度受金属离子的价态、配体的性质和溶剂性质的影响。
溶解度的不同可以影响配合物的稳定性和应用。

高中化学配合物配合物是指由中心金属离子和周围的配体离子共同形成的一个整体结构。
配合物广泛存在于日常生活和化学实验中,具有重要的应用价值。
在高中化学课程中,我们经常会接触到配合物的概念,了解其结构、性质和应用。
一、配合物的结构1. 配合物的组成:配合物通常由一个中心金属离子和若干个配体离子组成。
中心金属离子通常是过渡金属元素,具有较多的空位和不完满的d轨道。
配体离子则是能够给出一个或多个孤对电子的分子或离子,与中心金属离子形成配位键。
2. 配位键的形成:配位键是指中心金属离子与配体离子之间的化学键。
常见的配位键包括配位共价键、配位离子键和配位金属键。
配位键的形成使得配合物呈现特定的几何构型,如八面体、四方形、三角形等。
二、配合物的性质1. 颜色:配合物的颜色常常取决于其中的中心金属离子和配体离子的种类和结构。
不同的配合物由于电子跃迁的不同而呈现出不同的颜色。
这也是我们常常用来区分不同配合物的一种方法。
2. 稳定性:配合物的稳定性取决于配体的性质、中心金属离子的能力和配位数等因素。
稳定的配合物通常具有较低的配位能和较大的配位数,能够稳定保持其结构不发生变化。
3. 溶解性:部分配合物具有较好的溶解性,可以在水或有机溶剂中形成溶液。
溶解性的大小与配合物的结构和性质有关,不同的配合物在不同溶剂中呈现出不同的溶解性。
三、配合物的应用1. 工业应用:配合物在工业中具有广泛的应用,如催化剂、染料、氧化还原剂等。
通过合理设计配合物的结构和性质,可以实现对目标反应的催化和调控,提高反应的效率和产率。
2. 医药应用:部分配合物具有生物活性,可以作为药物的主体或辅助成分。
配合物药物可以改善药物的稳定性、生物利用度和靶向性,提高药物治疗的效果和减少副作用。
3. 环境应用:某些配合物可以被应用于环境保护领域,如重金属离子的吸附和去除。
通过设计合适的配合物结构,可以实现对有害物质的高效捕获和转化,减少环境污染和资源浪费。
综上所述,配合物作为化学领域中的重要概念,具有广泛的应用前景和研究价值。