第十一章 配合物结构
- 格式:doc
- 大小:44.50 KB
- 文档页数:3


配位化学讲义第十一章无机小分子配合物第十一章无机小分子配体配合物小分子配体的过渡金属配合物,已成为配位化学中发展最快的领域之一。
现已证实,小分子通过与过渡金属离子的配位而活化,进而可引起许多重要的反应。
第一节金属羰基(CO)配合物一、概述金属羰基配合物是过渡金属元素与CO所形成的一类配合物。
1890年,Mond和Langer发现Ni(CO)4,这是第一个金属羰基配合物。
常温、常压Ni(粉) + CO Ni(CO)4 (无色液体,m .p.= -25℃)150℃Ni(CO)4Ni + 4CO这成为一种提纯Ni的工艺。
现已知道,所有过渡金属至少能生成一种羰基配合物,其中金属原子处于低价(包括零价)状态。
二、类型1、单核羰基配合物这类化合物都是疏水液体或易挥发的固体,能不同程度地溶于非极性溶剂。
M-C-O键是直线型的。
例:V(CO)6 黑色结晶,真空升华V-C, 2.008(3) ÅCr(CO)6Cr-C, 1.94(4) ÅMo(CO)6无色晶体,真空升华,Mo-C, 2.06(2)Å 八面体W(CO)6W-C, 2.06(4)ÅFe(CO)5黄色液体,m.p.=20℃,Fe-C,1.810(3)Å(轴向)三角b.p.=103℃ 1.833(2)Å(赤道)双锥Ni(CO)4无色液体,m.p.= -25℃,Ni-C,1.84(4)Å四面体2、双核和多核金属羰基配合物多核羰基配合物可以是均核的,如:Fe3(CO)12;也可以是异核的,如MnRe(CO)10。
M在这类化合物中,不仅有M-C-O 基团, 而且还有O —C 和M-M 键,且M μ2-CO 常与M-M 键同时存在。
即: O —C 例:(1)Mn 2(CO)10为黄色固体,m.p.151℃,Mn-Mn=2.93Å OC CO OC COOC M M CO M=Mn 、Tc 、ReOC CO OC CO(2) Fe 2(CO)9 金色固体,m.p.100℃(分解),难挥发 OC CO COOC Fe Fe CO Fe 2(CO)9OC CO OC CO(3)Fe 3(CO)12 绿黑色固体,m.p.140-150℃(分解)OCCOFeO COCC OOC Fe C C Fe OCOCO CO CO COFe 3(CO)12(4)M 3(CO)12 M=Ru 、OsOCCOO COCC OOCC C OCOCO CO CO CO MMM*金属原子体积越大,越易形成非桥式结构。

有环状结构,被称为螯合物或内配合物。
2+同一配体的两个或两个以上的配位原子间有一个原子,这样才能形成比较配位化合物金属有机配合物SO4科学家鲍林CN -为强配体,使Co 3个d 电子重排中心采取d 2sp 3 杂化,配离子Co(CN)为正八面体构型。
3d4s4p d 2sp 3杂化过渡金属Ni 的d轨道与CO的π*能量相近,对称性一致,可以成键。
按重叠后的(C2H4) ]·H2Oσ配键d-pπ配键在八面体场中,六个配体沿x,y,z轴的个方向分布,以形成八面体场。
正八面体场中配体与d z2 轨道的相对位置,轨道的波瓣与六个配体正相对,d x 2-y 2d z 2球形场正八面体场中配体与d xy 轨道的相对位置,,轨道的波瓣不与配体相对,能量升高的少,低于球形场。
d xy d xz d yz 球形场坐标原点为正六面体的中心,三轴分别沿与三边平行的方向伸展。
4 个配体的位置如图所示,形成四面体场。
正四面体场中配体与d x 2-y 2 轨道的相对位置正四面体场中配体与d xy 轨道的相对位置d d d 球形场(d )球形场(d )坐标原点位于正方形中心,坐标轴沿正方形对角线方向伸展。
4个配位原子位于正方形的顶点,形成正方形电场。
yx-++--y 2d x 2-y 2轨道的波瓣与配体一一相对,受电场作用最大,能量最高。
d xy 轨道处于y 平面内,受电场作用较大,能量居第二位。
++--d xy yx轨道的环形波瓣在x O y 平面内,列第三位。
d z 2yx能量最低的是轨道和轨道d xz d yz ++--z d yzyz++--d xzxz2.影响分裂能大小的因素弱场强场 小大-----光谱化学序列弱场强场 小大X -,OH -等弱场配体△小,常有△< P ,取高自旋光谱化学序列中NO 2-,CN -,CO 等强场配体△大,常导致△> P ,取低自旋方式,强场低自旋。
高自旋排布(dε)4 (dγ)2 低自旋排布(dε)6 (dγ)05个d轨道的能量为零点。





第十一章配合物结构
(11-1)
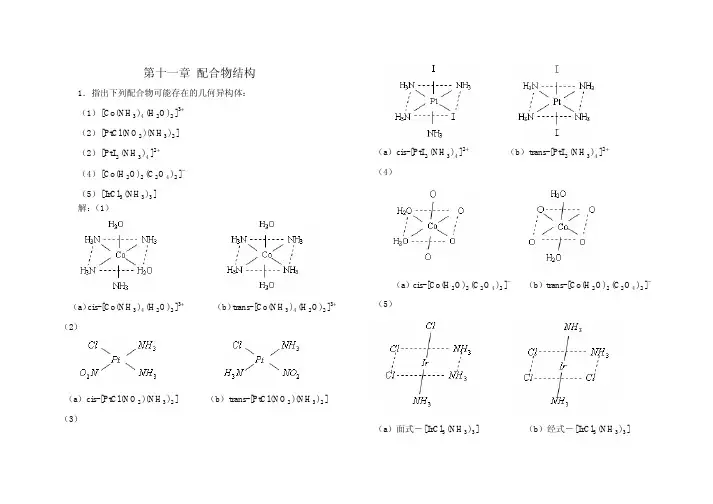
如果配合物具有平面四方形和八面体空间构性,这类配合无可能存在几何异构体。
(1)[Co(NH3)4(H2O)2]3+具有八面体空间构性,其顺、反几何异构体为:
(3),(4)与(1)类似,请自行完成。
(2)[PtCl(NO2)(NH3)2]为平面四方形构型,其顺、反几何异构体为:
(5)[IrCl3(NH3)3]为八面体构型,属[MX3A3]型配合物,其顺、反几何异构体分别称为面式和经式异构体:
(11-3)
磁矩是研究配合物结构的重要实验数据之一。
决定配合物磁矩的最最重要因素是中心离子或原子的未成对电子数,由试验测得磁矩后,可以推测出未成对电子数,进而确定形成体的价层电子排布、杂化轨道类型及配合物的空间构型。
[Co(H2O)6]2+的μ=4.3B.M,Co2+为3d7电子构型,推知Co2+的未成对电子数n=3,其价层电子排布为:
配合无为正八面体的空间构型。
[Mn(CN)6]4-:μ=1.8B.M,Mn2+为3d5电子构型,n=1。
其价层电子分布为:
配合物的空间构型为八面体。
自行回答[Ni(NH3)6]2+的相关问题。
*如果已经确定配合物个体的空间构型,可推知形成体的杂化轨道类型,再确定其价层电子排布和未成对电子数,从而可估算出该配合物磁矩。
(11-2)题就属这种情况,请自行完成本体的解答。
同样,也可完成(11-5)题。
(11-4)
本题的解体思路与(11-3)相同。
这里,主要是对三种常见的螯合剂en,C2O42-,EDTA 的配位原子种类和数目要进一步熟悉;同时对内轨型和外轨型配合物的概念要很了解。
[Co(en)3]2+:μ=3.82B.M,Co2+为3d7, n=3,每个en有两个配位原子N。
Co2+
的价层电子分布为:
Co2+采用sp3d2杂化轨道成键,为外轨型配合物(即成键轨道为ns,np,nd),是正八面体空间构型。
[Fe(C2O4)33-]的5.75B.M,Fe3+为,n=5,其价层电子分布为:
1C2O42-个有2个配位O,Fe3+以sp3d2杂化轨道成键,是外轨型八面体配合物。
[Co(EDTA)]-的,n=0,Co3+的价层电子分布为:
每个EDTA中有2个N和4个O为配位原子,Co3+以d2sp3杂化轨道与EDTA成键,该螯合物空间构型为八面体,是内轨型配合物(其成键轨道为(n-1)d,ns,np)。
(11-6)
内轨型、外轨型的概念是配合物价键理论中的概念;高自旋和低自旋的概念属于晶体长理论的范畴。
如果某八面体配合物按价键理论是内轨型的,则按晶体场理论往往是低自旋型的,即形成体的未成对电子数n尽可能的小。
同样,外轨型与高自旋型是相对应的,形成体的未成对电子数在形成配合物前后不改变。
(1)Ru2+的价层电子构型为4d6,按晶体场理论,[Ru(NH3)6]2+为低自旋状态,则其
电子排布式为t2g6e g0,n=0,估计磁矩=0。
(2)Fe3+的价层电子构型为3d5,[Fe(CN)6]3-为低自旋,其电子排布式为t2g6e g0,n=1,μ≈1.73B.M.。
(3)Ni2+的价层电子构型为3d8,d8电子构型的离子只能形成高自旋配合物,因此
[Ni(H2O)6]2+的电子排布式为t2g6e g0,n=2,μ≈2.83B.M.。
(4)V3+的价层电子构型为3d2,中心离子d2构型的配合物其电子排布式只能是
t2g6e g0;n=2,μ≈2.83B.M.。
(5)Co2+的价层电子构型为3d7,[CoCl4]2-为四面体空间构型的配合物,其电子排
布表示为e4t23,n=3,μ≈3.87B.M.。
*按照晶体场理论,配合物中心离子的电子排布与配合物个体的空间构型有关。
(11-8)
根据晶体场理论确定八面体空间构型的配合物的中心离子M n+的d电子排布式的基本思路是:
由的价层电子构型,确定d电子数:若P>Δ0,高自旋;若P<Δ0,低自旋。
[Co(NH3)6]2+,Co2+为3d7,P>Δ0,高自旋,t2g5e g2,n=3,μ≈3.87B.M.。
[Fe(H2O)6]2+,Fe2+为3d6, P>Δ0, 高自旋,t2g4e g2, μ≈4.90B.M.。
[Co(NH3)6]3+,Co3+为3d6, P<Δ0,低自旋,t2g6e g0,μ≈0。
(11-9)
计算配合物的晶体场稳定化能,应先确定中心离子的d电子排布。
[Co(NH3)6]2+:t2g5e g2,n1=5,n2=2,m1=m2=2
CFSE=(-4n1+6n2)Dq+(m1-m2)P
=(-4×5+6×2)D q =-8Dq=-0.8Δ0=-8800cm-1
[Fe(H2O)6]2+:t2g4e g2,n1=4,n2=2,m1=m2=1
CFSE=(-4×4+6×2)Dq =-4Dq=-0.4Δ0=-4160cm-1
[Co(NH3)6]3+:t2g6e g0,n1=6,n2=0,m1=3,m2=1
CFSE=(-4×6+6×0)Dq+(3-1)P =-24Dq+2P=-2.4Δ0+2P=-12960cm-1
*综合应用价键理论和晶体场理论来完成(11-10)题的解答。
(11-11)
本题是(11-8),(11-9)的总和;同时要考虑强场配体与低自旋配合物,弱场配体与高自旋配合物的对应关系,因此,要熟悉光谱化学序。
在光谱化学序中,排在前面的示弱场配体,如H2O,F....排在后面的为强场配体,如CO,CN-等。