《无机化学》第十一章 配合物结构之课后习题参考答案
- 格式:doc
- 大小:241.00 KB
- 文档页数:2

第11章卤素11.l 电解制氟时,为何不用KF 的水溶液?液态氟化氢为什么不导电,而氟化钾的无水氟化氢溶液却能导电?解:由于氟的高还原电位(E F 2/F -=2 . 87V) ,氟遇水时会同水发生反应。
因此,制备单质F 2不能用KF 的水溶液。
电解制氟的反应方程式是:2KHF 2 === 2KF↑+H 2 + F 2↑液态氟化氢不导电,但氟化钾的无水氟化氢溶液能导电,是因为液态氟化氢可同无水氟化钾作用形成KHF 2,该物质可发生强的电离作用,产生正负离子,从而导电。
KHFK + + HF 2-本质上,无水氟化氢是溶剂,氟化钾是溶解于氟化氢的溶质,该体系是非水HF 溶剂(也是类水溶剂)的电解质溶液。
11.2 氟在本族元素中有哪些特殊性?氟化氢和氢氟酸有哪些特性?解:同同族其它元素相比,氟元素的特殊性主要有:( l )除单质外,氟的氧化态呈-l 价,不呈正氧化态(其它卤素有多种氧化态);氟有特别强的氧化性;( 2)氟的电子亲合能比氯小(从氯到碘又逐渐减小)。
( 3 ) F 2 的键能因孤对电子的影响而小于Cl 2 。
( 4 )同其它的HX 在室温时是双原子气体相比,氟化氢是一种由氢键引起的聚合多原子气体(HF )x 。
与同族其它元素的氢化物相比,由于氟化氢分子间存在强的氢键,其熔点、沸点、汽化热和热力学稳定性都特别高。
HF 的高介电常数、低黏度和宽的液态范围,使它是各种类型化合物的一种极好溶剂。
许多M I 、M II 和M III 的离子性化合物在HF 中溶解后由于易离解而得到高效导电的溶液( XeF 2, HSO 3F , SF 6 及MF 6 ( M :Mo 、W 、U 、Re 、Os )在HF 中可溶解但不离解)( 5 )氟化氢的水溶液即氢氟酸。
同其它氢卤酸是强酸相比,氢氟酸的酸性较弱:HF + H 3O ++ F - K 1 2.4~4.7×10-4HF + F 2- K 2 =5~25 与其它弱酸相似,HF 浓度越稀,其电离常数越大。


第十一章后习题解答1. 区别下列名词:(1) 内层与外层(2) 单齿配体与多齿配体(3) d2sp3杂化和sp3d2杂化(4) 内轨配合物和外轨配合物(5) 强场配体和弱场配体(6) 低自旋配合物和高自旋配合物解(1)配合物的内层是由中心原子提供杂化轨道,配体中配位原子提供孤对电子,通过配位键形成的配离子。
与配离子带相反电荷的离子称为配合物的外层。
(2)只含有一个配位原子的配体称为单齿配体,如NH3,H2O,OH-,F -等。
含有两个或两个以上配位原子的配体称为多齿配体,如:乙二胺,EDTA等。
(3)以2个(n-1)d轨道、1个n s轨道和3个n p轨道杂化形成6个杂化轨道,称为d2sp3杂化。
以1个n s轨道、3个n p轨道和2个n d轨道杂化形成6个杂化轨道,称为sp3d2杂化。
(4)中心原子全部用最外层轨道杂化所形成的配合物称为外轨配合物;用次外层(n-1)d轨道和最外层n s,n p轨道杂化所形成的配合物称为内轨配合物。
(5)依据配体使中心原子d轨道能级的分裂程度不同,配体有强场、弱场之分。
使d轨道能级分裂能力强的配体称为强场配体,如CN-,CO;使d轨道能级分裂能力弱的配体称为弱场配体,如H2O、F -、Cl-、Br-、I-。
(6)中心原子电子组态为d4~d7的配合物中,单电子数多的称为高自旋配合物,单电子数少的称为低自旋配合物。
强场配体形成低自旋配合物,弱场配体形成高自旋配合物。
2. 命名下列配离子和配合物,指出中心原子、配体、配位原子和配位数,写出K s的表达式(1) Na3[Ag(S2O3)2] (2) [Co(en)3]2(SO4)3(3) H[Al(OH)4] (4) Na2[SiF6](5) [PtCl5(NH3)]-(6) [Pt(NH3)4(NO2)Cl](7) [CoCl2(NH3)3H2O]Cl (8) NH4[Cr(NCS)4(NH3)2]解名称中心原子配体配位原子配位数K s表达式(1) 二(硫代硫酸根)合银(I)酸钠Ag+S2O32-S2O32-中的S2 32322223[Ag(S O)][Ag][S O]-+-(2) 硫酸三(乙二胺)合钴(Ⅲ)Co3+en en中的N6 333+3[Co(en)][Co][en]+(3) 四羟基合铝(Ⅲ)酸Al3+OH-OH-中的O4434[Al(OH)][Al][OH]-+-(4) 六氟合硅(Ⅳ)酸钠Si(Ⅳ) F-F-中的F 62646[SiF][Si][F]-+-(5) 五氯•氨合铂(Ⅳ)酸根Pt4+Cl-,NH3Cl,N 653453[Pt(Cl)(NH)][Pt][Cl][NH]-+-(6) 氯•硝基•四氨合铂(Ⅱ)Pt2+NO2-,Cl-,NH3N,Cl、N 6 2342423[PtCl(NO)(NH)][Pt][Cl][NO][NH]+--(7) 氯化二氯•三氨•水合钴(Ⅲ)Co3+Cl-,NH3,H2OCl,N,O 623323233[Co(Cl)(NH)(H O)][Co][Cl][NH]++-(8) 四(异硫氰酸根)•二氨合铬(Ⅲ)酸铵Cr3+NCS-,NH3N,N 64323423[Cr(NCS)(NH)][Cr][NCS][NH]-+-3. 什么是螯合物?螯合物有何特点?它的稳定性与什么因素有关?形成五员环和六员环的螯合物,要求配体应具备什么条件?解由中心原子与多齿配体形成有环状结构的配合物称为螯合物。


十一章 配位化合物首 页 难题解析 学生自测题 学生自测答案 章后习题答案难题解析 [TOP]例11-1(1)根据价键理论,画出[Cd(NH3)4]2+(μ=0μB)和[Co(NH3)6]2+(μ=3.87μB)的中心原子与配体成键时的电子排布,并判断空间构型。
(2)已知[Co(NH3)6]3+的分裂能Δo 为273.9kJ·mol -1,Co3+的电子成对能P 为251.2kJ·mol -1;[Fe(H2O)6]2+分裂能Δo 为124.4kJ·mol -,Fe2+的电子成对能P 为179.40kJ·mol -1。
根据晶体场理论,判断中心原子的d 电子组态和配离子自旋状态。
并计算晶体场稳定化能。
析(1)利用磁矩确定未成对电子数,然后确定内轨或外轨及杂化类型。
(2)比较分裂能与电子成对能,确定高自、自旋化合物,计算晶体场稳定化能。
解(1)[Cd(NH3)4]2+中Cd2+的电子组态为4d10,μ=0μB ,无未成对电子,采取sp3杂化轨道成键,配体NH3中N 的孤电子对填入sp3杂化轨道,配离子空间构型为正四面体。
4d sp3杂化[Cd(NH3)4]2+[Kr] ☜ ☜ ☜ ☜ ☜ ☜ ☜ ☜ ☜ 外轨配离子 电子由NH3中N 提供[Co(NH3)6]2+中Co2+的电子组态为3d7,μ=3.87μB ,利用B )1(μμ-=n n ,未成对电子数n=3,故以sp3d2杂化轨道成键,NH3中N 的孤电子对填入sp3d2杂化轨道,属外轨配合物,正八面体构型。
3d sp3d2杂化 4d[Co(NH3)6]2+ [Ar]☜ ☜ ✁ ✁ ✁ ☜ ☜ ☜ ☜ ☜ ☜电子由NH3中N 提供 外轨配离子 (2)[Co(NH3)6]3+中Co3+的电子组态为3d6,Δo >P ,属低自旋配合物。
电子排布为06d d γε,晶体场稳定化能为CFSE = xE (εd ) + yE (d γ) + (n2-n1) P =6×(-0.4Δo )+ 0×0.6Δo )+ (3-1)P=-155.1 kJ·mol -1[Fe(H2O)6]2+中Fe2+的电子组态为3d6,电子排布为24d d γε,Δo <P ,属高自旋配合物。

分子结构1.试用离子键理论说明由金属钾和单质氯反应,形成氯化钾的过程?如何理解离子键没有方向性和饱和性? 答:KCl 的形成表示如下: K(s)?K +(g)+e12Cl 2?Cl(g)Cl(g)+e ?Cl -(g) K +(g)+Cl -(g)=KCl(s)也2.3.ClF F 2(g)(1)(2)12(3)2?(1F 2ΔH ==2?=4.试根据晶体的构型与半径比的关系,试判断下列AB 型离子化合物的晶体构型: BeONaBrCaSRbIBeSCsBrAgCl解:查表求各离子的Pauling 半径如下表: Pauling 半径(pm)计算各物质的正负离子半径比以及相应晶体构型如下表:5.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少?NaFAgBrRbFHICuIHBrCsCl解:查表求出各元素的Pauling电负性数据如下表:所以说键。
(2)不合理,端边N原子的价电子数超出N原子的实际数目;(3)合理,单键可以看作是由N原子提供的配位键;(4)不合理,端边N原子的周围电子数不达到饱和结构;(5)不合理,端边N原子的周围电子数不达到饱和结构;(6)不合理,端边N原子的周围电子数不达到饱和结构,端边O原子的周围电子数超出饱和结构。
(b)(1)合理,负电荷可以看作是电子被吸引到S原子上;(2)不合理,端边N原子周围的电子数不达到饱和结构;(3)合理,负电荷可以看作是电子被吸引到N原子上;(4)不合理,负电荷可以看作是电子被吸引到N原子上,但S原子只有两个成单电子,由于它的半径较大,不可能形成共价叁键(O原子半径较小,可以形成叁键)。
(c)(1)合理,P原子周围虽然超出饱和结构,但它有3d价轨道,因此周围可以有10个电子;(2)不合理,N原子周围达不到饱和结构。
9.在下列各组中,哪一种化合物的键角大?说明原因。
(a)CH4和NH3(b)OF2和Cl2O11.试用价键法和分子轨道法说明O 2和F 2分子的结构。


第十一章 电化学基础11-1 用氧化值法配平下列方程式 (1)KCl KClO 3KClO 443+=(2)CO 30P 3CaF 2CaSiO 18SiO 18C 30F )PO (Ca 44232345+++=++ (3)O 2H NaCl N Cl NH NaNO 2242++=+(4)O H 7SO K )SO (Fe 3)SO (Cr SO H 7FeSO 6O Cr K 242342342424722+++=++ (5)Cs 2CaCl Ca CsCl 22+=+↑11-2 将下列水溶液化学反应的方程式先改写为离子方程式,然后分解为两个半反应式 (1)2222O O H 2O H 2+=O H e H O H 222222=++-+ -+++=e H O O H 22222(2)HClO HCl O H Cl 22+=+ -+++=+Cl H HClO O H Cl 22--=+Cl e Cl 221-+++=+e H HClO O H Cl 2221(3)O H 3KCl 5KClO KOH 6Cl 3232++=+O H 3Cl 5ClO OH 6Cl 3232++=+-----=+Cl 5e 5Cl 225---++=+e 5O H 3ClO OH 6Cl 23221(4)O H MnSO SO Fe SO K SO H FeSO KMnO 2434242424444)(528104+++=++O H 4Mn 2Fe 5H 8Fe 5MnO 222324++=++++++-O H 4Mn e 5H 8MnO 224+=+++-+--+++=e Fe Fe 3222(5)O H 7O 3)SO (Cr SO K SO H 7O H 3O Cr K 22342424222722+++=++O H O Cr H O H O Cr 22322272732143++=++++-O H 7Cr 2e 6H 14O Cr 23272+=+++-+--+++=e O H O H 2222211-3 用半反应法(离子-电子法)配平下列方程式:(1)K 2Cr 2O 7 + H 2S + H 2SO 4 → K 2SO 4 + Cr 2(SO 4)3 + S + H 2OCr 2O 72- + 14H + + 6e - === 2Cr 3+ + 7H 2O ① H 2S === S + 2H + + 2e - ② ①+3×②得:Cr 2O 72- + 3H 2S + 8H + === 2Cr 3+ + 3S + 7H 2OO H 7S 3)SO (Cr SO K SO H 4S H 3O Cr K 234242422722+++=++(2) -24MnO + H 2O 2 → O 2 + Mn 2+(酸性溶液)MnO 42- + 8H + + 4e- === Mn 2+ + 4H 2O ①H 2O 2 === O 2 + 2H =+ 2e - ② ①+2×②得:MnO 42- + 2H 2O 2 + 4H + - === Mn 2+ + 2O 2 + 4H 2O(3) Zn + NO 3– + OH – → NH 3 + Zn(OH)42–---+=++OH NH e O H NO 986323 ①---+=+e 2)OH (Zn OH 4Zn 24②①+4×②得: ---+=+++24323)(4674OH Zn NH O H OH NO Zn(4) Cr(OH)4-+ H 2O 2 → CrO 42---=+OH e O H 2222 ①Cr(OH)4-+ 4OH -=== CrO 42-+ 4H 2O + 3e -②①×3+2×②得: 2Cr(OH)4- + 3H 2O 2 +2OH -=== 2CrO 42-+ 8H 2O(5) Hg + NO 3–+ H + → Hg 22+ + NOO H 2NO e 3H 4NO 23+=++-+-①-++=e 2Hg Hg 222②①×2+3×②得: O H 4NO 2Hg 3H 8NO 2Hg 62223++=++++-11-4 将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号。

配合物课后习题答案解析课后习题答案8.1 区分下列概念:(1)接受体原⼦和给予体原⼦;(2)配位体和配位原⼦;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)⾼⾃旋配合物和低⾃旋配合物;(6)强场配位体和弱场配位体;(7)⼏何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中⼼部位的中⼼原⼦(可以是⾦属原⼦,也可是⾼价⾮⾦属原⼦)或离⼦与配体组成,前者提供空轨道,称接受体,即接受体原⼦,后者提供孤电⼦对,称给予体,给予体中直接提供孤电⼦对的原⼦即为给予体原⼦。
(2)配位个体中与中⼼原⼦或离⼦结合的分⼦叫配位体,简称配体;配位体中直接键合于中⼼原⼦的原⼦叫配位原⼦,亦即上述之给予体原⼦。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为⼴义的是路易斯酸与路易斯碱的加合物。
复盐是过去⽆机化学上对明矾、冰晶⽯、光卤⽯等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有⽐所谓复盐还复杂的;②从结构看,⽆论单盐还是复盐,都可认为是配合物;③复盐,⽆“复盐”⼀词完全是形式化。
论在晶体中,在溶液中都不存在所谓的“化学式单位”的。
从配位个体稳定性的观点,可将复盐看作是⼀类稳定性极⼩的配合物;由于存在着许多中间状态,显然⽆法在复盐和配合物之间确定出⼀条绝对的界线。
(4)从配合物的价键理论出发,凡配位原⼦的孤对电⼦填在中⼼原⼦或离⼦由外层轨道杂化⽽成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对⼤⼩,使得配合物中的电⼦可能有两种不同的排列组态,其中含有单电⼦数较多的配合物叫⾼⾃旋配合物,不存在单电⼦或含有单电⼦数少的配合物叫低⾃旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中⼼原⼦周围因排列⽅式不同⽽产⽣的异构现象,称为⼏何异构现象,常发⽣在配位数为4 的平⾯正⽅形和配位数为 6 的⼋⾯体构型的配合物中。

第十一章生物无机化学【习题答案】11.1 生物体内含有哪些必需元素?它们在周期表内的分布有什么特点?解:一般认为,温血动物有26种必需元素,包括10种痕量金属元素:Fe、Cu、Mn、Zn、Co、Mo、Cr、Sn、V、Ni;4种宏量金属元素:Na、K、Ca、Mg;12种非金属元素C、H、O、N、P、S、Cl、I、B、F、Si、Se。
生命必需元素在周期表中的位置,绝大部分分布在第一至第四周期,只有Mo、Sn和I 位于第五周期。
11.2 什么叫“离子泵”?叙述在生命体中的作用。
解:“离子泵”是一种酶,其产生主动传递作用,使Na+和K+离子向着高浓度的方向扩散,使细胞膜维持一定的电势差(60~100 mV)。
一般认为,离子泵所需能量源自ATP→ADP→ATP循环。
钠-钾“离子泵”产生的电势差在神经和肌肉细胞中主要负责神经脉冲的传递。
11.3 什么叫作酶?什么叫金属酶?什么叫金属激活酶?举例说明它们的主要区别。
解:酶是一类具有高度专一性、高效率催化作用的蛋白质,是生物体中的催化剂。
金属酶是酶中的一类,是以蛋白质大分子为配体的金属配合物。
金属激活酶指需要由金属离子或者金属配合物激活才能实现其催化功能的一类酶。
金属酶和金属激活酶的区别主要在于酶蛋白与金属离子的结合强度不同。
金属酶一般含有化学计量的金属离子作为辅因子,主要含有过渡金属离子Fe、Zn、Cu等,金属离子与蛋白肽链之间的结合牢固。
金属激活酶也需要金属离子的参与才能表现其活性,但金属离子或金属配合物与蛋白肽链结合较弱。
Mg2+是金属激活酶的重要辅因子。
11.4 叙述金属离子在金属酶中的化学作用。
解:金属离子在金属酶中的化学作用包括:(a)路易斯酸作用带正电荷的金属离子通过吸电子效应使底物局部显正电性,使羟基或水分子易于对底物进行亲核攻击,导致底物分子水解。
(b)桥联作用底物与酶蛋白同时结合于金属离子上,金属离子作为桥梁使得底物分子与酶分子更易接近,便于各种酶促反应的进行。
第十一章卤素和氧族思考题解析1.解释下列现象:(1)在卤素化合物中,Cl、Br、I可呈现多种氧化数。
解:因为Cl、Br、I原子的价层电子排布为ns2np5,当参加反应时,未成对的电子可参与成键外,成对的电子也可拆开参与成键,故可呈现多种氧化数。
(2)KI溶液中通入氯气是,开始溶液呈现红棕色,继续通入氯气,颜色褪去。
解:开始I-被CI2氧化成I2,使溶液呈现红棕色;继续通入氯气,I2被Cl2氧化成无色的IO3-,反应式如下:2I- + Cl2 I2 + 2Cl-I2 + 5Cl2 + 6H2O 2IO3-+ 10Cl-+ 12H+2.在氯水中分别加入下列物质,对氯水的可逆反应有何影响?(1)稀硫酸(2)苛性钠(3)氯化钠解:氯水中存在如下平衡:Cl2 + H2(2)加入苛性钠,平衡向右移动,有利于Cl2的歧化反应;(3)加入氯化钠,平衡向左移动,不利于Cl2的歧化反应。
3.怎样除去工业溴中少量Cl2?解:蒸馏工业溴时,加入少量KBr,使其发生下列反应:Cl2+2KBr →Br2+2KCl4.将Cl2通入熟石灰中得到漂白粉,而向漂白粉中加入盐酸却产生Cl2,试解释之。
解:因为上述过程发生了如下相应反应:40℃以下··3Ca(OH)2 + 2Cl2 Ca(ClO)2 + CaCl2 Ca(OH)2 H2O + H2OCa(ClO)2 + 4HCl 2Cl2 + CaCl2 + 2H2O5.试用三种简便的方法鉴别NaCl、NaBr、NaI。
解:(1)AgNO3(A)Cl-+Ag+→AgCl ↓白色(B)Br-+Ag+→AgBr ↓淡黄色(C)I-+Ag+→AgI ↓黄色(2)Cl2水+CCl4(A)2NaBr +Cl4→2NaCl +Br2在CCl4中呈桔黄色(B)2NaI +Cl4→2NaCl +I2在CCl4中呈紫红色(3)浓H2SO4(A)NaCl +H2SO4→NaHSO4 +HCl ↑(B)NaBr +H2SO4→NaHSO4 +HBr ↑2 HBr +H2SO4→Br2+2H2O +SO2 ↑使品红试纸褪色(C)NaI +H2SO4→NaHSO4 +HI ↑8HI +H2SO4→4I2+4H2O +H2S ↑使Pb(OAc)2试纸变黑6.下列两个反应在酸性介质中均能发生,如何解释?(1)Br2+2I-→2Br-+I2(2)2BrO3-+I2→2IO3-+Br2解:(1)E¢(Br2/ Br-)=1.065V>E¢(I2/I-)=0.5355V,反应能进行。
基础化学第十一章 配位化合物习题答案1. 解: (1)配合物的内界是配合物的特征部分,是由中心原子和配体组成;配合物中与配离子带相反电荷的离子称为配合物的外界。
(2)只含有一个配位原子的配体称为单齿配体,如NH 3、H 2O 、OH -、F -、Cl -、Br -等,含有2个或2个以上配位原子的配体称为多齿配体,如en 、EDTA 等。
(3)中心原子用2个次外层d 轨道、1个最外层s 轨道和3个最外层p 轨道进行杂化,这种杂化方式称为d 2sp 3杂化。
中心原子用1个最外层s 轨道、3个最外层p 轨道和2个最外层d 轨道进行杂化,这种杂化方式称为sp 3d 2杂化。
(4)中心原子全部用最外层空轨道进行杂化成键,所形成的配合物称为外轨型配合物。
中心原子用次外层d 轨道和最外层的ns 、np 轨道进行杂化成键,所形成的配合物称为内轨型配合物。
(5)同一中心原子形成的配位数相同的配合物中,单电子数较多的配合物称为高自旋配合物;单电子数较少的配合物称为低自旋配合物。
使d 轨道分裂程度较大的配体称为强场配体,如CN -、CO 等。
使d 轨道分裂程度较小的配体称为弱场配体,如H 2O 、F -、Cl -、Br -、I -等。
2. 解: 列表如下: 配合物 名 称中心原子 配体 配位原子配位数 1 二(硫代硫酸根)合银(Ⅰ)酸钠 Ag + S 2O 32- S 2 2 硫酸三(乙二胺)合钴(Ⅲ) Co 3+ en N 6 3 四羟基合铝(Ⅲ)酸钠 Al 3+ OH - O 4 4 五氯·氨合铂(Ⅳ)离子 Pt 4+Cl -、NH 3Cl -、N6 5 氯·硝基·四氨合铂(II ) Pt 2+ NO 2-,Cl -、NH 3 N 、Cl -、N 6 6氯化二氯·三氨·水合钴(Ⅲ)Co 3+Cl -、NH 3、H 2OCl -、N 、O63. 解: Pd 2+的价层电子组态为4s 24p 64d 8。
课后习题答案8.1 区分下列概念:(1)接受体原子和给予体原子;(2)配位体和配位原子;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)高自旋配合物和低自旋配合物;(6)强场配位体和弱场配位体;(7)几何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中心部位的中心原子(可以是金属原子,也可是高价非金属原子)或离子与配体组成,前者提供空轨道,称接受体,即接受体原子,后者提供孤电子对,称给予体,给予体中直接提供孤电子对的原子即为给予体原子。
(2)配位个体中与中心原子或离子结合的分子叫配位体,简称配体;配位体中直接键合于中心原子的原子叫配位原子,亦即上述之给予体原子。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为广义的是路易斯酸与路易斯碱的加合物。
复盐是过去无机化学上对明矾、冰晶石、光卤石等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有比所谓复盐还复杂的;②从结构看,无论单盐还是复盐,都可认为是配合物;③复盐,无“复盐”一词完全是形式化。
论在晶体中,在溶液中都不存在所谓的“化学式单位”的。
从配位个体稳定性的观点,可将复盐看作是一类稳定性极小的配合物;由于存在着许多中间状态,显然无法在复盐和配合物之间确定出一条绝对的界线。
(4)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨道杂化而成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对大小,使得配合物中的电子可能有两种不同的排列组态,其中含有单电子数较多的配合物叫高自旋配合物,不存在单电子或含有单电子数少的配合物叫低自旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中心原子周围因排列方式不同而产生的异构现象,称为几何异构现象,常发生在配位数为 4 的平面正方形和配位数为 6 的八面体构型的配合物中。
课后习题答案8.1 区分下列概念:(1)接受体原子和给予体原子;(2)配位体和配位原子;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)高自旋配合物和低自旋配合物;(6)强场配位体和弱场配位体;(7)几何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中心部位的中心原子(可以是金属原子,也可是高价非金属原子)或离子与配体组成,前者提供空轨道,称接受体,即接受体原子,后者提供孤电子对,称给予体,给予体中直接提供孤电子对的原子即为给予体原子。
(2)配位个体中与中心原子或离子结合的分子叫配位体,简称配体;配位体中直接键合于中心原子的原子叫配位原子,亦即上述之给予体原子。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为广义的是路易斯酸与路易斯碱的加合物。
复盐是过去无机化学上对明矾、冰晶石、光卤石等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有比所谓复盐还复杂的;②从结构看,无论单盐还是复盐,都可认为是配合物;③复盐,无论在晶体中,在溶液中都不从配位个体稳定性的观点,可将复盐看作是一类稳定性极小的配合物;由于存在着许多中间状态,显然无法在复盐和配合物之间确定出一条绝对的界线。
(4)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨道杂化而成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对大小,使得配合物中的电子可能有两种不同的排列组态,其中含有单电子数较多的配合物叫高自旋配合物,不存在单电子或含有单电子数少的配合物叫低自旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中心原子周围因排列方式不同而产生的异构现象,称为几何异构现象,常发生在配位数为 4 的平面正方形和配位数为 6 的八面体构型的配合物中。
第十一章 答案1. (1) MnO 2 + 4HCl(浓)2 + Cl 2 + 2H 2O(2) 2KMnO 4+ 16HCl(浓)2 + 5Cl 2 + 8H 2O + 2KCl (3) Na 2Cr 2O 7+ 14HCl(浓)3 + 3Cl 2 + 7H 2O + 2NaCl2. (1) 2S + Cl 22Cl 2 S + Cl 2(过量)2(2) PCl 3 + 3H 2O 3PO 3(3) 2ClO 2 + 2OH -2- + ClO 3-+ H 2O(4) KI + I 23 (5) 2F 2 + SiO 24 + O 23. (1) 2NaCl + 2H 2电解Cl 2↑ + H 2↑+ 2NaOH 2NaOH + Cl 2NaCl + H 2O (2) 6KOH + 3Cl3 + 5KCl + 3H 2O (3) 4KClO 34+ KCl(4) 6Ba(OH)2 + 6Cl 3)2 + 5BaCl 2 + 6H 2O(5) KClO 4 + H 2SO 44 + 2HClO 4(减压蒸馏分离)(6) 2Ca(OH)2 + 2Cl 22 + CaCl 2 + 2H 2O(7) Ba(ClO 3)2 + H 2SO 44↓ + HClO 34.(1) ClF 2- (2) BrF 3 (3) IF 5 (4) ClF 4- (5) BrF 4+ (6) ICl 2+ (7) OF 2 (8) H 4IO 6- AB 2E 3型 AB 3E 2型 AB 5E 型AB 4E 2型 AB 4E 型 AB 2E 2型 AB 2E 2型 AB 6型 不等性 sp 3d 杂化不等性 sp 3d 杂化不等性 sp 3d 2杂化不等性 sp 3d 2杂化不等性 sp 3d 杂化不等性sp 3杂化不等性 sp 3杂化等性sp 3d 2杂化-+BrF FF F+ClO I OHOOH OHHO-5. ClO 3-+0.50V−−−→ClO -+0.89V−−−→Cl -,ClO /Cl ϕ-->3ClO /ClO ϕ--,∴ClO -能歧化生成Cl -和ClO 3-。
第十一章 配合物结构之课后习题参考答案2解:(1)[CuCl 2]-的磁距为0。
(2)[Zn(NH 3)4]2+的磁距为0。
(3)[Co(NCS)4]2-的磁距为87.3)23(3=+⨯。
3解:(1)(2)(3)4解:(1)[Co(en)3]2+为外轨型(2)[Fe(C 2O 4)3]3-为外轨型(3)[(Co(EDTA)]-为内轨型5解:Ni 2+离子的价电子构型为:3d 8。
因Cl -为弱场配体,形成[NiCl 4]2-配离子时,其3d 轨道中的电子不会发生重排腾出空的3d 轨道,所以只能使用最外层的空轨道形成sp 3杂化,其空间构型为正四面体,[NiCl 4]2-含有2个未成对电子,其磁距=83.2)22(2=+⨯。
而CN -为强场配体,可使Ni 2+离子的3d 轨道上的电子重排,腾出1条空的3d 轨道,则采取dsp 2杂化,空间构型为平面正方形,无成单电子数,其磁距为0,所以是反磁性的。
6解:(1)[Ru(NH 3)6]2+中Ru 2+离子的价电子构型为4d 6, 形成配离子后处于低自旋状态, 即4d 上的成单电子重排成三对电子对, 无成单电子存在,其磁距为0.(2)[Fe(CN)6]3-中Fe 3+离子的价电子构型为3d 5, 形成配离子后处于低自旋状态, 即3d 上的成单电子重排成两对电子对, 有1个成单电子存在, 其磁距为73.1)21(1=+⨯.(3)[Ni(H 2O)6]2+中Ni 2+离子的价电子构型为3d 8, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有2个成单电子存在, 其磁距为83.2)22(2=+⨯(4)[V(en)3]3+中V 3+离子的价电子构型为3d 2, 本身3d 轨道就有3条是空的,形成配离子时不需重排, 有2个成单电子存在, 其磁距为83.2)22(2=+⨯。
(5)[CoCl 4]2-中Co 2+离子的价电子构型为3d 7, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有3个成单电子存在, 其磁距为87.3)23(3=+⨯。
第十一章 配合物结构之课后习题参考答案
2解:(1)[CuCl 2]-的磁距为0。
(2)[Zn(NH 3)4]2+的磁距为0。
(3)[Co(NCS)4]2-的磁距为87.3)23(3=+⨯。
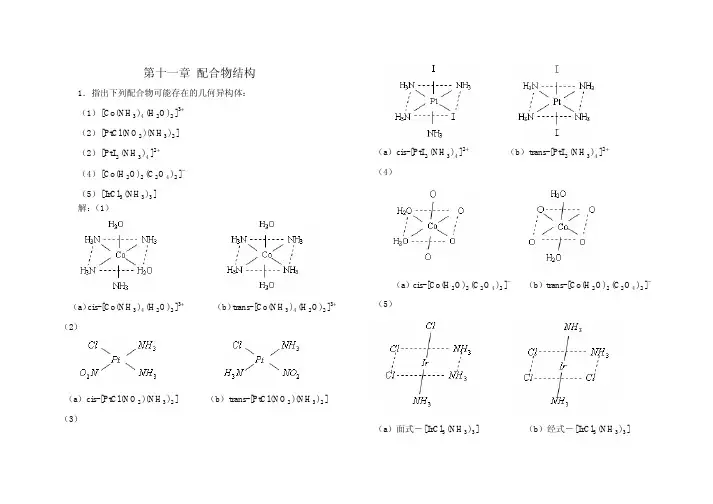
3解:
(1)
(2)
(3)
4解:(1)[Co(en)3]2+为外轨型
(2)[Fe(C 2O 4)3]3-为外轨型
(3)[(Co(EDTA)]-为内轨型
5解:Ni 2+离子的价电子构型为:3d 8。
因Cl -为弱场配体,形成[NiCl 4]2-配离子时,其3d 轨道中的电子不会发生重排腾出空的3d 轨道,所以只能使用最外层的空轨道形成sp 3杂化,其空间构型为正四面体,[NiCl 4]2-含有2个未成对电子,其磁距=83.2)22(2=+⨯。
而CN -为强场配体,可使Ni 2+离子的3d 轨道上的电子重排,腾出1条空的3d 轨道,则采取dsp 2杂化,空间构型为平面正方形,无成单电子数,其磁距为0,所以是反磁性的。
6解:(1)[Ru(NH 3)6]2+中Ru 2+离子的价电子构型为4d 6, 形成配离子后处于低自旋状态, 即4d 上的成单电子重排成三对电子对, 无成单电子存在,其磁距为0.
(2)[Fe(CN)6]3-中Fe 3+离子的价电子构型为3d 5, 形成配离子后处于低自旋状态, 即3d 上的成单电子重排成两对电子对, 有1个成单电子存在, 其磁距为73.1)21(1=+⨯.
(3)[Ni(H 2O)6]2+中Ni 2+离子的价电子构型为3d 8, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有2个成单电子存在, 其磁距为83.2)22(2=+⨯
(4)[V(en)3]3+中V 3+离子的价电子构型为3d 2, 本身3d 轨道就有3条是空的,形成配离子时不需重排, 有2个成单电子存在, 其磁距为83.2)22(2=+⨯。
(5)[CoCl 4]2-中Co 2+离子的价电子构型为3d 7, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有3个成单电子存在, 其磁距为87.3)23(3=+⨯。