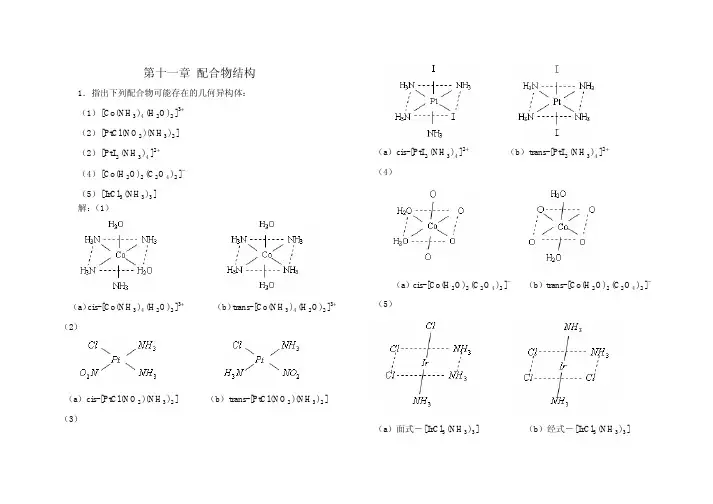
第十一章 配合物结构
- 格式:ppt
- 大小:6.02 MB
- 文档页数:77


配位化学讲义第十一章无机小分子配合物第十一章无机小分子配体配合物小分子配体的过渡金属配合物,已成为配位化学中发展最快的领域之一。
现已证实,小分子通过与过渡金属离子的配位而活化,进而可引起许多重要的反应。
第一节金属羰基(CO)配合物一、概述金属羰基配合物是过渡金属元素与CO所形成的一类配合物。
1890年,Mond和Langer发现Ni(CO)4,这是第一个金属羰基配合物。
常温、常压Ni(粉) + CO Ni(CO)4 (无色液体,m .p.= -25℃)150℃Ni(CO)4Ni + 4CO这成为一种提纯Ni的工艺。
现已知道,所有过渡金属至少能生成一种羰基配合物,其中金属原子处于低价(包括零价)状态。
二、类型1、单核羰基配合物这类化合物都是疏水液体或易挥发的固体,能不同程度地溶于非极性溶剂。
M-C-O键是直线型的。
例:V(CO)6 黑色结晶,真空升华V-C, 2.008(3) ÅCr(CO)6Cr-C, 1.94(4) ÅMo(CO)6无色晶体,真空升华,Mo-C, 2.06(2)Å 八面体W(CO)6W-C, 2.06(4)ÅFe(CO)5黄色液体,m.p.=20℃,Fe-C,1.810(3)Å(轴向)三角b.p.=103℃ 1.833(2)Å(赤道)双锥Ni(CO)4无色液体,m.p.= -25℃,Ni-C,1.84(4)Å四面体2、双核和多核金属羰基配合物多核羰基配合物可以是均核的,如:Fe3(CO)12;也可以是异核的,如MnRe(CO)10。
M在这类化合物中,不仅有M-C-O 基团, 而且还有O —C 和M-M 键,且M μ2-CO 常与M-M 键同时存在。
即: O —C 例:(1)Mn 2(CO)10为黄色固体,m.p.151℃,Mn-Mn=2.93Å OC CO OC COOC M M CO M=Mn 、Tc 、ReOC CO OC CO(2) Fe 2(CO)9 金色固体,m.p.100℃(分解),难挥发 OC CO COOC Fe Fe CO Fe 2(CO)9OC CO OC CO(3)Fe 3(CO)12 绿黑色固体,m.p.140-150℃(分解)OCCOFeO COCC OOC Fe C C Fe OCOCO CO CO COFe 3(CO)12(4)M 3(CO)12 M=Ru 、OsOCCOO COCC OOCC C OCOCO CO CO CO MMM*金属原子体积越大,越易形成非桥式结构。

有环状结构,被称为螯合物或内配合物。
2+同一配体的两个或两个以上的配位原子间有一个原子,这样才能形成比较配位化合物金属有机配合物SO4科学家鲍林CN -为强配体,使Co 3个d 电子重排中心采取d 2sp 3 杂化,配离子Co(CN)为正八面体构型。
3d4s4p d 2sp 3杂化过渡金属Ni 的d轨道与CO的π*能量相近,对称性一致,可以成键。
按重叠后的(C2H4) ]·H2Oσ配键d-pπ配键在八面体场中,六个配体沿x,y,z轴的个方向分布,以形成八面体场。
正八面体场中配体与d z2 轨道的相对位置,轨道的波瓣与六个配体正相对,d x 2-y 2d z 2球形场正八面体场中配体与d xy 轨道的相对位置,,轨道的波瓣不与配体相对,能量升高的少,低于球形场。
d xy d xz d yz 球形场坐标原点为正六面体的中心,三轴分别沿与三边平行的方向伸展。
4 个配体的位置如图所示,形成四面体场。
正四面体场中配体与d x 2-y 2 轨道的相对位置正四面体场中配体与d xy 轨道的相对位置d d d 球形场(d )球形场(d )坐标原点位于正方形中心,坐标轴沿正方形对角线方向伸展。
4个配位原子位于正方形的顶点,形成正方形电场。
yx-++--y 2d x 2-y 2轨道的波瓣与配体一一相对,受电场作用最大,能量最高。
d xy 轨道处于y 平面内,受电场作用较大,能量居第二位。
++--d xy yx轨道的环形波瓣在x O y 平面内,列第三位。
d z 2yx能量最低的是轨道和轨道d xz d yz ++--z d yzyz++--d xzxz2.影响分裂能大小的因素弱场强场 小大-----光谱化学序列弱场强场 小大X -,OH -等弱场配体△小,常有△< P ,取高自旋光谱化学序列中NO 2-,CN -,CO 等强场配体△大,常导致△> P ,取低自旋方式,强场低自旋。
高自旋排布(dε)4 (dγ)2 低自旋排布(dε)6 (dγ)05个d轨道的能量为零点。