第3节 原子基态的电子组态
- 格式:ppt
- 大小:329.00 KB
- 文档页数:10

基态原子电子组态(电子排布)量子力学假定每个电子的运动是独立的,又假定所有电子的相互作用力可以集中到原子核上,如同在原子核上添加一份负电荷。
对于基态原子,必须遵循如下原理:(1)泡利原理基态多电子原子中不可能同时存在4个量子数完全相同的电子。
换句话说,在一个轨道里最多只能容纳2个电子,它们的自旋方向相反。
(2)洪特规则基态多电子原子中同一能级的轨道能量相等,称为简并轨道;基态多电子原子的电子总是首先自旋平行地,单独地填入简并轨道。
(3)能量最低原理基态原子是处于最低能量状态的原子。
能量最低原理认为,基态原子核外电子的排布力求使整个原子的能量处于最低状态。
构造原理定义:随核电荷数递增,大多数元素的电中性基态原子的电子按能级交错填入核外电子运动轨道。
能级交错:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f →5d→6p……(能级交错现象是电子随核电荷递增填充电子次序上的交错,并不意味着先填能级的能量一定比后填能级的低。
)随核电荷数递增,电子每一次从填入ns能级开始到填满np 能级建立一个周期。
注意:构造原理只是对大多数元素的电中性基态原子电子组态的总结。
周期系中有约20种元素的基态电中性原子的电子组态不符合构造原理。
半满规则:5个d轨道各有一个电子,且自旋平行。
全满规则:d能级接近全满时倾向于全满。
铬的组态为(n-1)d5ns1,而不是(n-1)d4ns2。
铜金银基态原子电子组态为(n-1)d10ns1,而不是(n-1)d9ns2。
仔细考察元素周期表还可以发现,第5周期有较多副族元素的基态电中性原子的电子组态不符合构造原理,多数具有5s1的最外层构型,尤其是其中的钯(pb),电子组态为4d105s0,是最特殊的例子。

基态原子电子排布式1-36原子电子排布是指某一原子或原子核及其围绕着它的电子被分布在空间某一准确的位置上,它是原子结构中稳定状态的表现。
原子电子排布是一种量子统计学理论,通过能量状态对原子作用,被证明有可能实现量子状态下的原子的最低能量状态的基态,从而形成特定的电子排布。
以一种基态的电子排布来说,该竖向横向由子层,内子层和外子层组成,一般可以分为十字形和十字形的电子排布式。
一种基态的电子排布,可以从下表中得知:|主子层(K)| 1s²|| 2s²2p³||内子层(L)| 3s²3p³|| 4s²3d¹⁰||外子层(M)| 5s²4p⁴|| 6s²4d¹⁰5p⁶||7s²5d¹⁰6p⁶|这就是1-36元素基态原子电子排布式:1. H:1s¹2. He:1s²3. Li:[He]2s¹4. Be:[He]2s²5. B:[He]2s²2p¹6. C:[He]2s²2p²7. N:[He]2s²2p³8. O:[He]2s²2p⁴9. F:[He]2s²2p⁵10. Ne:[He]2s²2p⁶11. Na:[Ne]3s¹12. Mg:[Ne]3s²13. Al:[Ne]3s²3p¹14. Si:[Ne]3s²3p²15. P:[Ne]3s²3p³16. S:[Ne]3s²3p⁴17. Cl:[Ne]3s²3p⁵18. Ar:[Ne]3s²3p⁶19. K:[Ar]4s¹20. Ca:[Ar]4s²21. Sc:[Ar]3d¹4s²22. Ti:[Ar]3d²4s²23. V:[Ar]3d³4s²24. Cr:[Ar]3d⁴4s²25. Mn:[Ar]3d⁵4s²26. Fe:[Ar]3d⁶4s²27. Co:[Ar]3d⁷4s²28. Ni:[Ar]3d⁸4s²29. Cu:[Ar]3d⁹4s²30. Zn:[Ar]3d¹⁰4s²31. Ga:[Ar]3d¹⁰4s²4p¹32. Ge:[Ar]3d¹⁰4s²4p²33. As:[Ar]3d¹⁰4s²4p³34. Se:[Ar]3d¹⁰4s²4p⁴35. Br:[Ar]3d¹⁰4s²4p⁵36. Kr:[Ar]3d¹⁰4s²4p⁶以上就是1-36元素基态原子电子排布式,它是由不同能级上的子层来组成,包含主子层(K)、内子层(L)和外子层(M),每个子层中都有自己特有的分级电子排布式。

铍原子基态的电子组态
铍原子是一种元素,注意它们不像大多数剩余元素那样只具有一个基态,而是有一定数量的基态(3d,3p,3s)。
它们具有一个集群电子,形成一个原子核中心。
铍原子电子组态是由它们的能级对组成,这些能级按照占电子数越多越高的原则排列组合起来。
3d轨道是铍原子基态电子组态的最外层轨道。
它们有5个电子,分别位于每个轨道上方和下方的中心,当中还有一个分布在左右两边,因此当它们长度相等时,3d轨道上一共有10个电子。
3p轨道是次外层轨道,它们分布在每个轨道上方和下方。
每个轨道只有2个电子,因此每个原子上共有6个电子。
最内侧的占据3s轨道,有2个电子,一共有2个电子。
总的来说,铍原子基态的电子组态是由三个轨道(3d,3p,3s)组成,每个轨道上有相应的电子数量,它们按照能量级排列。
这些电子的分布和数量可以很容易追踪到铍原子的物理和化学性质,从而更好地理解物质的内部结构。

原子的基态的电子组态原理
原子基态的电子组态原理可以归纳为以下步骤:
第一步,确定原子的电子组成
原子的电子组成由原子序数Z决定,即原子包含Z个电子。
例如氢原子的Z为1,只有1个电子;碳原子的Z为6,有6个电子。
第二步,构建电子组态
根据泡利不相容原理,每个原子轨道至多只能容纳2个电子,且电子间最多只能配对成反对易旋。
根据轨道能级由低到高的顺序填充电子。
第三步,确定最低能级
电子依次填充能级低的轨道,当电子数等于原子序数Z时,此时的电子组态对应的总能量最低,为原子的基态。
第四步,绘制电子组态图
将每个电子填入对应的原子轨道,用箭头表示电子自旋方向。
轨道旁标注电子数,画出原子基态的电子组态结构图。
第五步,核查泡利原理
核查每层轨道电子数是否超过2,相邻电子旋转方向是否一致,电子组态是否符合能量最低原理。
第六步,指定术语
使用1s2、2p5等标准化术语准确表达电子排布情况。
s轨道最多2电子,p轨道最多6电子,d轨道最多10电子。
第七步,添加4量数
在电子组态图上补充每个电子的4量数(n、l、ml、ms),完整表示每个电子的量子数特征。
第八步,描述基态性质
根据基态电子组态,分析原子的磁性、光谱特性等,描述原子基态的物理化学性质。
综上步骤,通过确定电子数、填充顺序、遵守原理等,可以系统地分析和表达原子基态的电子组态,反映原子内部电子结构与化学性质的关系。
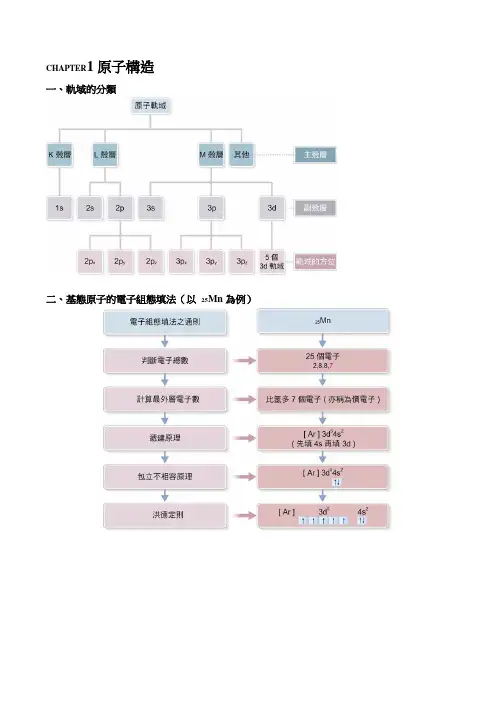
CHAPTER1原子構造一、軌域的分類二、基態原子的電子組態填法(以25Mn為例)三、原子各性質的大致趨勢1-1 氫原子光譜1. 不同波長的電磁波所呈現出來的能量各不相同,波長愈短、頻率愈高的電磁波其能量愈大。
2. 白色光透過三稜鏡所產生的光譜,其頻率由較低的紅光到較高的紫光全部都存在,由於頻率是連續的,故稱為連續光譜。
3. 焰色試驗法所得到的光譜,只含有特定波長而且不連續,因此稱為線光譜,亦稱為不連續光譜。
4. 物理學家芮得柏發展出芮得柏公式,可求出氫原子光譜中任何一條譜線的波長:1λ=R ×(1n f2-1n i2)其中R為芮得柏常數,相當於1.097 × 10-2 nm-1,n i、n f為整數,而n i大於n f。
1-2 波耳氫原子模型與氫原子能階5. 波耳的氫原子模型認為電子只能在某些固定的距離圍繞原子核運行,此時電子將不輻射能量而呈穩定態。
氫原子的電子在n=1時為最安定態,稱為基態。
1-3 原子軌域6. 電子在核外的運動情形並無固定的軌道,但其在原子核四周出現的機率已能被推算出來。
若將出現機率總和90%以上的各點勾畫出來,稱為軌域。
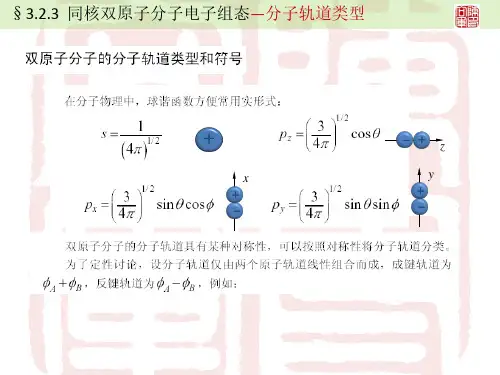
1-4 電子組態7. 依主量子數(n)的不同,軌域區分為許多主殼層,每一主殼層內有n2個不同的軌域。
8. 依角動量量子數的不同,軌域依據形狀可區分出s、p、d、f等不同的副殼層,其中s軌域的形狀呈球形對稱,p軌域為啞鈴形,d和f軌域的形狀則較複雜。
9. 除了s軌域以外,主殼層中相同形狀的軌域,即其角量子數亦相同者,會因為在空間方位的分布不同(即磁量子數不同),形成能量相同而空間排列不同的軌域,例如p軌域有p x、p y及p z三種空間分布不同的軌域。
10. 除少數例外,多電子原子中的電子可依據下列規則排列,以得到基態的電子組態:(1) 遞建原理:從最低能量的軌域開始填起。
(2) 包立不相容原理:任一軌域最多只能填入兩個電子,且自旋方向必須相反。


《原子物理学》教学大纲一、教学目的与任务课程性质:《原子物理学》是物理教育专业的专业必修课程。
本课程着重从物理实验规律出发,引进近代物理关于微观世界的重要概念和原理,探讨原子、原子核及基本粒子的结构和运动规律,解释它们的宏观性质,以及在现代科学技术上的重大应用。
本课程强调物理实验的分析、微观物理概念、物理图像和物理模型的建立和理解。
教学目的:物理学对物质微观结构的研究已经从原子层次深入到了原子核及基本粒子等层次,原子物理学又作为进一步学习原子层次以下其它物质微观结构层次的起点,通过原子物理学课程的学习,使学生掌握原子结构及核结构图象,原子的能级与辐射,外磁场对原子的作用、原子光谱规律及其产生机制等知识,使学生逐步掌握原子物理学中的实验事实和基本规律、基本原理及研究有关问题的思路和方法,培养学生发现和提出问题、建立物理模型、定性分析与定量计算的能力、理论联系实际的能力和独立获取知识的能力,开阔学生的思路,激发学生的探索和创新精神,提升其科学技术的整体素养,并为进一步学习量子力学、固体物理学及近代物理实验等课程打好基础。
二、教学基本要求从原子结构模型出发使学生对原子的结构有个初步认识,理解原子核式结构,掌握原子能级概念和光谱的一般知识;理解氢原子的波尔理论,了解伏兰克-赫兹实验;了解氢原子能量的相对论效应;了解斯特恩-盖拉赫实验,理解原子的空间取向量子化;了解碱金属光谱的精细结构,电子自旋与轨道的相互作用;理解两个价电子的原子态,了解泡利原理;理解原子磁矩及外磁场对原子的作用,了解顺磁共振和塞曼效应;掌握原子的壳层结构和原子基态的电子组态;了解康普顿效应,理解X射线的衍射。
三、教学内容、要求与学时分配绪论 2学时介绍原子物理学的地位与作用、研究对象与研究方法、发展史以及学习上应注意的问题。
第一章原子的基本状况 3学时1.1 原子的质量和大小 1学时1.2 原子核式结构 1学时1.3 同位素 1学时教学重点与难点:(1)卢瑟福原子核式结构模型;(2)α粒子散射理论与卢瑟福散射公式及其应用。


钠原子基态的电子组态和原子态
钠原子基态的电子组态和原子态是化学中一个重要的话题。
钠原子由一个核和十一个电子组成,其电子组态为1s22s22p63s1。
它的原子态是由一个1s2电子和两个2s2电子组成的,这三个电子构成了钠原子的外层电子结构。
因此,钠原子的电子组态与原子态之间有着密切的关系。
此外,钠原子的电子组态受到外部电场的影响,可以发生变化。
当外部电场的强度足够大时,钠原子的电子组态会发生变化,从而使钠原子的原子态也发生变化。
例如,钠原子可以在外部电场的作用下,由1s22s22p63s1变为1s22s22p53s2,这种变化使钠原子的原子态也发生了变化,从而使钠原子的性质也发生了变化。
综上所述,钠原子基态的电子组态和原子态之间有着密切的关系,而且钠原子的电子组态受到外部电场的影响,可以发生变化,从而使钠原子的原子态也发生变化,从而改变钠原子的性质。

原子在基态电子组态时的基谱项的确定
原子在基态电子组态时的基谱项是最重要的基本结构。
它表明了原子的结构特征,也被称为原子基态配置的核心结构特征。
这些结构特征反映了形成原子的基础,可以被用来标记和描述原子模型。
因此,加以准确描述原子的基谱项并能确定出多少能量级的存在,是电子组态的关键步骤。
一般来说,原子在外层通常有几个电子,从最外层开始,逐步放入第二层,第
三层,直到把所有电子都按原子核相对应的能量级进行分布,即为原子在基态电子组态时的基谱项。
为了确定基谱项所需要的结构特征,科学家们首先要搞清楚原子的能级结构,
然后从它的能量级中分离出来那些属于外层的能级。
然后,通过紧凑的能级构建工具,对每个紧凑层进行比较,以确定每层之间的两两能级之间的关系,从而分析出原子的基本结构。
之后,由量子数动态定义,确定原子基态电子组态时基谱项的具体构成和存在的能量级。
因此,完整正确的描述原子的基谱项是电子组态的关键步骤,也是确定原子结
构特征的重要依据。
它的确定需要结合对原子能量级结构的熟悉、量子数动态定义以及紧凑能级构建工具的应用,才能获得可靠、准确的结果。
基态原子的电子排布式构造原理
基态原子的电子排布是定义一个原子最低能量状态的重要参数,它由原子的电子数以及原子的总轨道数共同决定,决定了一个原子的化学和物理性质。
常见的基态原子其电子排布可通过建立多重态电子构造概念来描述,其电子若在原子的轨道中分布的总自旋结果为:若单电子轨道上的自旋为旋转(即有旋转分量),其运动动量在该轨道上定向构成,称为单态构造;若多电子轨道上,存在两个自旋分向相反,动量定义了一维或二维偶极分布,这种构造叫做双态构造;若存在三个自旋分向,动量的偶极分布构成了三维的偶极分布,此种构造叫三态构造;若此种情况继续发展,则会得到N态构造。
为保持最低能量,原子不得不选择能量最低的构造。
量子数决定原子选择不同态构造的能量水平。
传统上,有关基态原子的电子排布往往采用Aufbau(建立)原则来说明。
该原则推荐原子将一个电子放入能量最低的框架内,转到更高的框架,比如将最低能量轨道从s轨道填满s轨道,然后再填满p轨道,d轨道,f轨道,这样能量变得越来越高;而Pauli排斥原则认为,它规定每一个轨道中最多只能放置两个电子,其中一个以正转方式(spin up)旋转,另一个以反转方式(spin down)旋转,而且这两个电子的自旋必须相反。
因此,原子选择满足Pauli排斥原则的构型,当所有电子按照Pauli排斥原则排列时,原子就处于具有最低能量的态。
因此,基态原子的电子排布可以由多重态构造概念描述,其电子分布总自旋结果为:单态构造,双态构造,三态构造,等多态构造,为保持最低能量,原子不得不遵循Aufbau原则以及Pauli排斥原则所决定的电子排布。
只有满足这些原则的电子排布,原子的基态能量才能达到最低。
电子组态electron configuration
原子内电子壳层排布的标示。
又称电子构型。
原子中的电子排布组成一定的壳层,例如,硅原子的电子组态是1s22s22p63s23p2,表示其14个电子中2个排布在1s态,2个排布在2s态,6个排布在2p态,2个排布在3s态和最后 2 个电子排布在3p态,有时可简示为[Ne]3s23p2。
如果一个电子激发到4s态,则相应的电子组态为1s22s22p63s23p 4s。
或简示为[He]3s2 3p 4s。
电子组态清楚地显示出核外电子的排布状况。
将分子体系中电子按Pauli不相容原理填充在轨道中,分子轨道按能量顺序排列,也可以得到分子的电子组态
例如氢氧分子的电子组态:
H2 (σ1s)2
O2 KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)1
定义:由n,l所决定的一种原子(或离子)中的电子排布方式。
钠原子基态的电子组态和原子态
钠原子(Na)是化学元素表中最丰富的金属元素之一。
它的这种特性使它在很多科学研究领域中得到广泛应用,特别是在材料科学和化学工程学领域。
因此,人们对于钠原子的基态电子组态和原子态有着浓厚的兴趣。
本文将探讨钠原子的基态电子组态和原子态。
首先,让我们看看钠原子的基态电子组态是怎样的。
钠原子属于单原子元素,在其基态电子组态中共有11个电子,其中2个在衰变前占据1s轨道,然后2个在2s轨道,6个在2p轨道,以及1个在3s轨道上。
因此,钠原子的基态电子组态表示为:[Ne]3s,2p。
其次,让我们来探讨钠原子的原子态。
钠原子的原子态是通过原子构型中给定的电子数来决定的。
原子态可以分为内核态和外层态。
钠原子的内核态为1s2s2p,其中1s和2s分别表示一层有两个电子,2p表示二层有六个电子。
因此,钠原子的原子态可以表示为1s2s2p。
最后,让我们看看钠原子的光谱。
钠原子的光谱由三类光谱线组成,分别是英国的Lyman系列,半瑞的Bailey系列和丹瑞的Schumann-Runge系列。
其中,Lyman系列是由原子电子从一层过渡到另一层的紫外线所组成,而Bailey系列则是一层电子从量子状态3发射出来的可见光。
此外,Schumann-Runge系列则是由一个原子电子从分子态过渡到另一个分子态的可见光组成的。
综上所述,本文介绍了钠原子的基态电子组态和原子态,以及其光谱的组成。
这一知识对于我们理解钠原子的特性,以及进一步深入研究它非常重要。